一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产γ-氨基丁酸转化条件的优化
2012-02-09田灵芝徐美娟饶志明
田灵芝,徐美娟,饶志明
江南大学工业生物技术教育部重点实验室 江南大学应用微生物与代谢工程研究室,江苏 无锡 214122
γ-氨基丁酸 (简称 GABA) 是一种在中枢神经系统中有效的抑制性神经递质[1],具有许多重要的生理功能,如降血压、保持神经安定[2]、增强记忆、调节激素分泌、促进生殖、保肝利肾等[3]。近年来,GABA的研究和应用受到了广泛的关注。目前,国内外主要采用化学合成法[4]和微生物法[5]制备GABA,化学合成法反应条件剧烈,污染严重[6];微生物发酵法条件温和、安全、成本较低,但后处理过程复杂且生产周期长[7-8];而全细胞转化法合成GABA可提高底物转化率和产品纯度,简化后处理工序、缩短生产周期且降低环境污染,因此受到国内外研究者的广泛重视[9]。
本实验室前期通过菌种筛选获得一株植物乳杆菌,此菌株具有较高的谷氨酸脱羧酶活力,原始菌株摇瓶水平转化24 h,GABA的产量可达到34.66 g/L[10],原始菌株经诱变处理后5 L发酵罐全细胞转化24 h,GABA浓度达到65.45 g/L,摩尔转化率为 97.56%,产量明显高于其他同类菌株。但是,由于植物乳杆菌是兼性厌氧微生物,培养条件较难控制且培养条件的变化对 GABA的生产效率影响比较显著;同时,GAD是生物催化 L-谷氨酸脱羧反应生成 γ-氨基丁酸的限速酶,反应方程式如下:

在植物乳杆菌野生菌株中各酶的表达量受到菌体自身代谢水平的调控[11],因而其GAD的本底表达量不高导致了全细胞转化效率受限。鉴于此,本研究拟通过构建GAD高表达型重组大肠杆菌,借助大肠杆菌生长迅速、易于高密度培养和 GAD表达可以人工调控的优点进行GABA高效率生产。另外,通过对该酶的酶学性质进行研究,即酶的热稳定性、pH稳定性及温度、pH与酶活性的关系,几种金属离子对酶活的影响,来确定该酶作用的合适条件指导全细胞转化法合成 GABA,并为工业化制备GABA提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌 Escherichia coli JMl09、BL21 (DE3) 由本实验室保藏,植物乳杆菌Lactobacillus plantarum GB 01-21由本实验室筛选并诱变获得,克隆载体pMDl8-T购自TaKaRa公司,质粒pET-28a (+) 购自Novagen公司。
1.1.2 培养条件及培养基
培养温度37 ℃,旋转式摇床转速200 r/min,氨苄青霉素浓度为100 mg/L,卡那霉素浓度为50 mg/L筛选转化子,IPTG 诱导终浓度为0.5~1 mmol/L。
重组菌摇瓶种子培养基 (g/L):葡萄糖1.0,蛋白胨3.0,玉米浆1.5,NaCl 0.3,K2HPO40.1,MgSO4·7H2O 0.05。在pH 6.5~7.0、121 ℃下灭菌10 min。
重组菌发酵培养基 (g/L):葡萄糖5.0,蛋白胨 10,玉米浆 7.5,NaCl 0.5,K2HPO40.1, MgSO4·7H2O 0.05,L-谷氨酸1.0,生物素2×10−5。pH 6.5~7.0、121 ℃下灭菌10 min。
1.1.3 主要试剂和仪器
质粒小量抽提试剂盒、胶回收试剂盒购自北京博大泰克生物基因技术有限公司。工具酶、IPTG购自TaKaRa公司。咪唑和抗生素购自上海Sangon公司。丙烯酰胺、甲叉双丙烯酰胺(American Promega Corporation)、广范围蛋白质分子量标准购自Fermentas公司。PCR引物由上海赛百盛基因技术有限公司合成。其他试剂均为国产试剂纯。5 L发酵罐购于上海保兴生物设备工程有限公司,氨基酸自动分析仪为日立835-50型,2619#树脂 (阳离子交换柱Φ 2.6 mm×150 mm)。
1.2 方法
1.2.1 谷氨酸脱羧酶基因的克隆
根据 NCBI中植物乳杆菌 Lactobacillus plantarum subsp. plantarum ST-Ⅲ (GI:308044682)全基因组核酸序列3 254 376 bp中的lpgad基因序列设计谷氨酸脱羧酶编码基因的引物,上游引物P1:5′-GACGGATCC ATGGACCAGAAGCTG TTAAC-3′;下游引物P2:5′-GGCGCGGCCGCCA GGTGTGTTTAAAGCTGTT-3′ (下划线分别表示BamH Ⅰ和Not Ⅰ酶切位点)。提取Lactobacillus plantarum染色体为模板,利用已设计好的引物PCR扩增获得目的基因片段,PCR扩增条件为:94 ℃ 5 min ;94 ℃ 50 s,57 ℃ 1 min 30 s, 72 ℃2 min,35个循环;72 ℃延伸10 min。所得片段经胶回收后与克隆载体pMDl8-T连接,转化E. coli JMl09,经过氨苄青霉素抗性平板筛选,挑取阳性转化子。提取质粒酶切鉴定,将重组质粒命名为T-Lpgad,测序由上海Sangon公司完成。
1.2.2 重组质粒 pET-28a-lpgad的构建及 GAD在大肠杆菌BL21中的表达
将 T-lpgad用 BamH Ⅰ和 Not Ⅰ进行双酶切,胶回收lpgad片段,将其与经相同双酶切处理获得的线性化载体pET-28a (+) 混合,加入T4 DNA连接酶,16 ℃过夜连接,再转化大肠杆菌BL21 (DE3) 感受态细胞,卡那霉素抗性筛选阳性菌落,提取质粒,进行双酶切验证,将符合预期结果的阳性转化子接种至含卡那霉素 (终浓度为50 mg/L) 的LB培养基中,37 ℃振荡培养过夜,次日按1%接种量转接,37 ℃培养至OD600约0.6~0.8,加入IPTG至终浓度为0.5 mmol/L,16 ℃过夜诱导表达[12]。
1.2.3 SDS-PAGE
采用5%的浓缩胶及12%分离胶的不连续垂直平板电泳进行蛋白分离,考马斯亮兰R-250染色[13]。
1.2.4 谷氨酸脱羧酶的纯化
将过夜诱导表达的菌液于10 000 r/min、4 ℃离心15 min,收集菌体,用PBS缓冲液 (pH 7.4)悬浮菌体,超声波破碎细胞,然后经0.45 μm滤膜过滤后上柱,经Ni-NTA纯化[13],得到纯化后的GAD。
1.2.5 谷氨酸脱羧酶活力的测定
采用比色法[14],首先配制底物溶液Macllvaine缓冲体系 (0.2 mol/L,pH 4.8,含0.1 mmol/L PLP,0.4 mol/L底物L-谷氨酸钠),取200 μL底物溶液和100 μL酶液在30 ℃反应一定时间,置于冰浴中,加入200 μL 0.2 mol/L硼酸缓冲液 (pH 9.0) 终止反应;再加入1.0 mL 6%苯酚和400 μL次氯酸钠溶液,充分振荡后,沸水浴中反应10 min,迅速在冰浴中冷却显色20 min,然后测定630 nm处吸光值变化。酶反应体系中 GABA的量以标准曲线确定,相对活力以单位时间内A630的变化表示,一个酶活力单位 (U) 定义为在测定条件下每分钟产生1 μmol GABA所需的酶量。
1.2.6 蛋白质含量测定
粗酶液蛋白质含量采用Bradford法[15]测定,以BSA为标准蛋白。
1.2.7 谷氨酸脱羧酶的酶学性质研究
最适pH及pH稳定性:配制pH 3.6~6.0的醋酸-醋酸钠反应缓冲液,30 ℃下将酶液分别与不同pH的反应液混合,测定GAD在不同pH反应体系中的酶活,考察pH对酶促反应的影响。再将一定量的酶液加入到以上不同pH的反应缓冲液中,30 ℃下分别保温2 h,测定剩余酶活,考察GAD在不同pH条件下的稳定性。
最适温度及热稳定性:采用pH 4.8的反应缓冲液,分别在20 ℃、25 ℃、30 ℃、35 ℃、37 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃下测定酶活,研究温度对酶反应的影响。将酶液置于以上不同温度下保温2 h、4 h、6 h、8 h、10 h,测定剩余酶活,考察GAD在不同温度下的稳定性。
不同金属离子及EDTA对酶活的影响:在反应液中分别加入终浓度为 1 mmol/L的 Ca2+、Mg2+、K+、Fe2+、Fe3+、Cu2+、Mn2+、Zn2+、Na+、Ag+、Al3+、Li2+以及EDTA,30 ℃下测定GAD酶活,以不加金属离子的反应液作为对照,研究不同金属离子对其酶促反应的影响。另外,对具有明显激活作用的金属离子,配制不同的浓度进行梯度实验测定。
Km值及Vmax的测定:配制不同浓度的L-谷氨酸钠底物溶液,分别与酶液在30 ℃下反应,采用双倒数作图法确定GAD的Km及Vmax值。
1.2.8 重组大肠杆菌转化L-谷氨酸产GABA
将斜面保藏的菌种接种至 50 mL (装液量为10 mL) LB培养基中,于旋转式摇床中37 ℃、160 r/min培养12 h进行活化,再以5%的接种量接入500 mL摇瓶 (装液量为100 mL) 种子培养基中培养菌体,按上述条件培养 24 h得到种子液,按 10%的接种量将培养好的种子液接入5 L全自动发酵罐 (装液量为3 L),先于37 ℃、250 r/min培养至OD600为0.6,再向其中添加乳糖至终浓度为1 g/L,同时在线控制pH 6.8流加葡萄糖,30 ℃诱导发酵14 h至OD600为13.6,发酵结束后将培养好的菌体全部离心收集,双蒸水洗涤3次,用2 L乙酸-乙酸钠缓冲液 (pH 5.0)悬浮菌体,添加底物L-谷氨酸进行全细胞转化,5 L发酵罐转化条件:30 ℃、 250 r/min、120 L/h,转化24 h后,加入15%的三氯乙酸终止反应,取1 mL进行适当稀释后,氨基酸自动分析仪测定转化液中GABA的量。
2 结果与分析
2.1 谷氨酸脱羧酶基因的克隆及分析
提取植物乳杆菌全基因组 DNA,用设计的引物进行扩增,得到长度为1 410 bp、编码469个氨基酸的基因片段 (图1),连接pMDl8-T载体测序。Blast分析结果表明,扩增获得的基因核苷酸序列与 NCBI中公布的 lpgad基因序列(GenBank Accession No. ADO00011.1) 同源性高达 99.36%,其相差 9个碱基,4个氨基酸。L. plantarum GB 01-21基因 lpgad已提交至GenBank数据库 (Accession No. JN248358)。

图1 lpgad基因的PCR扩增Fig. 1 PCR amplification of lpgad gene. 1: DL2 000 marker; 2: PCR products.
2.2 重组大肠杆菌表达载体的构建
将T-lpgad用BamHⅠ和NotⅠ进行双酶切,胶回收 lpgad片段,将其与经相同酶切线性化的pET-28a (+) 载体连接,酶切验证,重组质粒经BamHⅠ和NotⅠ进行双酶切,释放5 369 bp和 1 410 bp大小的片段 (图 2),分别对应于pET-28a (+) 和lpgad的大小,结果表明重组质粒构建成功,将其命名为pET-28a (+) -lpgad。

图2 质粒pET-28a (+) -lpgad的酶切验证Fig. 2 Identification of pET-28a (+) -lpgad by enzyme digestion. M1: λDNA/Hind III marker; 1: pET-28a (+)-lpgad digested with BamH I; 2: pET-28a (+) -lpgad digested with BamH I and Not I; M2: DL2 000 marker.
2.3 lpgad基因在E. coli BL21 (DE3) 中表达与重组蛋白GAD的纯化
将pET-28a (+) -lpgad转入BL21 (DE3),在卡那霉素抗性 LB平板上挑选阳性转化子,即pET-28a (+) -lpgad/BL21 (DE3),IPTG诱导后的菌液经超声波破碎细胞,上清液SDS-PAGE分析,检测到一条分子量约为53 kDa的特异性条带,与报道的目标蛋白大小一致[16],如图3所示。上清液测得比酶活为8.53 U/mg,是植物乳杆菌破碎细胞后粗酶液酶活的4.24倍。本实验选用的表达载体pET-28a (+) 中含有6·His-Tag编码序列,采用Ni-NTA纯化谷氨酸脱羧酶GAD。纯化后的GAD经SDS-PAGE分析结果见图3,可看出经过纯化后得到相对单一的条带,基本上可以认为已得到相对较纯的GAD酶蛋白。纯化后酶液的比酶活达到32.45 U/mg,是纯化前粗酶液酶活的3.8倍,回收率达53.32%。结果见表1。
2.4 谷氨酸脱羧酶GAD的酶学性质研究
2.4.1 最适pH及pH稳定性
GAD在pH 3.6~6.0范围内反应时测定其酶活,由图4可见,最适pH为4.8,与已报道的微生物来源的GAD反应最适pH在4~5之间[17-19]基本一致。pH稳定性方面,将GAD在pH 3.6~6.0不同pH条件下处理2 h后测定酶活性,GAD在pH 3.6~5.0范围内保温2 h后均能保持80%以上的酶活力,pH值大于5.2,酶活降低较为明显,说明该GAD在酸性环境下相对稳定,具有较高的酸依赖性。
2.4.2 最适温度及热稳定性
在20 ℃~70 ℃范围内进行GAD酶促反应,测得的酶活结果见图5,由图可知该GAD在低温度范围内,随着温度的升高,酶活呈上升趋势,37 ℃时酶活性达到最高,温度再继续升高,酶活则呈下降趋势。热稳定性试验结果如图 5所示GAD在20 ℃~40 ℃较稳定,水浴保温10 h后相对酶活仍在85%以上,说明该酶在此温度范围内具有较高的稳定性,随着温度的升高,酶稳定性逐渐下降,到达60 ℃时水浴保温2 h,GAD迅速失活,几乎检测不到酶活且酶液出现絮状沉淀,酶可能完全变性失活。
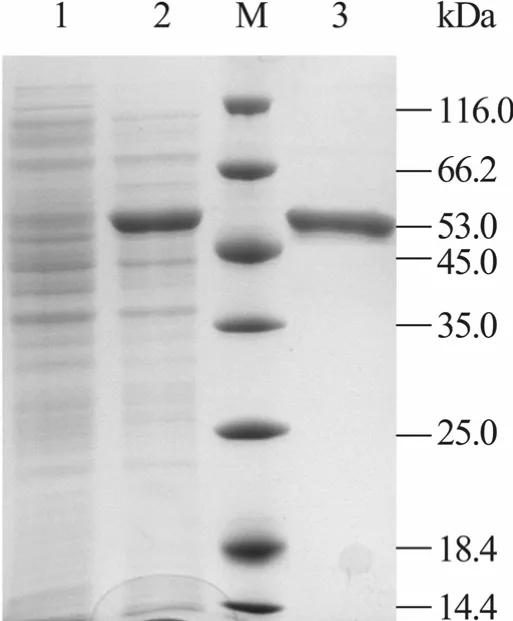
图3 表达和纯化产物的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of expressed and purified GAD. 1: supernatant of E. coli Bi21; 2: supernatant of E. coli B121 with recombinant plasmid pET-28a (+) -lpgad; M: protein marker (kDa); 3: purified GAD.

表l 重组蛋白GAD纯化表Table l Purification of recombinant GAD

图4 谷氨酸脱羧酶的最适pH范围及其pH稳定性Fig. 4 The optimal pH (A) and pH stability (B) of GAD.
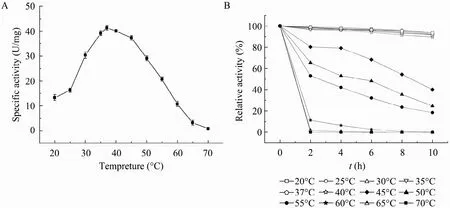
图5 谷氨酸脱羧酶的最适反应温度及其热稳定性Fig. 5 The optimal temperature (A) and thermal stability (B) of GAD.
2.4.3 不同金属离子及EDTA对酶活性的影响
金属离子经常可以作为酶促反应的辅助因子,因此在酶促反应中经常添加某些金属离子来促进酶促反应的进行。在GAD酶促反应中添加各
种金属离子以及 EDTA,其中以不加离子时的反应液作为对照,设其酶活为100%,其对GAD酶活的影响结果见表2。可以看出Mn2+、Fe2+、Fe3+、Ag+、Cu2+均对植物乳杆菌GAD的活力有较大的抑制作用,Li+、K+、Na+等对活性影响不明显,Ca2+、Mg2+对该酶有较强的激活作用。为了进一步研究Ca2+、Mg2+对该重组酶GAD的影响,考酶活达 131%,可以考虑全细胞转化体系中添加Ca2+、Mg2+作为GAD酶促反应的辅助因子,以期提高反应体系中GAD酶活,增强其转化L-谷氨酸产GABA能力。察了两种不同浓度金属离子对重组酶 GAD的影响,确定最佳激活浓度,如图6所示:2.5 mmol/L Ca2+时激活作用最明显,相对酶活达 154%,3.5 mmol/L Mg2+对重组酶GAD的激活作用最强,

表2 金属离子及EDTA对GAD酶活性的影响Table 2 Effect of metal ion and EDTA on the activity of GAD

图6 不同浓度Ca2+、Mg2+对GAD酶活的影响Fig. 6 Effect of different concentration Ca2+ (A) and Mg2+ (B) on the activity of GAD.
2.4.4 谷氨酸脱羧酶Km值和Vmax测定
根据不同底物浓度与酶促反应的关系,按照米氏方程,采用Lineweaver-Burk作图法,求重组GAD的表观米氏常数,如图7,可以得到Km为9.21 mmol/L,Vmax为7.58 mmol/(L·min)。
2.5 全细胞转化条件的确定

图7 重组GAD的Lineweaver-Burk作图Fig. 7 Lineweaver-Burk plot of recombinant GAD.
通过对重组谷氨酸脱羧酶GAD酶学性质的初步研究,确定了其最适作用温度、最适pH以及不同金属离子和EDTA对重组GAD酶活性的影响,根据酶学性质的研究结果,将转化体系的温度、pH分别调整至最适值,并向其中添加对重组酶GAD具有促进作用的金属离子,以此确定最适转化条件为:乙酸-乙酸钠缓冲液(pH 4.8)、2.5 mmol/L Ca2+、3.5 mmol/L Mg2+,转化温度37 ℃。
在进行输出以前,还要设置相关的求解控制参数,包括计算时间控制(设为100 ms)、输出频率、沙漏控制类型、沙漏系数以及缺省设置。由LS-DYNA EXPORTE模块输出K文件,打K文件设置内存空间,以及为提高计算速度而适当进行质量缩放[6]的修改。设置K文件中的参数需要具有一定的理论基础,难度比较大,但是正确的设置会大大提高求解效率,缩短仿真时间,将复杂的仿真模型快速求解。
2.6 重组大肠杆菌转化L-谷氨酸产GABA研究
将5 L发酵罐中培养至14 h的菌体进行离心收集,双蒸水洗涤3次后,2 L乙酸-乙酸钠缓冲液悬浮,菌体浓度达6.2 g/L,添加底物L-谷氨酸,分别在原始和优化后的条件下进行全细胞转化,以50 g/L的投料量进行分批投料,前期由于酶活水平较高,反应速率较快,投料间隔为每3 h投料一次,随着反应的进行,酶活有所下降,反应速度变慢,12 h后,投料时间间隔延长到6 h,在转速250 r/min、通气量120 L/h的条件下转化24 h,反应结束后转化液离心取上清,加入15%的三氯乙酸终止反应,取1 mL进行适当稀释后,氨基酸自动分析仪测得优化前后反应体系的转化液中产物 GABA浓度分别为 143.5 g/L和204.5 g/L,转化率分别为97.32%和97.92%,与最初转化条件相比,相同转化时间下,优化后反应体系的转化液中 GABA累计浓度提高了42.5%。条件优化前后,全细胞转化液氨基酸自动分析仪测定结果如图8所示:

图8 氨基酸自动分析仪测定条件优化前后全细胞转化液中L-Glu与GABA的含量图谱Fig. 8 Map of GABA and L-Glu of whole cell transformation solutions analyzed by auto amino acid analyzer. (A) Original condition. (B) Optimized condition.
3 讨论
本课题组前期研究结果表明:一方面,植物乳杆菌厌氧培养时 GABA产量高于有氧环境,因此生长速度较好氧微生物慢,影响了菌体的生长;另一方面,植物乳杆菌中的低拷贝lpgad基因使得GAD的表达量有限,粗酶液酶活仅有2.01 U/mg,限制了GABA的生产效率。而增大酶的表达量及提供其合适的作用条件是提高全细胞转化效率的两个重要策略,本文构建了一株重组大肠杆菌BL21/pET-28a (+) -lpgad,借助其生长迅速、可高密度培养及pET-28a表达质粒中T7强启动子等优点,在简化培养条件、缩短培养时间的基础上,大幅度提高了GAD的表达量,重组菌破细胞后粗酶液酶活为植物乳杆菌中GAD酶活的4.24倍。另外,利用6·His-Tag采用Ni-NTA柱亲和层析法将重组菌中 GAD进行纯化,并对其酶学性质进行初步研究,确定了全细胞转化时所需的酶的最适反应条件:最适pH为4.8,最适温度为37 ℃,Ca2+、Mg2+作为激活剂。在此条件下,添加底物L-谷氨酸,5 L发酵罐转化24 h,GABA累计浓度高达204.5 g/L,摩尔转化率为97.92%,在国内外处于领先地位[20],与初始转化条件相比,转化液中GABA累计浓度提高了 42.5%,在实验室条件下实现了微生物高效率生产GABA,为其工业化应用奠定了良好的基础。
REFERENCES
[1] Krnjevic K. Chemical nature of synaptic transmission in vertebrates. Physiol Rev, 1974, 54(2): 418−540.
[2] Mao YH, Shan Pu YM. Research on physiological function of γ-aminobutyric acid in recent years-the center of brain improvement and hypertension function. Food Explor, 2001, 36(6): 9−13.茅原纮, 杉浦友美. 近年の GABA生理机能研究-脑机能改善作用、高血压作用を中心に. 食品と开发, 2001, 36(6): 9−13.
[3] Okada T, Sugishita T, Murakami T, et al. Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration. Nippon Shokuhin Kashi, 2000, 47(8): 596−603.
[4] Abbjasova LE, Tuzov DG. Method of synthesis of γ-aminobutyric acid: RU, 2202538. 2003-04-20.
[5] Nomum M, Kimoto H, Someya Y, et a1. Production of γ-aminobutyric acid by cheese starters during cheese ripening. J Dairy Sci, 1998, 81(6): l486−l491.
[6] Li LZ, Li MY. Preparation of the Latest Biochemical Medicine. Beijing: China Med Sci Press, 2001: 79−80.李良铸, 李明晔. 最新生化药物制备技术. 北京: 中国医药科技出版社, 2001: 79−80.
[7] Choi SI, Lee J W, Park SM, et a1. Improvement of γ-aminobutyric acid (GABA) production using cell entrapment of Lactobacillus brevis GABA 057. J Microbiol Biotechnol, 2006, 16(4): 562−568.
[8] Komatsuzaki N, Shima J, Kawamoto S, et a1. Production of' γ-aminobutyric acid (GABA) by Lactobacillus paracasei isolated from traditional fermented foods. Food Microbiol, 2005, 22(6): 497−504.
[9] Huang J, Mei LH, Xia J. Application of artificial neural network coupling particle swarm optimization algorithm to biocatalytic production of gaba. Biotechnol Bioeng, 2007, 96(5): 924−931.
[10] Liu TT, Yang TW, Zhang SC, et al. Screening, identification and primary optimizing of a strain producing γ-aminobutyric acid from L-glutamate acid. J Food Sci Biotechnol, 2010, 29(5): 742−747.刘婷婷, 杨套伟, 张术聪, 等. 高效转化L-谷氨酸为γ-氨基丁酸菌株的筛选、鉴定及初步优化.食品与生物技术学报, 2010, 29(5): 742−747.
[11] Kook MC, Seo MJ, Cheigh CI, et al. Enhancement of γ-amminobutyric acid production by Lactobacillus sakei B2-16 expressing glutamate decarboxylase from Lactobacillus plantarum ATCC 14917. J Korean Soc Biol Chem, 2010, 53(6): 816−820.
[12] Sambrook J, Fritsch E, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harb Lab Press, 1989: 20−25.
[13] Joseph S, David WR. Molecular Cloning. 3rd ed. New York: Cold Spring Harb Lab Press, 2001: 1523−1574.
[14] Xu JJ, Jiang B, Xu SY. Rapid determination of
[18] Xu JJ, Jiang B, Xu SY. Purification and partial characterization of glutamate decarboxylase from Lactococcus lactis. J Wuxi Univ Light Ind, 2004, 23(3): 79−83.许建军, 江波, 许时婴. Lactococcus lactis谷氨酸脱羧酶的分离纯化及部分酶学性质. 无锡轻工大学学报, 2004, 23(3): 79−83.
[19] Ueno Y, Hayakawa K, Takahashi S, et al. Purification and characterization of glutamate decarboxylase from Lactobacillus brevis IFO 12005. Biosci Biotechnol Biochem, 1997, 61(7): 1168−1171.
[20] Ji LL, Menghe BLG. The Physiological functions and research progress of γ-aminobutyric acid. Acad Period Farm Prod Processing, 2007, 6(12): 11−14.冀林立, 孟和毕力格. γ-氨基丁酸的生理功能和研究进展. 农产品加工·学刊, 2007, 6(12): 11−14.glutamate decearboxylase activity from lactic acid bacteria by spfctrometric method and its applications. Microbiol China, 2004, 31(2): 66−71.许建军, 江波, 许时婴. 比色法快速测定乳酸菌谷氨酸脱羧酶活力及其应用. 微生物学通报, 2004, 31(2): 66−71.