低浓度混合酶改良消化法体外培养SD大鼠面颌肌细胞
2012-02-02殷忠平许艳华
殷忠平,许艳华,徐 芸,果 利
(1大庆龙南医院,黑龙江大庆163453;2昆明医学院附属口腔医院)
颌面部肌肉的调控和改建在牙颌面畸形矫治及疗效保持过程中起着关键作用。功能矫治器通过改变颌面部肌肉功能调节和刺激颅面骨骼生长而促进颌的发育,建立新的神经肌肉动力平衡协调关系,使口颌系统正常生长发育,从而矫正形成中的牙颌面畸形。原代培养骨骼肌细胞的报道较多[1~3],但对面颌肌细胞原代培养报道较少。在借鉴及摸索实践的基础上,本研究用低浓度混合酶改良消化法成功地进行了SD大鼠颌面肌细胞的体外培养,观察了该细胞在体外生长的一般生物学特性和生长规律,为颌面部肌肉组织功能改建的生物学和生物力学研究奠定了基础。
1 材料与方法
1.1 实验动物及试剂 出生2~3 d的SD大鼠(昆明医学院动物科提供)。胎牛血清(FBS:Gibco公司),DMEM培养基(Gibco公司),胰蛋白酶(Sigma公司),Ⅰ型胶原酶(Sigma公司)等。
1.2 实验方法
1.2.1 SD大鼠面颌肌细胞的原代培养及纯化 ①SD大鼠乙醚麻醉,75%乙醇浸泡消毒5 min,解剖分离颌面部咬肌区肌肉组织。用含100 U/mL青霉素、100 U/mL链霉素的冷PBS液冲洗4~6遍,去除脂肪及粘连的软骨组织,无菌滤纸拭干,用眼科剪将其剪成约1 mm3的碎块,冷PBS液洗涤3次,组织浆移入25 mL培养瓶。②先加入0.1%的Ⅰ型胶原酶,消化10 min,弃上清液;再加入混合酶(0.1%的Ⅰ型胶原酶:0.125%的胰酶=1∶1)37℃振荡消化20 min。待大组织沉淀后,取上清液,加入含10% FBS的DMEM培养基终止消化,过滤。将剩余大组织移入消化培养瓶,按上述步骤重复2~3次。③滤液1 000 r/min离心5 min,弃上清液,沉淀物用含20%FBS的DMEM增殖培养基重悬。细胞悬液移入培养瓶,37℃、饱和湿度、5%CO2孵箱中静置30 min,将上清细胞悬液如此纯化细胞4次。④ 将纯化后的面颌肌成肌细胞以1×106/mL接种于25 mL培养瓶中,加增殖培养基,37℃、饱和湿度、5%CO2孵箱中原代培养。
1.2.2 SD大鼠面颌肌细胞的传代培养 当原代培养的SD大鼠面颌肌细胞生长至铺满培养瓶80%以上时,倒掉培养基,加入0.125%的胰蛋白酶消化2~3 min,并不断用吸管吹打。用含10%FBS的DMEM生长培养基终止消化,1 000 r/min离心5 min,弃上清液,生长培养基重悬沉淀细胞,以1× 105/mL接种于25 mL培养瓶中。首次传代后的细胞长满瓶底70%~80%后按1∶2或1∶3传代。
1.2.3 SD大鼠面颌肌细胞的形态学观察及生物学鉴定 ①倒置相差显微镜观察细胞形态,记录细胞贴壁、分化、融合及肌管形成情况并照相。取第1代培养的SD大鼠面颌肌细胞盖玻片爬片,用SP法进行结蛋白(Desmin)免疫组化染色,用成纤维细胞作对照。
1.2.4 SD大鼠面颌肌细胞生长曲线绘制及细胞倍增时间计算 ①取第3代SD大鼠面颌肌细胞,以1.25×104/mL接种至24孔培养板,每天选3孔细胞用4%苔盼蓝染色,计数活细胞,每孔计数3次,取平均值,共计数7 d。根据细胞计数结果和时间绘制生长曲线。②计算细胞倍增时间:T=t×log2/ (logNt-logN0),T为SD大鼠面颌肌细胞数增加1倍的时间,N0为第1天细胞数,Nt为生长高峰期(第5天)细胞数,t为倍增时间(120 h)。
2 结果
倒置显微镜下观察发现,体外培养的SD大鼠面颌肌细胞经酶消化后呈球形,接种12 h后细胞开始贴壁,单个,呈圆形或梭形。24 h后细胞完全贴壁开始增生,呈梭形,有两极,体积小,折光性强;少量细胞多角形,有突起。第2~3天,细胞具有较强的分裂增殖能力,单核双极大量伸展,并逐渐变成纺锤形,胞质丰富,胞核位于细胞中央,呈椭圆形,核仁明显。第4天肌细胞大量增殖,变得细长,呈长轴平行排列,具有方向性,细胞之间出现融合现象,形成多核性长管状初生肌管,肌管多数平行排列。第5~6天肌管数量增多,体积增大,细胞核数目明显增多。第7~8天细胞融合形成肌管达高峰,呈典型的“峰~谷”样生长。免疫组化染色后显微镜下观察,见肌细胞呈梭形,胞核较大,细胞质Desmin染色阳性(阳性率达95%以上,胞核无染色),而成纤维细胞无Desmin表达。证明培养、分化的细胞为SD大鼠面颌肌细胞。
SD大鼠面颌肌细胞接种后经过1 d的潜伏适应期,第2天细胞进入指数生长期,持续3~4 d;第5天细胞进入平台生长期,第6天细胞达到增殖高峰。体外培养2~6 d,细胞生长活跃之后增殖速度减慢,数目逐渐减少。SD大鼠面颌肌细胞生长曲线见图1。SD大鼠面颌肌细胞T平均为37.76 h。
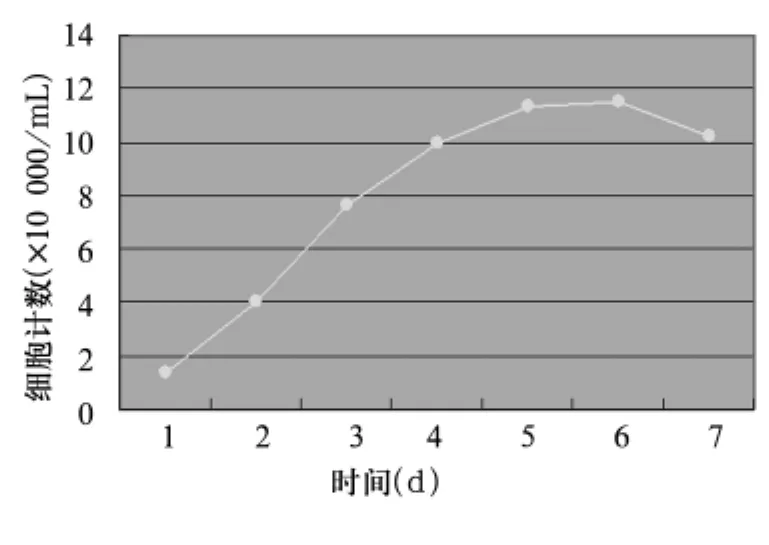
图1 SD大鼠面颌肌细胞生长曲线
3 讨论
胰蛋白酶和胶原酶是酶消化法细胞培养的常用酶。胰蛋白酶适用于消化细胞间质较少的软组织,而胶原酶则对细胞间质有消化作用[4]。因成肌细胞位于肌纤维和基底膜之间,单纯用胶原酶只能使肌纤维相互分离,只有胰蛋白酶才能分离成肌细胞,且新生大鼠骨骼肌组织以Ⅰ型胶原为主[5]。本实验将酶消化步骤略作改进,将其分两步进行:先用0.1%的Ⅰ型胶原酶消化分离出肌纤维,10 min后去上清液使易被胶原酶解离出来的内皮细胞、成纤维细胞等混杂细胞先游离出来而被去除,得到纯净的肌纤维;再用0.1%的Ⅰ型胶原酶和0.125%的胰蛋白酶(1∶1)联合消化20 min后收集细胞。结果表明,低浓度的胰蛋白酶和Ⅰ型胶原酶混合消化,减少了酶对细胞的损伤,细胞培养周期短且细胞纯度高、产量高、活性强、稳定性好。此法既节约了酶的用量,又提高了细胞成活率,更好地保护了离体面颌肌细胞的性状和生长代谢,有利于对该细胞进行体外研究。
由于成纤维细胞、血管内皮细胞30 min左右即可完全贴壁,比肌细胞贴壁迅速,而此时肌细胞因Ca2+作用呈聚集悬浮状态,故本实验利用差速贴壁法对细胞进行纯化[6]。每次换瓶前均反复多次轻轻吹打,使细胞成单个分散状态,以获得更高纯度的面颌肌细胞。
可通过骨骼肌成肌细胞在体外能够分化成肌小管、形成横纹,甚至可见收缩这些特异性形态学变化对其进行鉴定。本实验体外培养的成肌细胞,当降低血清浓度或细胞密集时,清晰可见成肌细胞在长轴方向相互融合,形成多核肌管,未见横纹及成肌细胞收缩。免疫组织化学方法鉴定成肌细胞包括肌球蛋白(Myosin)、Desmin、M-钙黏蛋白(M-cadherin)及α-横纹肌肌动蛋白(α-sarcometric actin)[7,8]的检测。Desmin具有高度组织特异性[9],是肌细胞的骨架蛋白和功能蛋白,在成肌细胞分化的早期即能检测到,是哺乳动物成肌细胞的早期标志[10],也是鉴定成肌细胞的有效方法。
本实验先用0.1%的Ⅰ型胶原酶消化解离出肌纤维,再用低浓度的胰蛋白酶和Ⅰ型胶原酶混合酶消化,差速贴壁法纯化细胞的方法步骤简单,所需时间短。为从细胞生物学角度研究外因作用下颌面部肌肉组织适应性功能改建机制提供了细胞体外培养的模型。
[1]Blau HM,Webster C.Isolation and characterization of human muscle cells[J].Cell Biol,1981,78(9):5623.
[2]邬江,钟世镇,徐达传,等.肌组织工程的基础研究-卫星细胞培养及鉴定[J].中国临床解剖学杂志,1999,17(4):351.
[3]陈松林,张为西,刘晓蓉,等.成肌细胞培养的重复肌块法[J].中山医科大学学报,2002,23(5):339-340.
[4]司徒镇强,无军正.细胞培养[M].西安:世界图书出版公司,1996:62-72.
[5]Hata H,Matsumiya G,Miyagawa S,et al.Grafted skeletal myoblast sheets attenuate myocardial remodeling in pacing induced canine heart failure model[J].J Thorac Cardiovasc Surg,2006,132 (4):918-924.
[6]Allen RE,Temm-Grove CJ,Sheehan SM,et al.Skeletal muscle satellite cell cultures[J].Methods Cell Biol,1997,(52):155-176.
[7]魏宽海,裴国献,史宇恒,等.骨骼肌卫星细胞的培养鉴定及生物学特性[J].中国危重病急救医学,2002,14(2):104.
[8]Lawson-Smith MJ,McGeachie JK.The identification of myogenic cells in skeletal muscle with emphasis on the use of tritiated thymidine autoradiography and desmin antibodies[J].J Anat,1998,192(Pt 2):161-171.
[9]Baroffio A,Piallat MLB,Gabbianni G,et al.Heterogeneity in the progeny of single human muscle satellite cells[J].Differentiation,1995,59(4):259.
[10]芩石强,杨志明.成肌细胞在基因治疗和组织工程中的应用综述[J].中国修复重建外科杂志,1999,13(3):173.
