实验动物金黄色葡萄球菌LAMP检测方法的建立
2012-01-30荣蓉,张丽芳,李雨函等
金黄色葡萄球菌(Staphylococcus aureus,SA)属于葡萄球菌属(Staphylococcus),广泛存在于空气和水中,是人和动物体表、皮、毛、鼻、口腔、消化道的常见菌,也是一种条件性致病菌。金黄色葡萄球菌可引起人和动物皮肤软组织感染、败血症、乳房炎、心内膜炎、肺炎、肠炎、脑膜炎、骨髓炎、筋膜炎、关节炎、中毒性休克综合征等。对于实验大、小鼠,可引起化脓性睾丸炎、前列腺炎、卵巢脓肿、子宫内膜炎等,严重影响鼠群繁育和动物实验结果[1]。中华人民共和国国家标准GB14922.2-2011《实验动物微生物学等级及监测》将金黄色葡萄球菌列为SPF级大鼠、小鼠、豚鼠、地鼠和兔等啮齿类实验动物必须检测和排除的病原菌。
实验动物金黄色葡萄球菌检测通常采用分离培养和生化鉴定相结合的方法,这种方法至少需要5d。环介导等温扩增是近年来发展起来的一项基因体外扩增的技术,利用4条不同的引物特异性地识别目的基因上面的6个特定序列,借助具有链置换活性的Bst DNA聚合酶,在恒温条件下催化新链的合成[2]。在反应产物中加入 SYBR green I,绿色为阳性,橙色为阴性,可以直接肉眼观察判定结果。该技术由于操作简便、快速、灵敏度高、特异性强等优点被广泛应用于生命科学各领域。本研究将LAMP技术应用于实验动物金黄色葡萄球菌检测中,实现目的基因高效、快速的扩增,大大提高了检测效率、降低了检测成本。
1 材料和方法
1.1 材料
1.1.1 菌株:金黄色葡萄球菌ATCC 25923由本实验室保藏;金黄色葡萄球菌、沙门菌、小肠结肠炎耶尔森菌、假结核耶尔森菌、肺炎克雷伯菌均为本实验室分离保藏。
1.1.2 主要试剂:细菌基因组DNA小量试剂盒购自AxyPrep公司;Bst DNA Polymerase购自 NEB公司;Betaine购自Sigma公司;dNTP m ixture、MgCl2、购自 TaKaRa宝生物(大连)工程有限公司;SYBR green I荧光染料购自北京天恩泽基因科技有限公司;DEPC水购自Solarbio公司。
1.2 方法
1.2.1 引物的设计:根据金黄色葡萄球菌特有的nuc基因,利用Primer Explorer IV设计4条引物[3],由北京阅微基因技术有限公司合成(表1)。
1.2.2 菌株培养:金黄色葡萄球菌ATCC 25923接种于血琼脂平皿,37℃培养18h~24h,挑取单菌落转接于营养肉汤培养基,37℃培养过夜。取100μL菌液用于稀释与计数,其余菌液6000r/m in离心30min,收集菌体溶于 DEPC水中,-20℃保存备用。
1.2.3 金黄色葡萄球菌的稀释与计数:取100μL增菌培养后的菌液,用无菌PBS进行10倍递增稀释,每个稀释度吸取100μL接种到血琼脂平板上,每个稀释度做2个平皿,L棒涂布均匀,于37℃培养24h后进行计数。
1.2.4 模板制备:采用热裂解法制备粗制模板[4]。取50μL菌液溶于50μL DEPC水,电磁炉煮沸10m in,12000r/m in离心 5m in,取上清液为粗制模板,-20℃保存备用。
1.2.5 LAMP扩增反应:
1.2.5.1 25μL扩增体系和反应条件[5]:1.6μmol/L FIP、1.6μmol/L BIP、0.2μmol/L F3、0.2μmol/L B3、1.6mmol/L dNTP、4mmol/L MgCl2、0.8mol/L betaine、LAMP buffer(20mmol/L Tris-HCl (pH 8.8)、10mmol/L KCl、10mmol/L(NH4)2SO4、2mmol/L MgSO4、0.1%TritonX-100)、1μL模板、8U Bst酶。加入模板后煮沸5min,4℃ 3min,再加入Bst酶,60℃ 60min,80℃ 3min,4℃保存。
1.2.5.2 特异性试验:按照1.2.5.1的25μL扩增体系配制反应液,分别以金黄色葡萄球菌 ATCC 25923、金黄色葡萄球菌、沙门菌、小肠结肠炎耶尔森菌、假结核耶尔森菌、肺炎克雷伯菌的粗提DNA为模板进行扩增。
1.2.5.3 优化反应体系:按照1.2.5.1的25μL扩增体系配制反应液,以金黄色葡萄球菌ATCC 25923的粗提DNA为模板,对LAMP反应体系中的dNTP浓度、Mg2+浓度和betaine浓度以及反应时间进行优化。
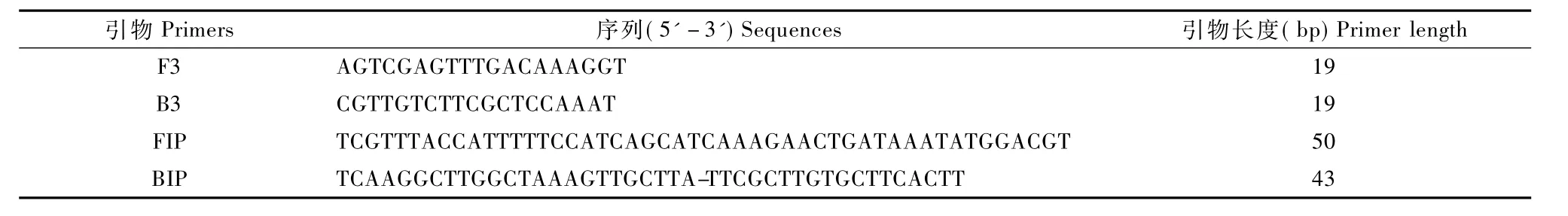
表1 引物序列Tab.1 Nucleotide sequences of the primers
1.2.5.4 灵敏性试验:按照优化后的反应体系进行扩增。将模板浓度做倍比稀释,使每个反应体系的模板量为1cfu、2cfu、3cfu、4cfu、5cfu、10cfu。
1.2.5.5 方法验证:取20粒SPF级小鼠粪便。经分离培养和生化鉴定[6]证实有表皮葡萄球菌存在。将20份样品随机平均分为两组,每组中5份样品混入少量金黄色葡萄球菌 ATCC 25923。一组粗提DNA为LAMP反应的模板,编号为1~10,11号为空白对照;另一组用AxyPrep细菌基因组DNA小量试剂盒提取DNA为LAMP反应的模板,编号为1'~10',11'号为空白对照。按照优化后的25μL扩增体系配制反应液进行扩增。扩增产物以5μL上样进行凝胶电泳观察结果,粗提DNA的一组每管剩余20μL加入2μL 100×SYBR green I(以无水DMSO将10000×SYBR green I稀释100倍)肉眼直接观察,橙色为阴性,绿色为阳性。
2 结果
2.1 特异性试验
对供试菌株分别进行LAMP。结果显示,金黄色葡萄球菌反应管电泳结果均呈阳性,而其他菌株反应管电泳结果均呈阴性(见图1),说明所设计的引物具有极强的特异性。
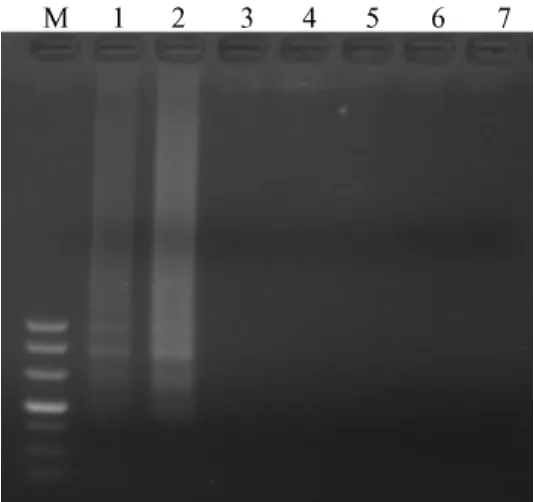
图1 引物特异性凝胶电泳图Fig.1 Agarose gel electrophoretogram of the LAMP-amplified DNA using specific primersNote: M: marker DL500;1: Staphylococcus aureus ATCC25923;2:Staphylococcus aureus;3:Salmonella spp.;4:Yersinia enterocolitica;5: Yersinia pseudotuberculosis;6:Klebsiella pneumoniae;7:blank control.
2.2 优化反应体系
2.2.1 dNTP浓度对LAMP反应的影响:由图2可见,dNTP的浓度为1.6mmol/L~2.0mmol/L时均能扩增出靶DNA。当dNTP的浓度达到2.0mmol/L时,就能够得到均一、稳定的条带,继续增加dNTP浓度至2.4mmol/L,扩增效率稍有降低。
2.2.2 Mg2+浓度对 LAMP反应的影响:由图3可见,Mg2+的浓度为2mmol/L~7 mmol/L时均能扩增出靶DNA。当Mg2+的浓度达到6mmol/L时,就能够得到均一、稳定的条带,继续增加Mg2+浓度至7 mmol/L,扩增效率稍有降低。
2.2.3 Betaine浓度对 LAMP反应的影响:由图4可见,当betaine的浓度在0.6mol/L~1.0mol/L范围内时对扩增反应的影响并不大,但仍可见当betaine的浓度达到0.8mol/L时,扩增效果最好。
2.2.4 反应时间对LAMP反应的影响:在电泳30min时就能观察到特异性条带,但在60min才能得到均一、稳定的电泳条带(图5)。

图2 dNTP浓度对LAMP反应的影响Fig.2 Effect of dNTP concentration on the LAMP reaction Note:M:marker DL500;1:dNTP 0.4mmol/L;2:dNTP 0.8mmol/L;3:dNTP 1.2mmol/L;4:dNTP 1.6mmol/L;5:dNTP 2.0 mmol/L;6:dNTP 2.4mmol/L;7:blank control.
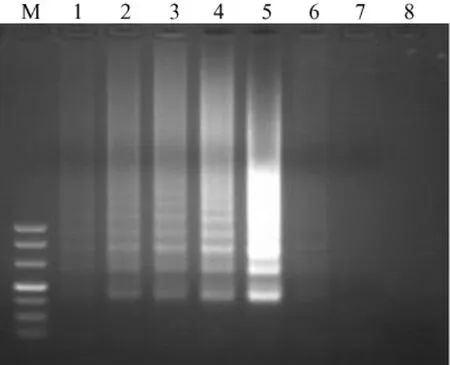
图3 Mg2+浓度对LAMP反应的影响Fig.3 Effect of Mg2+concentration on the LAMP reaction Note:M:marker DL500;1:Mg2+2mmol/L;2:Mg2+ 3mmol/L;3:Mg2+4mmol/L;4:Mg2+5mmol/L;5:Mg2+ 6mmol/L;6:Mg2+7 mmol/L;7:Mg2+8mmol/L;8:blank control.
2.3 敏感性试验
根据条件优化试验结果调整金黄色葡萄球菌LAMP反应体系进行敏感性试验,结果显示,所设计的特异性引物在最佳反应条件下,最低可检测到2cfu热裂解法粗提DNA的金黄色葡萄球菌。(图6)

图4 Betaine浓度对LAMP反应的影响Fig.4 Effect of betaine concentration on the LAMP reactionNote:M:marker DL500;1:Betaine 0.6M;2:Betaine 0.7 mol/L;3:Betaine 0.8mol/L;4:Betaine 0.9 mol/L;5:Betaine 1.0mol/L;6:Betaine 1.1mol/L;7:blank control.
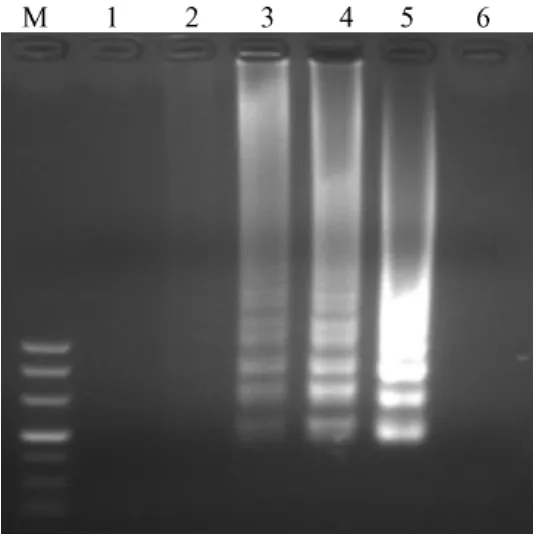
图5 反应时间对LAMP反应的影响Fig.5 Effect of reaction time on the LAMP reaction Note:M:marker DL500;1:20min;2:30min;3:40min;4:50min;5:60min;6:blank control.
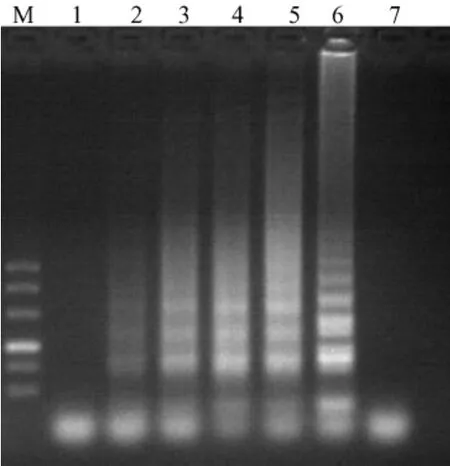
图6 LAMP敏感性电泳结果Fig.6 Agarose gel electrophoretogram of LAMP-amplifiedDNA of SA at different DNA concentrationNote:M:marker DL500;1:1cfu;2:2cfu;3:3cfu;4:4cfu;5:5cfu;6:10cfu;7:blank control.
2.4 方法验证
对供试粪便样品分别进行用LAMP进行检测。结果显示,未添加金黄色葡萄球菌ATCC 25923的供试样品凝胶电泳结果均呈阴性,添加金黄色葡萄球菌ATCC 25923的供试样品凝胶电泳结果均呈阳性(图7),说明引物对表皮葡萄球菌并无交叉反应。同时,肉眼直接观察加入SYBR Green I荧光染料的反应管,1~5为橙色、6~10为淡绿色、11为橙色,与凝胶电泳结果相同。
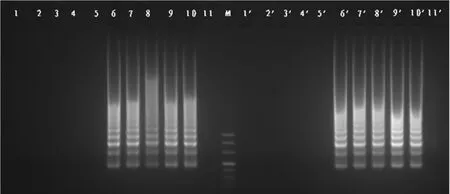
图7 LAMP琼脂糖凝胶电泳结果Fig.7 Results of of LAMP-agarose gel electrophoresisNote:M:Marker DL500;1~5:stool samples of SPF mice processed by thermal cracking;6~10:Thermal cracking stool samples added with Staphylococcus aureus ATCC25923of SPF mice processed by thermal cracking;11:Blank control;1'~5':Stool samples of SPF mice processed by kit;6'~10':Stool samples added with Staphylococcus aureus ATCC25923of SPF m ice processed by kit;11':Blank control.
3 讨论
根据生物学特性、表型特征鉴定细菌的传统的分离培养法是实验动物国家标准中推荐的检测方法,这种方法存在许多不足之处:耗时长且步骤繁琐,要求有经验非常丰富的科研人员,并且这些方法很容易出现漏检。PCR技术虽然越来越多地被应用于实验动物微生物检测,但是因为需要特殊的仪器,并且容易发生非特异性扩增使得它在实验动物微生物检测中的应用受到限制。LAMP技术较常规的PCR技术操作更简单;无需昂贵的实验仪器,反应不需要控制温度的变化,仅需一台水浴锅就可完成整个扩增过程;结果判定简便,可直接根据有无焦磷酸镁沉淀的生成,或者根据加入荧光染料SYBR green I后颜色的变化,直接肉眼观测结果,省去PCR中的变温过程和电泳观察结果的步骤,大大缩短试验时间;另外4条引物必须完全匹配才能进行扩增使得LAMP技术比PCR技术具有更强的特异性。故LAMP技术能够满足基层、现场、即时、大批量样本检测的需要,克服了传统PCR方法的不足之处。
金黄色葡萄球菌的nuc基因编码耐热核酸酶,位于染色体上,长966bp。Brakstad等[7]人分别应用PCR的方法证明了nuc基因只存在于金黄色葡萄球菌中,而在其他葡萄球菌和非葡萄球菌中均不存在,是金黄色葡萄球菌的高特异性基因。
本研究针对金黄色葡萄球菌特异性的nuc基因设计的LAMP技术是一种特异性强、敏感性高、操作极其简便的快速检测方法。在25μL的LAMP体系中(1.6μmol/L FIP、1.6μmol/L BIP、0.2μmol/L F3、0.2μmol/L B3、2.0mmol/L dNTP、6mmol/L MgCl2、0.8mol/L betaine、20mmol/L Tris-HCl(pH 8.8)、10mmol/L KCl、10mmol/L(NH4)2SO4、2mmol/L MgSO4、0.1% ritonX-100、模板 DNA、8U BstDNA聚合酶)仅需要40min~60min,就可以清晰检测出2cfu粗提DNA的金黄色葡萄球菌。扩增结束后直接在反应管中加入只与双链DNA结合的SYBR green I可通过阳性结果呈绿色、阴性结果呈橙色,肉眼直接判定结果。从提取 DNA开始,在1.5h~2h内即可完成全部检测过程。诸多优点使得这项技术不仅能够满足对检测特异性、敏感性的要求,也能够满足实验动物饲养机构和基层实验室对大批量实验动物是否感染金黄色葡萄球菌进行初步筛选的需要。
[1]方喜业,邢瑞昌,贺争鸣.实验动物质量控制[M].北京,中国标准出版社,2008:371-372.
[2]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Ices,2000,28(12):63.
[3]Eiken Chenieal Co.Ltd.The principles of LAMP method[EBIOL].http://loopamp.eiken.eo.iP/e/tech/index.html.2003,10.
[4]严剑波,王虹玲,朱水荣,等.单增李斯特菌LAMP方法的建立[J].中国卫生检验杂志,2009,19(9):2048-2050.
[5]周义正,王昌富,李向阳,等.环介导等温扩增快速检测阳性血培养瓶中的金黄色葡萄球菌[J].中华医院感染学杂志,2009,19(9):2075-2077.
[6]廖延雄.兽医微生物实验诊断手册[M].北京农业大学出版社,1995,81-114.
[7]Brakstad OG, Aasbakk K, Maeland JA. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene[J].J Clin Microbiol,1992,30(7):1654-1660.
