不同方法建立的人大细胞肺癌裸鼠移植瘤模型的生物学特点
2012-01-30屠珏,陈方明,周卫民等
人肺癌裸鼠移植瘤模型是抗肿瘤药研究的常用模型,更是抗血管生成类抗肿瘤药的首选模型。保持肿瘤生物学特性的稳定,尽可能地模拟癌症患者临床生理特征是评价一个裸鼠异种移植瘤模型成功和优劣的关键[1]。目前国内外已建立了多个传代稳定的肺癌裸鼠皮下移植瘤模型,应用于小细胞肺癌、肺腺癌等的研究[2]。但建立人大细胞肺癌移植瘤模型的详细报道甚少,对该移植瘤模型的生物学特征的研究更是空白。NCI-H460细胞来自男性大细胞肺癌患者的胸腔积液,为美国典型培养物保藏中心(ATCC)收藏的人大细胞肺癌细胞株。本文参考三种常用的皮下移植瘤造模方法分别建立了人大细胞肺癌 NCI-H460裸鼠移植瘤模型,并比较了三种方法建立的肿瘤模型的生长规律和生物学特性,其中对移植瘤裸鼠免疫功能的研究尚属首次。
1 材料和方法
1.1 实验动物与瘤株
BALB/c-nu/nu裸鼠,SPF级,3~4周,雌性。购于上海必凯实验动物有限公司[生产许可证:SCXK(沪)2008—0016]。饲养及无菌实验操作均在浙江中医药大学动物实验研究中心屏障系统内进行[实验室许可证:SYXK(浙)2008—0115]。人大细胞肺癌NCI-H 460细胞、人白血病 K562细胞:购于中科院上海细胞所。
1.2 主要仪器与试剂
Nikon eclipse 80i显微镜,Nikon公司;Forma 3111型细胞培养箱,Thermo公司;SW-CJ-2F超净工作台,苏州净化;BIO-RAD 680酶标仪;Axiovert 200荧光倒置显微镜,ZEISS;全自动生化分析仪,日本日立;丙氨酸氨基转氨酶(ALT)、天冬氨酸氨基转移酶(AST)、血糖(G1u)、尿素氮(BUN)、肌酐(CREA)试剂盒,由上海申能德赛技术诊断有限公司提供。
1.3 模型制备
1.3.1 细胞培养移植法造模[3]:取对数生长期NCI-H 460细胞消化后,调整至5×107/mL,每鼠颈背皮下接种0.2m L。细胞悬液放置于冰上,接种过程必须在细胞悬液制备后1h内完成。
1.3.2 组织块移植法造模[4]:取培养细胞初代移植瘤生长至1cm3的荷瘤裸鼠4只,采用脊髓离断法处死动物,无菌剥离瘤体,除去包膜,用0.9%生理盐水洗涤2次,取周围鱼肉样新鲜组织剪成(0.5×0.5×0.5)mm大小瘤块,用套管针接种于裸鼠颈背部皮下。接种标本在离体后5min之内完成。
1.3.3 匀浆液移植法造模[5]:取培养细胞初代移植瘤生长至1cm3的荷瘤裸鼠4只,采用脊髓离断法处死动物,无菌剥离瘤体,除去包膜,剪碎,加入生理盐水,以200目铜网过滤,制备成单细胞悬液,台盼蓝拒染计数活细胞后调整细胞浓度至5×107/m L,接种于裸鼠颈背部皮下,每只接种0.2m L。
1.4 一般生物学特征观察
1.4.1 移植瘤生长曲线:自接种日起每周测量1次肿瘤长径(b)和短径(a),按公式V=1/2×a×b2计算肿瘤体积,待肿瘤生长至100mm3后每3天测量1次,共观察5周,绘制生长曲线图,根据生长曲线计算各种方法的成瘤率、成瘤潜伏时间、肿瘤体积倍增时间。
1.4.2 组织形态观察;于2周和5周后分别取荷瘤裸鼠,处死,剥离肿瘤组织,中性甲醛固定,石蜡包埋切片,HE染色,光镜下观察肿瘤组织形态。
1.5 外周血生化和白细胞分类检测
3种方法建立的人大细胞肺癌裸鼠移植瘤模型作为3个实验组,分别简称为匀浆液组、细胞培养组和埋块组。另取10只正常 BALB/c-nu/nu裸鼠作为对照组。于造模后2周、4周和5周分别经眼丛静脉取血,全自动生化分析仪检测其丙氨酸氨基转氨酶(ALT)、天冬氨酸氨基转移酶(AST)、血糖(G1u)、尿素氮(BUN)和肌酐(CREA)等生化指标;实验结束取血,EDTA二钠抗凝,血球分析仪检测白细胞总数(WBC)并进行分类(NEUT%、LY%、MO%、HGB、PLT等)。
1.6 免疫功能检测
于造模后2周和5周分别取荷瘤裸鼠和正常BALB/c-nu/nu裸鼠各5只,检测其非特异性免疫功能。
1.6.1 腹腔巨噬细胞吞噬活性[6]:裸鼠腹腔内注射5%鸡红细胞悬液0.5m L,30m in后颈椎脱臼处死,仰卧固定。常规消毒腹部皮肤,腹腔注入2m L生理盐水,轻揉腹部1min。吸取腹腔液1m L,分滴于2张清洁载玻片上,将玻片置于湿盒内盖好,于37℃培养箱30min,其间轻晃动玻片2次。取出后在生理盐水内清洗载玻片2次,洗去未吸附的细胞。晾干,1:1丙酮-甲醇溶液固定,用姬姆萨染色液染色3m in,用蒸馏水漂洗,晾干后,用油镜检查。计数巨噬细胞吞噬鸡红细胞的吞噬百分率和吞噬指数。
1.6.2 NK细胞活性[7]:无菌取脾,常规制备脾细胞,调整效应细胞浓度至1×107个/m L,取传代培养处于对数生长期的人白血病K562细胞,调整靶细胞浓度至1×105个/mL。采用LDH法检测NK细胞活性。
2 结果
2.1 移植瘤生长规律
本实验三种方法分别取10只裸鼠接种NCI-H 460细胞株。细胞培养移植法和匀浆液移植法成瘤率达100%,潜伏期为3~5d,肿瘤组织在短期内呈膨胀性生长。观察5周,肿瘤生长曲线符合Gompertzian曲线,18~20d肿瘤体积即达到1500
mm3,之后生长趋于稳定,平台期较长,如图所示(图 1)。肿瘤组织体积倍增时间(tumor doubling time,TD)分别为(6.1±0.4)d和(5.8±1.2)d。组织块移植法成瘤率为80%,潜伏期为5~9 d。观察5周,肿瘤生长Gompertzian曲线多处于对数生长期,观察期结束瘤体积刚好达到1500mm3。TD为(4.7±0.7)d。肿瘤为可触结节状,质略软,随着时间的延长,肿瘤体积逐渐增大,质变硬,瘤体被覆不完整结缔组织包膜,毛细血管清晰,细胞培养组和匀浆液组后期瘤块顶部发黑,局部血管明显扩张,有的瘤块顶部可出现坏死。解剖后,见瘤体有完整的包膜,呈结节状生长,中央多为豆腐渣样坏死。三种造模方法在肿瘤形成过程中均未观察到肿瘤自然消退者。
2.2 组织形态学
肉眼观察见3种方法组的肿瘤均位于皮下,球形或椭圆形,少数呈分叶状,匀浆液组和细胞培养组的瘤块大小较为均匀,而组织块移植法由于接种的组织块大小很难均一,所以形成的肿瘤大小有一定的差异。HE染色结果(图2,见彩插6)显示典型的上皮癌特征,移植瘤细胞多为圆形或椭圆形,体积较大,密集成团分布或呈巢状排列,胞浆丰富、深染,核分裂相多,或可见2~3个核仁。各组无明显差别。
2.3 生化指标
全自动生化分析仪检测生化指标结果见图3。接种2周后,与正常对照组比较,三组荷瘤小鼠血液中ALT变化不明显,AST升高,其中埋块组差异有显著性(P<0.05);BUN有降低趋势,细胞培养组差异有显著性(P<0.01)。荷瘤小鼠血糖均显著降低(P<0.05;P<0.01)。三种方法组之间进行单因素方差分析比较,匀浆液组荷瘤小鼠血液中GLU显著低于埋块组(P<0.01)。接种4周后,与正常对照组比较,匀浆液组和细胞培养组荷瘤小鼠肝功能指标ALT、AST均显著升高(P<0.05;P<0.01),肾功能指标 BUN、CREA显著降低(P<0.01)。三种方法组之间进行单因素方差分析比较,埋块组ALT、AST显著低于另两个荷瘤组(P<0.05;P<0.01),BUN、CREA高于另两组但是无统计学差异(P>0.05)。5周后,三组荷瘤小鼠ALT、AST均高于正常对照组,BUN、CREA显著低于正常小鼠(P<0.05;P<0.01)。
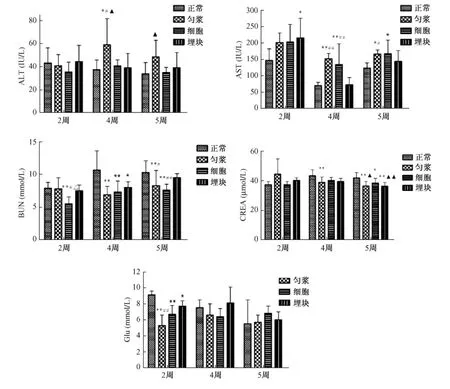
图3 荷瘤小鼠和正常小鼠血液生化指标的比较。Fig.3 Blood biochemistry of the tumor-bearing mice and normal mice.注:*P<0.05;**P<0.01与正常对照组比;△P<0.05与匀浆液组比;▲P<0.05;▲▲P<0.01与细胞培养组比;#P<0.05;##P<0.01与埋块组比。Note:*P<0.05;**P<0.01,vs.the control group;△P<0.05,vs.the homogenate group;▲P<0.05,▲▲P<0.01,vs.the cultured cell group;#P<0.05,##P<0.01,vs.the tissue transplantation group.
2.4 血液中白细胞分类的变化
从表1可见,与正常对照组比较,匀浆液组和细胞培养组的荷瘤小鼠血液中WBC、NEUT%、PLT均呈现显著性升高(P<0.05;P<0.01);埋块组荷瘤小鼠WBC、PLT呈升高趋势,但无显著性差异(P>0.05)。三种方法组荷瘤小鼠血液中 LYM%、MN%、HGB则呈降低趋势,其中匀浆液组和细胞培养组差异有统计学意义(P<0.05;P<0.01)。三种方法组间进行单因素方差分析比较,匀浆液组和细胞培养组差异未见显著性,埋块组除PLT与细胞培养组差异未见显著性外,其余指标与其他两组差异均呈现显著性(P<0.05;P<0.01)。
2.5 非特异性免疫功能
2.5.1 腹腔巨噬细胞吞噬活性:结果显示,接种2周时,裸鼠腹腔巨噬细胞吞噬百分率和吞噬指数均以匀浆液组>埋块组>细胞培养组>正常对照组,匀浆液组与对照组、细胞培养组比较差异均有显著性(P<0.05;P<0.01)。随着裸鼠周龄增长,其免疫功能有所恢复,接种5周后,正常组裸鼠腹腔巨噬细胞吞噬活性升高,三个荷瘤组吞噬百分率和吞噬指数均显著低于正常组(P<0.05;P<0.01),以埋块组<细胞培养组<匀浆液组 <正常对照组,匀浆液组与另外两个荷瘤组差异有显著性(P<0.05;P<0.01)(表2)。
表1 三种方法荷瘤小鼠和正常小鼠血液中白细胞分类的比较(n=10,±s)Tab.1 Leukocyte differential count of the tumor-bearing mice in the mice of the three tumor groups and normal group(n=10,±s)

表1 三种方法荷瘤小鼠和正常小鼠血液中白细胞分类的比较(n=10,±s)Tab.1 Leukocyte differential count of the tumor-bearing mice in the mice of the three tumor groups and normal group(n=10,±s)
注:*P<0.05,**P<0.0,与正常对照组比;▲P<0.05;▲▲P<0.01,与埋块组比;Note:*P<0.05,**P<0.01,vs.the control group;▲P<0.05,▲▲P<0.01,vs.the tissue transplantation group.
组别Groups WBC(×103/) NEUT(%) LYM(%) MN(%) HGB(g/L)PLT正常对照组Normal control 2.8±1.0 57.3±8.9 33.3±8.8 1.6±0.5 163.2±6.4 1200.0±120.5匀浆液组 Homogenate group 15.6±6.2**▲▲ 79.2±2.7**▲▲ 11.1±1.5**▲▲ 0.7±0.2*▲ 126.8±8.2**▲▲ 1910.4±281.8**▲细胞培养组 Cell group 11.9±9.4*▲ 75.1±13.1*▲▲ 17.0±9.1**▲▲ 0.7±0.3*▲ 137.2±8.7**▲▲ 1739.3±439.7*埋块组Tissue transplantation group 5.0±2.7 55.3±12.8 32.9±11.5 1.3±0.9 154.0±11.4 1385.2±414.3
表2 三种方法荷瘤小鼠和正常小鼠腹腔巨噬细胞吞噬活性的比较(n=5,±s)Tab.2 Comparison of the phagocytosis activity index of the tumor-bearing mice in the three groups and normal mice(n=5,±s)
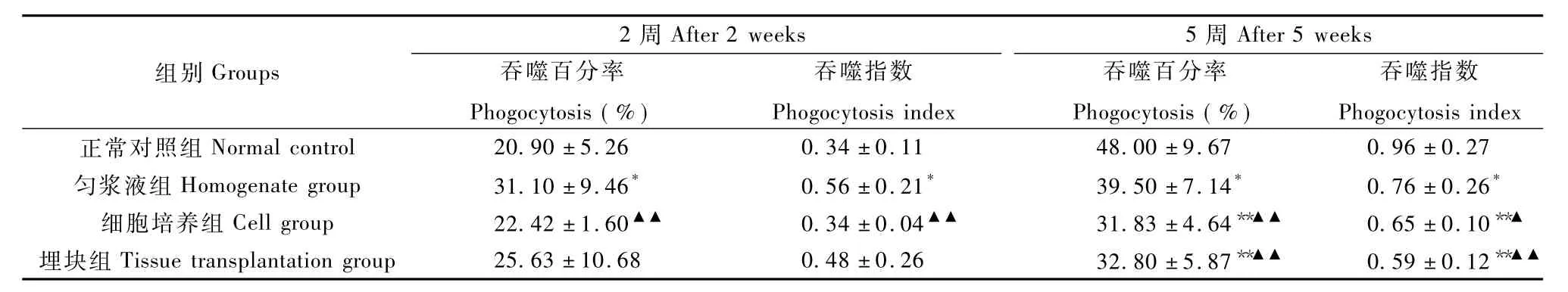
表2 三种方法荷瘤小鼠和正常小鼠腹腔巨噬细胞吞噬活性的比较(n=5,±s)Tab.2 Comparison of the phagocytosis activity index of the tumor-bearing mice in the three groups and normal mice(n=5,±s)
注:*P<0.05,**P<0.01,与正常对照组比;▲P<0.05,▲▲P<0.01,与匀浆液组比。Noto:*P<0.05,**P<0.01,vs.the control group;▲P<0.05,▲▲P<0.01,vs.the homogenate group.
组别Groups 2周After 2weeks 5周After 5weeks吞噬百分率Phogocytosis(%)吞噬指数Phogocytosis index吞噬百分率Phogocytosis(%)吞噬指数Phogocytosis index正常对照组Normal control 20.90±5.26 0.34±0.11 48.00±9.67 0.96±0.27匀浆液组Homogenate group 31.10±9.46* 0.56±0.21* 39.50±7.14* 0.76±0.26*细胞培养组Cell group 22.42±1.60▲▲ 0.34±0.04▲▲ 31.83±4.64**▲▲ 0.65±0.10**▲埋块组Tissue transplantation group 25.63±10.68 0.48±0.26 32.80±5.87**▲▲ 0.59±0.12**▲▲
2.5.2 NK活性:结果显示,接种2周时,未接种裸鼠NK活性较低,荷瘤裸鼠NK活性显著高于正常小鼠(P<0.05;P<0.01),匀浆液组NK活性最高,与细胞培养组差异有显著性(P<0.01)。5周后随着裸鼠周龄增长,其NK活性逐渐增强,正常组裸鼠NK活性升高幅度最大,三组荷瘤裸鼠NK活性低于正常组,其中细胞培养组和埋块组差异具有显著性(P<0.05;P<0.01);埋块组显著低于另外两组荷瘤组(P<0.05;P<0.01)(表3)。
表3 三种方法荷瘤小鼠和正常小鼠NK活性的比较(n=5,±s,%)Tab.3 Comparison of the NK cell activity of tumor-bearing m ice in the three groups and normal mice(n=5,±s,%)
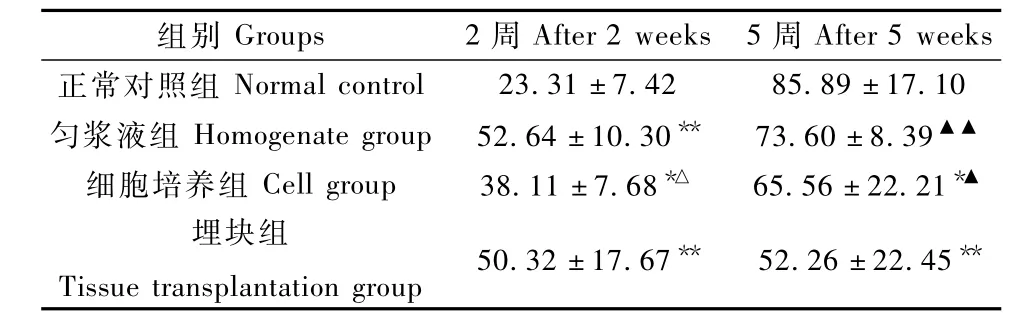
表3 三种方法荷瘤小鼠和正常小鼠NK活性的比较(n=5,±s,%)Tab.3 Comparison of the NK cell activity of tumor-bearing m ice in the three groups and normal mice(n=5,±s,%)
注:*P<0.05,**P<0.01,与正常对照组比;△P<0.05,与匀浆液组比;▲P<0.05;▲▲P<0.01,与埋块组比。Note:*P<0.05,**P<0.01,vs.the control group;△P<0.05,vs.the homogenate group;▲P<0.05,▲▲P<0.01,vs.the tissue group.
组别Groups 2周A fter 2weeks 5周After 5weeks正常对照组Normal control 23.31±7.42 85.89±17.10匀浆液组 Homogenate group 52.64±10.30** 73.60±8.39▲▲细胞培养组 Cell group 38.11±7.68*△ 65.56±22.21*▲埋块组Tissue transplantation group 50.32±17.67** 52.26±22.45**
3 讨论
人体肿瘤的裸鼠异种移植模型对抗癌药的反应与临床反映基本平行,比体外敏感性实验有更高的可靠性,是抗肿瘤药物临床前药效学的主要评价依据。潜伏期短、移植瘤成活率高、生长均匀、组织学和原始肿瘤基本符合、染色体核型和生化指标稳定的移植瘤模型在肿瘤研究和实验动物领域都至关重要[8]。故本文先以三种皮下移植方法成功建立了人大细胞肺癌移植瘤,HE染色结果显示移植瘤组织形态呈现典型的上皮癌细胞特征,与大细胞肺癌临床病理检查结果相符。细胞培养和匀浆液移植法由于接种细胞数可控,肿瘤大小均匀,生长曲线基本符合 Gompertzian曲线,由于接种量较大,接种后肿瘤组织在短期内呈膨胀性生长,平台期较长,多处于 Gompertzian曲线上段,肿瘤的生长指数(grow th fraction,GF)值较低,较好地模拟了多数临床可检肿瘤的生长特征,但是已知抗肿瘤药的一大作用机制是干扰DNA合成及其功能,因此,GF值低、增殖较慢的肿瘤对这些药物就不敏感,不适于抗肿瘤药物的筛选[9]。尤其是目前广泛应用于抗肿瘤研究的中草药,具有起效慢,疗效缓,疗程长的特点。本文采用的组织块移植法通过将组织块体积由常用的1~2mm3缩小为0.5mm3,使肿瘤生长Gompertzian曲线多处于对数生长期,肿瘤的分裂指数升高,可以增加其对药物的敏感,使其更有利于抗肿瘤中药的药效学研究。该方法由于接种的组织块无法保证均一,所以对成瘤率和均匀性造成了影响。
当前大量的研究集中于人肿瘤裸鼠移植瘤模型的构建以及瘤组织生物学特性的研究,对荷瘤机体生理状态和免疫功能的研究甚少,缺乏对肿瘤的整体认识。血液中白细胞计数、分类以及生化指标检测是目前临床上判断人体健康状况或疾病的最常用的诊疗手段之一。在许多异常情况下(包括炎症、损伤等)都会出现血液中白细胞计数、分类以及生化指标的改变。我们的研究发现,荷瘤裸鼠的ALT、AST显著高于正常裸鼠,说明伴随着肿瘤生长,荷瘤裸鼠的肝功能下降,肝损伤明显,剖检指标升高最明显的匀浆液组裸鼠发现肝脏有转移结节。提示大细胞肺癌在生长后期发生了肝转移[10]。荷瘤裸鼠BUN、CREA显著降低,这与徐彩菊等[11]研究结果一致。临床上BUN降低与肝功能衰竭有关,CREA的降低主要受贫血、营养状况的影响。本实验的3种方法中,埋块组的BUN显著高于另两个荷瘤组,推测与其肝转移程度远远小于其他两组有关。此外,接种2周后,荷瘤裸鼠的Glu显著低于正常裸鼠,匀浆液组的Glu降得最低,这可能与肿瘤在此阶段膨胀性生长过度利用葡萄糖有关[12]。白细胞分类检测结果显示,荷瘤小鼠血液中白细胞计数升高,说明肿瘤与炎症存在着密不可分的联系;血小板数升高,血红蛋白含量下降,提示恶性肿瘤的血液高凝和贫血状态;淋巴细胞和单核细胞的百分比下降提示肿瘤患者细胞免疫功能低下,与张奉梅等[13]研究结果一致。
众所周知,裸鼠由于无胸腺,T细胞免疫功能缺陷,使得动物模型不能确切反映人类免疫系统的特点,严重阻碍了肿瘤免疫学的发展。事实上,成年裸鼠(6~8周龄)较普通鼠有较高水平的天然杀伤(NK)细胞活性,但幼鼠(3~4周龄)的NK细胞活性低下[14]。NK细胞是非特异性细胞免疫系统的主要成员,其细胞毒作用可以通过Fas/FasL途径介导的细胞凋亡来实现。肿瘤发展与NK细胞水平下降及FasL表达水平降低有关。同时NK细胞与T细胞存在高度的同源性,能间接反应特异性细胞免疫系统[15]。我们在实验中发现,荷瘤裸鼠的腹腔巨噬细胞吞噬活性及NK细胞活性均表现为先升高,后降低。这与“肿瘤免疫监视理论”一致[16]。该理论认为,一旦肿瘤发生即产生针对外源性组织相容性复合体(MHC)抗原的免疫应答。免疫系统能持续地监视体内存在的异常细胞,识别并摧毁他们。表现为肿瘤发生的早期机体免疫功能升高,随着肿瘤的生长,免疫功能下降。匀浆液组在接种的初期非特异性免疫功能增强明显,可能与其接种的死细胞比例高产生较强的免疫应答有关。
本实验采用的三种方法,细胞培养和匀浆液移植法接种数量可控,肿瘤生长均匀,适合建立不同实验需求的移植瘤模型。但是匀浆液移植法由于在制备匀浆悬液的过程中死细胞较多,接种后产生的炎症应答较强,动物状态差,容易继发感染,不推荐使用。组织块移植法在改良后非常适于建立中药抗肿瘤筛选的动物模型。裸鼠的生理生化状态和免疫功能与肿瘤的生长有密切的关系。提示从整体角度出发,选择能更好地模拟临床肿瘤的发生发展的动物模型对开展抗肿瘤药作用机制的研究具有重要意义。
[1]王兴旺,胥彬.抗肿瘤药物筛选模型和方法研究的新结果[M].见:郑树主编.中国癌症研究进展③.北京:军事医学出版社.1998:110-113.
[2]林芸秀,吕联煌,林锦娟,等.人小细胞肺癌NCI-H446细胞裸鼠异种移植瘤模型的建立[J].实验动物科学与管理,2004,3:1-3.
[3]饶子亮,刘盛来,黄小琼,等.亚砷酸对裸鼠宫颈癌移植瘤模型的干预研究[J].中国比较医学杂志,2009;,9:22-25.
[4]张胜本,黄显凯,饶本强.SW-480裸鼠移植瘤模型的建立及其生物学特性 [J].第三军医大学学报,2000,22:109 -111.
[5]张宝来,徐明丽,高明堂,等.提高人肺腺癌裸鼠皮下移植瘤成瘤率的方法学研究[J].中国临床药理学与治疗学,2007,12:1052-1057.
[6]沈晓珑,沈文率,刘少杰,等.扶正抗癌汤对荷瘤裸鼠非特异性细胞免疫系统的作用[J].山西医科大学学报,2005,36:448-450.
[7]刘安军,车伟,张旭,等.软骨多糖对荷瘤小鼠免疫功能影响的初步研究[J].中国比较医学杂志,2008,18:48-51.
[8]韩锐,主编.抗肿瘤药物研究与实验技术[M].北京:北京医科大学中国协和医科大学联合出版社.1997:
[9]甄永苏.恶性肿瘤治疗的病理药理学基础与新药研发[M].见:甄永苏主编.抗肿瘤药物研究与开发.北京:化学工业出版社.2004:7-15.
[10]Howard RB,Mullen JB,Pagura ME,et al.Characterization of a highly metastatic,orthotopic lung cancer model in the nude rat[J].Clin Exp Metastasis.1999,17:157-162.
[11]徐彩菊,姚亚萍,孟佳,等.S180荷瘤小鼠血液中指标的变化[J].中国卫生检验杂志.,2007,17:2033-2035.
[12]李建鹏,朱图志,巩克亭,等.顺铂为基础的联合化疗对非小细胞肺癌患者血糖影响的临床观察[J].中华肿瘤防治杂志,2009,16(23):1878-1880.
[13]张奉梅,龚继勇,龚继梅,等.加味当归补血汤对荷瘤小鼠血液流变学及免疫功能的影响[J].时珍国医国药,2010, 21(9):2247-2248.
[14]周雪瑞,黄选东.免疫缺陷动物裸鼠[J].生物学教学.2007,32(3):2-4.
[15]Velthuis J H,de Bont HJ,Medema JP,et al.Interleukin-2activated NK cells do not use the CD95L-and TRAIL-pathways in the rapid induction of apoptosis of rat colon carcinoma CC531s cells[J].Immunobiology,2003,207(2):115-127.
[16]李帅,王小平.肿瘤细胞疫苗研究进展[J].现代肿瘤医学.2010,18:618-620.
