高热量高蛋白饮食诱导GK大鼠糖尿病肾病模型的建立
2012-01-30徐孝平寿旗扬陈方明周卫民蔡月琴陈民利
徐孝平,寿旗扬,陈方明,周卫民,蔡月琴,陈民利
(1.浙江大学动物科学学院,杭州 310029;2.浙江中医药大学动物实验研究中心,杭州 310053)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见的微血管并发症,是由于DM引起的肾小球基底膜增厚,系膜扩张以及胞外基质增生,导致肾小球的高滤过和蛋白尿[1]。2010版《中国2型糖尿病指南》指出目前我国20岁以上的成人DM的患病率在9.7%,而2型DM约占到95%,2001年国内住院患者回顾分析显示2型DM并发DN的患病率为34.7%,因此对2型DN的发病研究成为目前的热点之一。目前国内外研究建立的2型DN模型主要是应用小剂量链脲佐菌素(STZ)加高脂饮食诱导,存在着造模时间长,模型稳定性不足等问题。GK大鼠是1975年由Goto等人选育的与人类2型DM近似的自发性非肥胖2型糖尿病鼠种[2],目前已有一些针对 GK大鼠肾脏改变的研究,但还存在着发病时间晚、症状不够明显的问题[3-6]。研究表明,由胰岛素代谢障碍而致长期高血糖是DN发生的最关键原因[7],饮食蛋白过高是糖尿病肾病的危险因素[8],脂代谢紊乱亦是 DM和DN发生的一项独立的危险因素[1]。本实验通过给予GK大鼠高热量高蛋白饮食,诱发GK大鼠形成高血脂高血糖,高蛋白尿,以期加快GK大鼠形成2型DN模型,并探讨其可能的作用机制。
1 材料和方法
1.1 实验动物
清洁级雄性GK大鼠28只,28周龄,由上海斯莱克实验动物有限公司提供[SCXK(沪)2007—0005],饲养于浙江中医药大学动物实验研究中心屏障动物实验设施[SYXK(浙)2008—0115],室温(23±2)℃,相对湿度60% ~70%。
1.2 试剂
尿微量白蛋白(U-ALB)检测试剂盒、尿蛋白(U-TP)检测试剂盒、肌酐(Cr)检测试剂盒、尿素氮(BUN)检测试剂盒、血糖(GLU)检测试剂盒、总胆固醇(TC)检测试剂盒、甘油三脂(TG)检测试剂盒由上海申能-德赛诊断技术有限公司提供;钠钾ATP酶(Na+K+-ATPase)检测试剂盒、一氧化氮(NO)检测试剂盒由南京建成生物工程研究所有限公司提供。
1.3 实验仪器
7 020全自动生化分析仪(日本日立),BT-815A半自动生化分析仪(上海三科仪器有限公司),AG204电子分析天平(瑞士Mettler),HM 335E型轮转切片(德国Microm),染色机(德国Leica),AP280组织包埋机(德国Microm),脱水机(德国Microm),显微镜(德国Zeiss)。
1.4 实验方法
1.4.1 实验分组及2型DN模型的建立:动物随机分成模型组、对照组,每组各12只。模型组给予高热量高蛋白饲料(饲料组成:基础饲料59.75%,酪蛋白19%,猪油10%,蔗糖10%,胆固醇1%,3号胆盐0.25%,蛋白质∶脂肪∶碳水化合物热量比为28.3∶28.3∶44.3);对照组给予基础饲料(蛋白质∶脂肪∶碳水化合物热量比为24.6∶12.5∶62.9),由浙江省医学科学院配制提供,共饲养8周。根据Mogensen[9]对DN的分期标准判定 GK大鼠糖尿病肾病的发生。
1.4.2 指标观察;
1.4.2.1 动物一般状况:每日观察大鼠饮食饮水、精神状态、活动情况、大便性状、每周测体重并记录。
1.4.2.2 尿液生化指标:各组于第0、4、8周上代谢笼,测定24h尿量,并取尿液离心取上清液检测UALB、U-TP、U-Cr水平,并计算24h U-ALB、24h UTP、U-ALB/U-Cr比值。
1.4.2.3 血液生化指标:各组于第0、8周,禁食不禁水10h,取血分离血清,检测空腹血糖(FBG)和血清肌酐(Scr)、BUN、TC、TG、NO水平。NO采用硝酸还原酶法测定,使用半自动生化仪检测。
1.4.2.4 肾重指数:各组大鼠称取体重,末次取血后,取双侧肾脏,去除肾包膜,称重,计算肾重指数,肾重指数=双侧肾重/体重‰。
1.4.2.5 组织病理学指标:肾组织用4%中性甲醛溶液固定24h后,乙醇脱水,石蜡包埋,切片,进行HE染色和 PAS染色,光镜下观察肾组织病理学变化,根据 Tervaert等[10]发布的DN病理分型标准判断GK大鼠肾脏的病变程度。
1.5 数据处理及统计
所有数据均采用 SPSS 18.0软件进行统计,用均数±标准差(±s)表示,组间比较采用t检验,以P<0.05作为差异显著性界值。
2 结果
2.1 一般观察和体重变化
两组大鼠在实验过程中均未有死亡,对照组动物精神状况略优于模型组,模型组大鼠体重增长略快于对照组,但差异未有显著性(P>0.05)。见表1。
2.2 24h尿微量白蛋白、24h尿蛋白、尿微量白蛋白与尿肌酐比值的动态变化
与对照组相比,模型组的第0周24h-U-ALB水平、24h-U-TP水平和U-ALB/U-Cr比值差异无显著性(P>0.05),第4、8周时各指标水平都显著升高(P<0.01);与第0周相比,模型组大鼠第4、8周24h U-ALB水平、24h-U-TP水平和U-ALB/U-Cr比值显著升高(P<0.01),对照组大鼠第4、8周24h-UALB水平显著升高(P<0.01),24h-U-TP水平无显著差异(P>0.05),U-ALB/U-Cr比值水平显著升高(第4周P<0.05,第8周P<0.01)。见图1。
2.3 肾肥大指数和肾组织钠钾ATP酶活性的比较
与对照组相比,模型组大鼠肾肥大指数显著升高(P<0.01),模型组大鼠肾组织钠钾ATP酶活性显著升高(P<0.01)。见图2。
2.4 空腹血糖、一氧化氮、肾功能、血脂水平的变化

图1 两组大鼠24h尿微量白蛋白、24h尿蛋白、尿微量白蛋白与尿肌酐比值的动态变化Fig.1 Dynamic changes of 24h-U-ALB,24h-U-TP and U-ALB/Ucr in the two groups of rats.注:与对照组比较,**P<0.01;与第0周比较,△P<0.05,△△P<0.01Note:Compared with the control group,**P<0.01;Compared with week 0,P<0.05,△△P<0.01

图2 两组大鼠肾肥大指数和肾组织钠钾ATP酶活性的比较Fig.2 Comparison of kidney hypertrophy index and Na+K+-ATPase activity in the two groups of rats.注:与对照组比较,**P<0.01.Note:Compared with the control group,**P<0.01
与对照组相比,模型组第0周的FBG、NO、Scr、BUN、TC、TG水平差异无显著性(P>0.05),第8周的FBG、NO、TC、TG水平差异有显著性(P<0.01),Scr、BUN水平差异无显著性(P>0.05);与第0周相比,模型组第8周的FBG、NO、TC、TG水平差异有
显著性(P<0.01),Scr、BUN水平差异无显著性(P>0.05),对照组第8周的NO水平差异有显著性(P<0.01),其余指标水平差异均无显著性(P>0.05)。见表1。
2.5 肾脏组织病理变化
HE染色结果显示,对照组大鼠肾脏结构清晰,肾小球未见明显增大,系膜细胞未见明显增多,模型组大鼠肾脏体积增大,肾小球囊腔狭窄,球内细胞增多,可见部分肾小管成上皮管型。PAS染色结果显示,对照组大鼠肾小球系膜基质稍增多,基底膜增厚,模型组大鼠肾小球基底膜明显增厚,系膜区增宽,PAS染色阳性区域成团块状。根据Tervaert等发布的DN病理分型标准,对照组大鼠肾脏病变有9例为IIa型、3例为IIb型;模型组大鼠肾脏病变有2例为IIa型、9例为IIb型、1例为III型(图3,见彩插6)。
3 讨论
DN发病机制比较复杂,至今尚不完全清楚,除遗传因素、高血糖相关代谢紊乱以外,还与血脂异常、饮食中蛋白和脂肪摄入的数量、高血压、精神等多因素有关[11]。研究2型 DN需先建良好的2型DM模型,目前国内常用小剂量 STZ加高脂饮食诱导2型DM,国外2型DM研究多采用具有自发性糖尿病倾向的近交系动物,如db/db小鼠、OLETF大鼠、肥胖型Zuker大鼠、GK大鼠等。小剂量STZ加高脂饮食诱导的2型DN模型忽略了DN发病的遗传因素,还存在造模时间偏长,稳定性不足的问题;通过自发生2型DM模型引起2型DN,只考虑遗传因素在发病过程中的主导作用,这与临床并不完全相符,且成模时间也长。
GK大鼠主要表现为胰岛素分泌受损,葡萄糖负荷后胰岛素释放异常,肝脏、肌肉和脂肪组织中度胰岛素抵抗等。GK大鼠的血糖随着年龄增长而升高,继而出现肾脏结构和功能的改变,肾脏组织学改变主要包括肾小球基底膜增厚,肾小球膜基质增多,肾小球增生等[2],在长期糖尿病后,GK大鼠出现肾小球肥大,局灶性肾小球硬化,肾小管间质纤维化,炎症细胞浸润等形态学变化[12]。但目前的研究显示,GK大鼠的高血糖因素在主导糖尿病肾病发展上存在着发病时间晚,症状不够明显的问题。本实验通过运用GK大鼠,结合 DN发病过程中遗传因素、长期高血糖、饮食蛋白和脂肪摄入等各种因素,以期建立更与人类疾病相似的2型 DN模型。
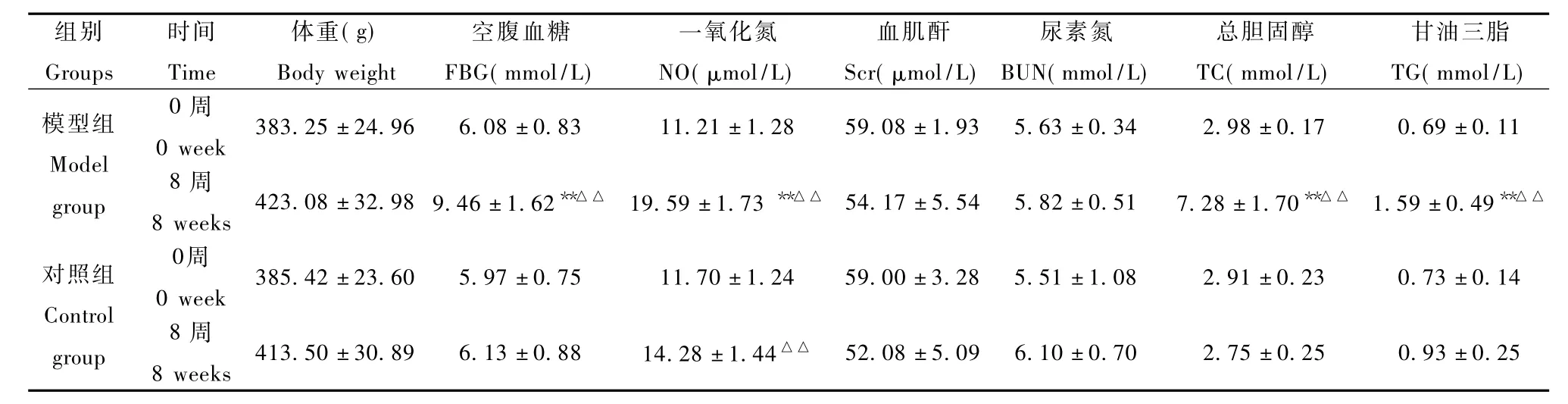
表1 两组大鼠体重、空腹血糖、一氧化氮、肾功能、血脂水平的变化Tab.1 Changes of body weight,FBG,NO,Scr,BU,、TC,and TG in the two groups of rats
本实验发现,8周后模型组大鼠FBG、TG、TG水平显著高于对照组,模型组的2型糖尿病症状更加明显。临床上以24h-U-ALB作为早期诊断DN的金指标,目前的研究表明U-ALB/U-Cr比值亦有很高的诊断价值[13],本实验发现,模型组24h-U-ALB、U-ALB/U-Cr比值、24h-U-TP亦显著高于对照组,且随着实验时间的延长而加重,Mogensen的DN分期标准指出,尿白蛋白排泄率(uAE)在30~300mg/24h为早期 DN期,uAE>300mg/24h为显性 DN期,按体重折算成大鼠这两期uAE指标分别为0.2~2mg/24h和2mg/24h,结果表明,模型组大鼠基本处在显性DN期。糖尿病肾脏肥大是出现最早、最明显的肾脏病理改变,而肾重指数是衡量肾脏肥大较客观的指标,模型组大鼠肾重指数明显高于对照组,病理检查显示,肾脏体积增大,肾小球囊腔狭窄,球内细胞增多,基底膜明显增厚,系膜区增宽,根据Tervaert的DN病理分型标准,模型组大鼠肾病病理分型基本在 IIb型,与非病理指标判断基本相符,表明模型已诱导成功。研究表明体内高血糖状态下,激活与醛糖还原酶相关的多元醇通路,造成进入肾组织细胞的葡萄糖转变为不易透过细胞膜的山梨醇和果糖,在细胞内堆积而造成细胞肿胀和破坏,并促进大分子糖化终末产物形成,造成肾小球基底膜增厚[14],且能促使蛋白激酶 C活性升高,引起细胞黏附因子在肾小球膜细胞中的表达,加速肾小球损伤,高血糖致血容量扩张,从而使肾血流量增加,造肾小球滤过率升高,促进DM向DN的转变。血脂异常导致肾脏损伤的可能机制有肾小球基底膜脂质沉积,刺激基底膜细胞增殖和细胞外间质生成,降低纤溶活性,造成肾小球毛细血管的血栓栓塞,改变血管阻力使肾小球呈高滤状态,尿白蛋白排出增加等。实验中,模型组肾功能与对照组并无差异,考虑可能和病程较短有关,还未达到DN晚期。研究表明,NO的升高导致肾小球毛细血管的高灌注、高滤过,从而增加肾的工作负荷,促使DN的恶化[15];在STZ诱导的DM大鼠早期,肾组织Na+K+-ATPase活性明显增强,与DN的发生发展有显著的相关性[16]。本实验显示,模型组的肾组织Na+K+-ATPase的活性和血清NO显著升高,进一步加剧了GK大鼠向2型DN的进展。
[1]王战建.糖尿病肾病发病机制的研究进展[J].国际泌尿系统杂志,2006,26(5):693-696.
[2]王芬,何华亮,刘铜华,等.自发的2型糖尿病动物模型[J].中国实验动物学报,2007,15(5)395-398.
[3]Phillips AO,Baboolal K,Riley S,et al.Association of prolonged hyperglycem ia with glomerular hypertrophy and glomerular basement membrane thickening in the Goto Kakizaki model of non-insulin-dependent diabetes melltitus[J].Am J Kidney Dis,2001,37:400-410.
[4]Cheng ZJ,Vaskonen T,Tikkanen I,et al. Endothelial dysfunction and salt-sensitive hypertension in spontaneously diabetic Goto-Kakizaki rats[J].Hypertension,2001,37:433-439.
[5]Sato N,Komatsu K,Kurumatani H.Late onset of diabetic nephropathy in spontaneously diabetic GK rats[J].Am J Nephrol,2003,23:334-342.
[6]Sehrijvers BF,De Vriese AS,Van de Vorde J,et al.Long-term renal changes in the Goto-Kakizaki rat,a model of lean type 2diabetes[J].Nephrol Dialysis Transpl,2004,19:1092-1097.
[7]李景丽.对糖尿病肾病危险因素的研究进展[J].广西中医学院学报,2009,12(2):81-83.
[8]Hansen HP,Tauber LE,Jensen BR,et al.Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy[J].Kidney Int,2002,62:220-228.
[9]Mogensen CE.Microalbuminuria as a predictor of clinical diabetic nephropathy[J].Kidney Int.1987,31(2):673-89.
[10]Tervaert TW,Mooyaart AL,Amann K,et al.Pathologic classification of diabetic nephropathy[J].J Am Soc Nephrol.2010,21(4):556-563.
[11]Jorge LG,Mirela JA,Sandra PS,et al.Diabetic nephropathy:diagnosis,prevention,and treatment[J].Diabetes Care,2005,28:164-176.
[12]刘毅,王宗保.糖尿病肾病动物模型的研究进展[J].中国实验动物学报,2006,14(1):67-70.
[13]孔建新,姚丽娟,罗以勤,等.多项生化检测指标对诊断早期糖尿病肾病的价值[J].安徽医学,2009,30(4):380-381.
[14]Jensen LJ,Stergaard J,Flyvbjerg A.AGE-RAGE and AGE cross-link interaction:important p layers in the pathogenesis of diabetic kidney disease[J].Horm Metab Res,2005,37:26-34.
[15]李凝,陆付耳,董慧,等.小檗碱对糖尿病大鼠早期肾脏高滤过状态的干预作用[J].中国比较医学杂志,2007,17 (4):192-196.
[16]Scherzer P,Popovtzer MM.Segmental localization of mRNAs encoding Na+-K+-ATPase α1-and β1-subunits in diabetic rat kidneys using RT-PCR[J].Am J Physiol Renal Physiol,2002,282(3):F492-F500.
