格列本脲在糖尿病大鼠体内药动学评价
2012-01-30李育卿魏玉辉武新安
李育卿,魏玉辉,周 燕,王 丹,张 帆,武新安
(1.兰州大学第一医院药剂科,兰州 730000;2.兰州大学药学院,兰州 730000)
链脲佐菌素能够快速而稳定地选择性破坏胰岛β细胞功能,诱发大鼠实验性糖尿病模型的常用药物。空腹一次性腹腔注射大剂量(50~70mg/kg)[1-4]的链脲佐菌素制备的糖尿病大鼠模型是常常被用来评价评价降糖药物药效的手段。考察糖尿病动物成模的指标一般以空腹血糖值为依据,然而该模型对药物的吸收、分布、代谢和排泄过程是否和糖尿病病人一致少有报道。我们通过比较Niopas等[5]报道的健康受试者与Coppack等[6]报道的II型糖尿病患者口服格列本脲药动学参数后发现,健康受试者和糖尿病人格列本脲的药动学参数无明显变化,这意味着格列本脲在健康受试者与II型糖尿病病人(无肾病)的体内过程无差异。本实验试图比较格列本脲在正常大鼠和一次性腹腔注射60mg/kg链脲佐菌素诱发糖尿病大鼠模型的药动学是否存在差异,并与文献健康受试者和糖尿病人药动学相比,研究此模型与II型糖尿病病人的药动学是否一致,从而为确定链脲佐菌素诱发糖尿病大鼠模型是否适合作为药物的评价模型提供依据。
1 材料和方法
1.1 仪器
岛津LC-20AT二元梯度泵,SPD-M20A二级阵列检测器,DGU-20A在线脱气系统,SL-20A自动进样系统,CTO-20A柱温箱,LC Solution色谱工作站(岛津,日本);SHZ-III型循环真空水泵(上海亚荣生化仪器厂),高速离心机(深圳国华仪器厂),XW-80A漩涡混合器(上海医科大学仪器厂),LT-224S电子天平(北京赛多利斯)。
1.2 药品与试剂
链脲佐菌素(Sigma公司,批号:18883-66-4),格列本脲对照品(中国药品生物制品检定所,批号:10135-0103),地西泮对照品(中国药品生物制品检定所,批号:1230-960),格列本脲片(山西云鹏制药有限公司,批号:A081001),甲醇(色谱纯,德国默克公司),乙腈(色谱纯,山东禹王实业公司禹城化工厂),其他试剂均为国产分析纯。去离子水(兰州大学第一医院自制)。
1.3 动物
健康雄性W istar大鼠,体重200~250g,购于甘肃省中医学院实验动物中心,合格证号SCXK(甘) 2004-0006。所有大鼠使用代谢笼单只喂养,自由饮水及给予标准化饲料。
1.4 方法
1.4.1 色谱条件:色谱柱:伊利特 Hypersil ODS2(4.6mm ×150mm,5μm),流动相:甲醇-0.2%乙酸溶液(57∶43,v/v),流速:1m L/m in,柱温:40℃,流检测波长:229 nm,进样量:20μL。
1.4.2 储备液的配制:
1.4.2.1 内标溶液:精密称取地西泮对照品适量置于100m L的容量瓶中,用乙腈定容至100m L,使地西泮浓度为0.205μg/mL,作为内标溶液。
1.4.2.2 格列本脲储备液:精密称取格列本脲对照品适量置于50m L的容量瓶中,用内标溶液配制成0.0852mg/m L的储备液,置于4℃冰箱中保存,使用时用内标溶液稀释至所需浓度。
1.4.3 血浆样品处理:取血浆样品100μL,加内标溶液200μL,旋涡振荡2min,3500r/min离心10m in,将除蛋白后的溶液转移至装有30mg~50mg氯化钠的1.5mL离心管中,涡旋振荡1min,静置吸取上层有机层,40℃水浴氮气吹至少许,用乙腈溶解至50μL,超声、混匀后取20μL进样分析。
1.4.4 色谱行为:在上述色谱条件下,格列本脲的保留时间为 12.55min,内标的保留时间为 8.57 m in。内源性杂质不干扰格列本脲与内标的分离测定。图1为空白血样、加样血浆及含内标的血浆样品色谱图。
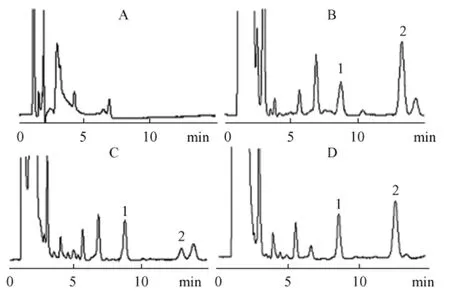
图1 HPLC色谱图A-空白血浆;B-空白血浆+格列本脲标准品 +内标;C-正常大鼠灌胃给予10mg/kg后120min的血浆样品;D-糖尿病大鼠灌胃给予10mg/kg后120min的血浆样品;(1为内标,2为格列本脲)Fig.1 HPLC chromatograms of blood plasma of the ratsNote:A:Blank plasma;B:Blank plasma spiked with glibenclamide and internal standard;C:Nomal rat plasma collected at two hours after intragastrically administration of glibenclamide 10mg/kg;D:Diabetic rat plasma taken at two hours after intragastrically administration of glibenclam ide 10mg/kg;(1:internal standard;2:glibenclamide)
1.4.5 标准曲线制备和最低检测浓度:精密吸取格列本脲对照品储备液适量,用内标溶液稀释至15.62、31.25、62.50、125.00、500.00、1000.00、1 500.00μg/L的系列对照品溶液。取上述对照品溶液200μL与100μL空白大鼠血浆混合按血浆样品处理1.4.3项下操作,进样分析。记录格列本脲和内标峰面积。以格列本脲与内标的峰面积比为纵坐标(Y),格列本脲的浓度为横坐标(X)进行线性回归,回归得方程为:Y=3.8771X+0.0378,r2= 0.9993。表明格列本脲在 15.62μg/L~1500.00μg/L范围内,浓度与峰面积的线性关系良好。检测限(S/N≥3)为3μg/L,血浆中格列本脲定量限(S/N≥10)为8μg/L。
1.4.6 精密度:配制高、中、低3种浓度(1000.00、125.00、31.25μg/L)三个不同浓度的格列本脲标准质控样品,按血浆样品处理1.4.3项下操作,进行色谱分析,代入标准曲线方程计算格列本脲浓度。一日内测定5次及每日测定1次,连续5d,计算日内日间精密度。日内精密度分别为3.72%,3.31%,4.58%。日间精密度分别为5.47%,9.12%,8.48%。
1.4.7 回收率:配制高、中、低(1000.00、125.00、31.25μg/L)三个不同浓度的格列本脲标准质控样品,按血浆样品处理1.4.3项下操作,进行色谱分析,代入标准曲线方程计算格列本脲浓度。将实测值与理论值相比得到相对回收率,高、中、低浓度的格列本脲在大鼠血浆中的平均回收率分别为(95.73±6.17)%、(102.58±4.55)%、(93.23± 3.07)%。
1.5 药动学研究
1.5.1 造模及采集血样:健康雄性W istar大鼠13只,(200~250)g,随机分为两组,即正常组5只和糖尿病组8只。糖尿病组大鼠禁食16h后腹腔注射链脲佐菌素60mg/kg。72h后断尾取空腹血,葡萄糖氧化酶法测定空腹血糖。将空腹血糖高于16.7 mmol/L的大鼠视为造模成功,取5只纳入实验。给药前禁食12h,自由饮水,灌胃给予格列本脲混悬液10mg/kg。于给药前及给药后15、30、60、90、120、150、180、240、360、540、720min,经股动脉插管采血0.25m L,同时补充等量含40IU/m L肝素钠的生理盐水,血样立刻转入涂过肝素钠的1.5mL离心管中,在3500r/m in离心5m in得血浆,取血浆100μL在血浆样品处理1.4.3项下操作,测定血药浓度。
1.5.2 数据处理
血药浓度测定结果用 Drug and Statistics of Windows 2.0(DAS 2.0)统计软件进行处理,计算药动学参数。正常组与模型组比较采取 t检验,P<0.05为有统计学意义。
2 结果
2.1 药时曲线及与药动学参数
图2为格列本脲在正常组和模型组的药-时曲线图。由图可以看出,糖尿病大鼠组格列本脲的血药浓度高于正常大鼠组,且达峰时间延长。
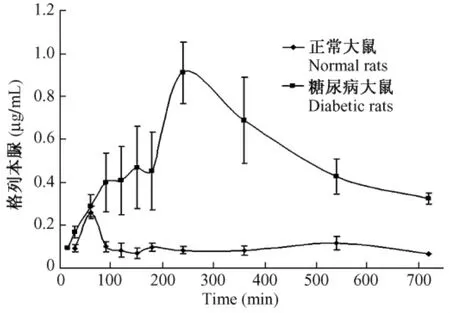
图2 灌胃给予格列本脲10mg/kg正常大鼠和糖尿病大鼠血药浓度-时间曲线(±s,n=5)Fig.2 Mean plasma concentration-time curves of glibenclamide after intragastrically administrationin a dose of 10mg/kg in normal rats and diabetic rats(±s,n=5)
对药时曲线中的数据用 DAS 2.0统计软件进行处理,拟合后符合权重因子为1/CC的一室模型,主要的药动学参数见表1。
3 讨论
一次性大剂量注射链脲佐菌素制备的糖尿病大鼠模型常被用来研究药物在糖尿病状态下的药动学和药效学[1,4,7-9]。武开明[7]采用一次性腹腔注射65mg/kg链脲佐菌素制备糖尿病大鼠模型,并比较了小檗碱在正常和糖尿病大鼠的药动学,其结果表明,在糖尿病大鼠体内,小檗碱的Cmax和AUC(0~24h)与正常大鼠相比分别提高了1.3倍(P<0.05)和1.5倍(P<0.05)。刘晓等[8]采用相同方法制备糖尿病大鼠模型,经研究发现芦丁在糖尿病肾病大鼠体内的AUC(0-t)与正常大鼠相比显著增大(P<0.01),血浆清除率显著减小(P<0.05)。为了考察糖尿病对二甲双胍药动学的影响,本实验室秦红岩等人[10]采用空腹一次性腹腔注射60mg/kg链脲佐菌素制备糖尿病大鼠模型,结果表明盐酸二甲双胍在糖尿病大鼠体内的Cmax、Tmax、t1/2及 AUC均显著高于正常大鼠(P<0.01),其CL/F显著低于正常大鼠(P<0.01)。本课题结果表明格列本脲在正常大鼠和链脲佐菌素制备的糖尿病模型体内的药动学存在显著性差异。可见链脲佐菌素制得的糖尿病大鼠模型对药物的药动学有较为显著的影响。
表1 正常大鼠组和糖尿病大鼠组格列本脲主要药动学参数(±s,n=5)Tab.1 Pharmacokinetic parameters of glibenclamide in the normal and diabetic rats(±s,n=5)
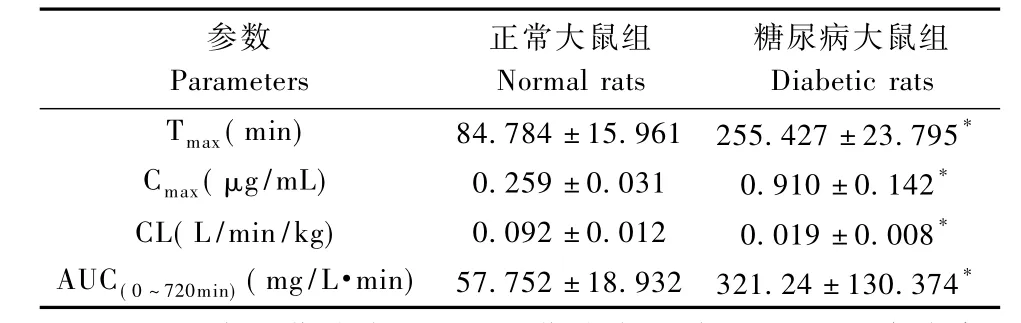
表1 正常大鼠组和糖尿病大鼠组格列本脲主要药动学参数(±s,n=5)Tab.1 Pharmacokinetic parameters of glibenclamide in the normal and diabetic rats(±s,n=5)
注:Cmax,达峰血药浓度;Tmax,血药浓度达峰时间;CL,清除率;AUC(0~720min),药时曲线下面积。与正常组相比,*P<0.05Note:Cmax:peak p lasma concentration;Tmax:time to reach Cmax;CL:total body clearance;AUC(0~720min), area under the plasma concentration-time curve from time 0to 720min.Compared with the normal rats,*P<0.05
参数Parameters正常大鼠组Normal rats糖尿病大鼠组Diabetic rats Tmax(min) 84.784±15.961 255.427±23.795* Cmax(μg/m L) 0.259±0.031 0.910±0.142* CL(L/min/kg) 0.092±0.012 0.019±0.008* AUC(0~720min)(mg/L·min) 57.752±18.932 321.24±130.374*
但是,Sambol等[11]比较了盐酸二甲双胍在健康受试者与II型糖尿病患者(无肾病)体内的药动学,结果显示健康受试者与糖尿病患者的所有药动学参数无显著差异。Niopas等[5]报道了健康受试者口服5mg/kg格列本脲的部分药动学参数,如下:Tmax为 3.6 ±2.3 h,Cmax为167 ±63.4 ng/m L,AUC(0-24h)为808.6±279.4ng·h/m L。Coppack等[6]报道了II型糖尿病病人(无肾病无肝病)口服5mg/kg格列本脲的部分药动学参数:Tmax为2.71±0.44h,Cmax为152±26ng/m L,AUC(0-24h)为1154±351ng·h/m L。通过比较两组数据,格列本脲在健康受试者和II型糖尿病病人体内药的药动学参数也无显著性差异。因此,药物在一次性大剂量注射链脲佐菌素制得的糖尿病大鼠模型体内的药动学变化和糖尿病患者体内药动学的变化存在差异。
造成降糖药物在糖尿病模型大鼠与正常大鼠体内药动学参数存在差异而在 II型糖尿病病人和健康受试者体内药动学参数无差异的原因,可能是由于一次性大剂量注射链脲佐菌素制备的糖尿病大鼠模型的病理机制与 II型糖尿病患者病理机制不同。链脲佐菌素能直接破坏胰岛素β细胞,引发糖尿病症状,同时引起脏器损害,但其作用机制尚不明确[12]。研究发现糖尿病大鼠胃排空减慢[13]可以导致格列本脲的吸收增加,从而使其AUC显著增加。链脲佐菌素及高血糖环境能造成肝脏病变以及引起肝脏代谢酶的变化[14-15]。此外链脲佐菌素具有肾毒性,可抑制肾脏细胞的增殖和凋亡,引起细胞肥大,最终导致糖尿病肾病[16-17],引起体内药物蓄积。体内肝脏及肾脏的损伤使格列本脲在糖尿病大鼠体内的总清除率下降。
因此,链脲佐菌素制得的糖尿病大鼠模型可能不完全符合II型糖尿病的病理状态。由本实验室及他人的研究数据表明,链脲佐菌素制备的糖尿病大鼠模型导致药物的体内过程与正常大鼠明显不同,与临床实际情况出入较大,从而可能不适用于考察药物在II型糖尿病病态下的药动学研究。
[1]Eidi A,Eidi M,Esmaeili E. Antidiabetic effect of garlic (Allium sativum L.) in normal and streptozotocin-induced diabetic rats[J].Phytomedicine,2006,13(9-10):624-629
[2]Akbarzadeh A,Norouzian D,Mehrabi MR,et al.Induction of diabetes by streptozotocin in rats[J].Ind J Clin Biochem,2007,22(2):60-64.
[3]Adikwu MU,Yoshikawa Y,Takada K. Pharmacodynamicpharmacokinetic profiles of metformin hydrochloride from a mucoadhesive formulation of a polysaccharide with antidiabetic property in streptozotocin-induced diabetic rat models[J].Biomaterials,2004,25(15):3041-3048.
[4]Nazaroglu NK,Sepici-Dincel A,Altan N.The effects of sulfonylurea glyburide on superoxide dismutase,catalase,and glutathione peroxidase activities in the brain tissue of streptozotocin-induced diabetic rat [ J]. J Diabetes Complications,2009,23(3):209-213.
[5]Niopas I,Daftsios AC.A validated high-performance liquid chromatographic method for the determination of glibenclamide in human plasma and its application to pharmacokinetic studies[J].J Pharm Biomed Anal,2002,28(3-4):653-657.
[6]Coppack SW,Lant AF,Mc Intosh CS,et al.Pharmacokinetic and pharmacodynamic studies of glibenclamide in non-insulin dependent diabetes mellitus[J].Br J Clin Pharmacol,1990,29 (6):673-684.
[7]武开明.葛根芩连汤中小檗碱在正常和糖尿病大鼠的药动学比较[J].中国药师,2010,13(4):467-468.
[8]刘晓,汤道权,印晓星,等.芦丁在正常及糖尿病肾病大鼠体内药代动力学研究[J].徐州医学院学报,2009,29(11):708-712.
[9]Kalaiarasi P,Kaviarasan K,Pugalendi KV.Hypolipidemic activity of 18β-glycyrrhetinic acid on streptozotocin-induced diabetic rats[J].Eur J Pharmacol,2009,612(1-3):93-97.
[10]秦红岩,段好刚,魏玉辉,等.盐酸二甲双胍在正常大鼠与糖尿病大鼠体内的药动学比较[J].中国现代应用药学杂志,2009,26(6):433-436.
[11]Sambol NC,Chiang J,O'Conner M,et al.Pharmacokinetics and Pharmacodynamics of methormin in healthy subjects and patients with noninsulin-dependent diabetes mellitus[J]. J Clin Pharmacol,1996,36(11):1012-1021.
[12]夏旋.链脲佐菌素在糖尿病模型中的应用研究[J].国际内科学杂志,2009,36(9):540-543.
[13]Ishiguchi T,Tada H,Nakagawa K,et al.Hyperglycemia impairs antro-pyloric coordination and delays gastric emptying in conscious rats[J].Auton Neurosci,2002,95(1-2):112-120.
[14]Baig NA,Herrine SK,Rubin R.Liver disease and diabetes mellitus[J].Clin Lab Med,2001,21(1):193-207.
[15]Shimojo N,Ishizaki T,Imaoka S,et al.Changes in amounts of cytochrome P450isozymes and levels of catalytic activities in hepatic and renal microsomes of rats with streptozotocin-induced diabetes[J].Biochem Pharmacol,1993,46(4):621-627.
[16]Cruzado JM,Lloberas N,Torras J,et al.Regression of advanced diabetic nephropathy by hepatocyte growth factor gene therapy in rats[J].Diabetes,2004,53(4):1119-1127.
[17]原军英.链脲佐菌素诱导大鼠糖尿病肾病模型研究进展[J].山西医药杂志,2009,38:66-68.
