环境水中总挥发性有机硫化物的检测方法
2012-01-07王艳君郑晓玲王保栋国家海洋局第一海洋研究所海洋生态研究中心山东青岛266061
王艳君,郑晓玲,何 鹰,张 栋,王保栋 (国家海洋局第一海洋研究所海洋生态研究中心,山东 青岛 266061)
环境水中的挥发性有机硫化物(VSCs)具有种类多、极性强、易氧化的特点[1].其中一些硫化物具有特殊气味,属于国内重点检测的恶臭气体,如二硫化碳(CS2)、二甲基硫(DMS)和二甲基二硫醚(DMDS)等[2].一些VSCs在进入大气对流层后被氧化为 SO2,形成硫酸盐,对区域酸沉降和全球硫循环有较大影响[3].因而这些气体受到广泛关注[4-11].
挥发性有机硫化物在环境水中的浓度很低且具有极强的吸附性,其分析测定技术是国际公认的难题.常用的检测方法为气相色谱-质谱法(GC-MS)、气相色谱-火焰光度法(GC-FPD)和气相色谱-硫化学发光法(GC-SCD)[2].然而,上述的分析方法通常仅检测水中一种或数种典型的挥发性有机硫化物,在挥发性污染物总量检测方面存在不足.
本文根据当前环境水中挥发性有机硫化物总量检测中存在的一些问题,建立了一种吹扫捕集、解析、氧化、紫外荧光检测技术.利用自行研制的低温捕集-热解析装置,对水中吹扫出的挥发性有机硫化物进行富集和热解析,在高温和助燃气作用下,有机硫化物充分氧化为 SO2,采用紫外荧光法检测 SO2含量,从而间接计算出水体中挥发性含硫化合物的总量.该装置简单、便于实现自动化操作,在环境水中 VSCs污染监测和污染物总量测定方面,具有一定的实用价值.
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 紫外荧光二氧化硫分析仪DASIBI-4000(北京中晟泰科环境科技有限公司);高温石英燃烧炉(自制),温度控制范围 200~1300℃;低温捕集-热解析装置(自制),捕集温度-30~15℃,解析温度 50~250℃,内有捕集解析盒,30cm不锈钢捕集管,管内填充Tenax-TA吸附剂(60~80目),使用前在 220℃下,通入 30mL/min的高纯氮气,老化 12h;微型电动牵引装置(自制).Nafion膜干燥管(美国纯博有限公司);可再生水气分离器(自制),内填充干燥剂无水氯化钙(AR,潍坊迪拜尔化工有限公司);无机硫化物吸收管(自制),内填充片状氢氧化钠(AR,上海山海工学团实验二厂).
1.1.2 试剂 SO2标准气体,SO2的体积分数为37.0×10-6;二甲基硫标准气体,DMS体积分数为25.1×10-6,均以高纯氮为稀释气(青岛合利气体有限公司).高纯氮气(99.999%);高纯氧(99.995%)(青岛合利气体有限公司);二甲基硫标样(色谱纯,德国的MERCK-Schuchardt公司).
1.2 实验流程
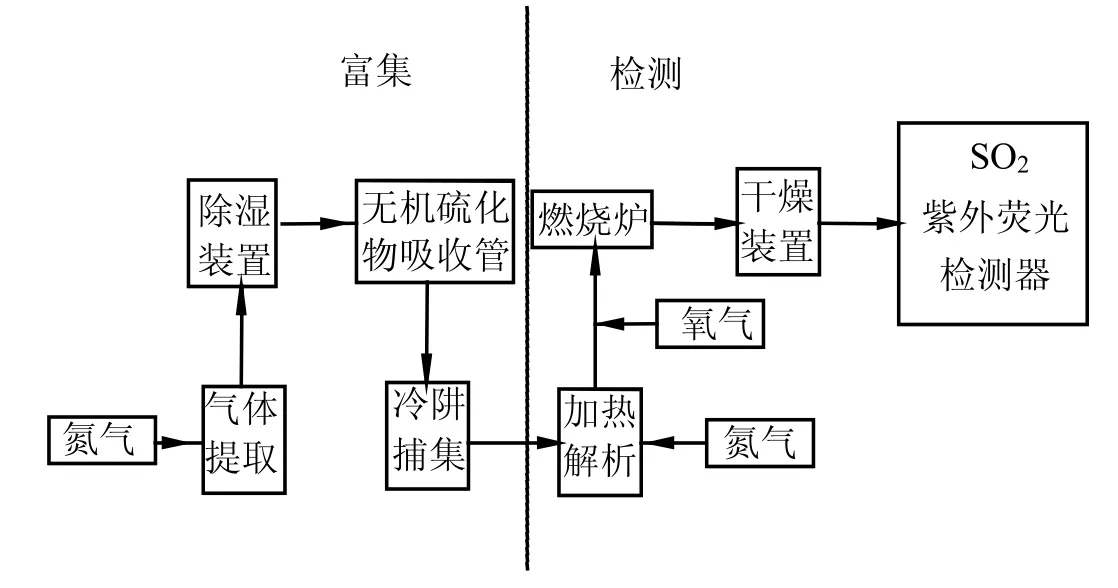
图1 挥发性有机硫化物的分析系统流程示意Fig.1 Flow diagram of VSCs analytic system
实验流程见图1.系统管路采用直径2mm的不锈钢管和3mm的Teflon管连接,接头连接均用氟橡胶密封垫,不锈钢管内壁用稀NaOH溶液清洗和水清洗,然后用丙酮清洗,烘干后再用氮气吹扫.各部件在安装前均用丙酮和石油醚清洗,用氮气加温吹干.分析实验开始前,将已活化过的水气分离器、无机硫化物吸收管和捕集管分别在50,60,150℃下吹扫 10min,以避免管道中可能残留的 VSCs的干扰.待紫外荧光二氧化硫分析仪信号平稳在基线附近,方可进行实验.
1.3 实验步骤
仪器校准:设定紫外荧光二氧化硫分析仪的标定参数,体积分数为37.0×10-6的SO2标准气体充满体积 0.39mL的定量环后,切换六通阀,流量为 580mL/min的高纯 N2气体吹扫定量环内的SO2标准气体进入分析仪(吹扫时间 30s).观察二氧化硫分析仪的信号变化,待信号回到基线附近时,停止标定.当进行样品分析时,该系统自动将样品数据与标定数据进行比较,从而确定硫含量.
水样中总挥发性有机硫的分析:将 20.00mL的水样倒入气提室,气提室的温度调节至最佳气提温度,固定最佳气提时间,从水样吹出的气体依次经过水气分离器、无机硫化物吸收管(以去除混合气中的水蒸气、无机硫的干扰)进入已经达到最佳捕集温度的捕集管.气提结束,切换三通阀,系统自动连接检测线路,微型电动牵引装置将捕集管从半导体制冷器中移出,热敏电阻器加热捕集管使其温度上升至最佳解析温度,捕集管中解析出的气体在高纯氮载气的推动下进入已达到最佳氧化温度的高温石英燃烧炉,同时引入助燃气,载气和助燃气体积比为1:1,DMS在高温和助燃气作用下定量转化成 SO2,氧化产物经过膜干燥管除水后进入紫外荧光二氧化硫分析仪,获得SO2检测峰面积.所有的气体被吹出捕集管后停止检测.
1.4 实验条件
1.4.1 最佳捕集温度、解析温度、氧化温度、Nafion膜干燥管的反吹流量 将捕集管的温度降到设定的捕集温度,DMS充满体积为 0.31mL的定量环,切换六通阀,300mL/min高纯氮载气将定量环内的DMS气体吹入捕集管内,DMS被捕集管中吸附剂捕集,吹扫时间 1min,捕集结束,捕集管的温度升至设定的解析温度,解析出的DMS经过高温燃烧,其氧化产物通过Nafion膜干燥管除水后进入紫外荧光二氧化硫分析仪,获得 SO2检测峰面积.此实验过程首先单方差分析各因素,接着进行正交实验,用以确定捕集温度、解析温度、氧化温度、Nafion膜干燥管的最佳实验条件.
1.4.2 最佳气提温度及气提时间 穿透时间是一定体积的气体随载气完全穿过30cm长捕集管的时间.在300mL/min高纯氮气的吹扫下0.08、0.16mL定量环中的DMS的穿透时间为40min,0.24、0.31、0.39mL定量环中的DMS的穿透时间为 30min,因此方法中的气提时间应≤30min.在1.4.1步骤中最佳捕集温度、解析温度、氧化温度、Nafion膜干燥管的反吹流量的条件确定下,300mL/min高纯氮载气将体积为0.31mL定量环内的 DMS气体吹入装有 20.00mL超纯水(Milli-Q)的气提室中,DMS随载气穿过气提室进入已达到最佳捕集温度的捕集管中,吹扫结束后捕集管温度升至最佳解析温度,解析出的 DMS气体随之吹入到达最佳氧化温度的高温石英燃烧炉,DMS裂解成 SO2及水蒸气,其裂解产物进入二氧化硫分析仪检测前先经过 Nafion膜干燥管(以最佳反吹流量吹扫)以除去水蒸气.此实验过程改变气提温度(25~75℃),固定气提时间20min,由DMS经过气提室的回收率的大小确定最佳气提温度.
气提温度确定后,固定最佳捕集温度、解析温度、氧化温度、Nafion膜干燥管的反吹流量,改变气提时间(5~25min)重复上述实验步骤,由DMS经过气提室回收率的大小确定最佳气提时间.
1.4.3 水蒸气及无机硫化物干扰的去除 高纯氮气鼓泡吹扫水样时,水蒸气、无机硫化物、VSCs等易挥发的物质都会随气流吹入气提室.气体依次经过填充无水CaC12的可再生水气分离器和填充片状NaOH的无机硫化物吸收管利于避免水蒸气对系统的破坏及无机硫对检测的干扰.
2 结果与讨论
2.1 捕集温度
温度为-5~5℃的捕集管均能对DMS有效捕集,温度>5℃的捕集管未能对 DMS完全捕集,造成测定峰面积降低.考虑到温度过低会造成捕集管周围结冰,给后续操作造成麻烦,选择 5℃为最佳捕集温度.
2.2 解析温度
适当的解析温度可以使 VSCs从捕集管中快速充分地解析且有较小的峰宽.大于 150℃的解析温度可以获得较理想的峰面积.为了利于VSCs从捕集管中迅速析出并且缩短进行下次实验的准备时间,选择150℃为最佳解析温度.
2.3 氧化温度
氧化温度决定了 VSCs能否完全燃烧生成SO2.燃烧炉温度<650℃时,DMS不能被氧化成SO2,分析仪无法检测到信号.950~1050℃的燃烧温度可将DMS完全氧化成SO2,为确保环境水中其他种类的挥发性有机硫化物也能被完全氧化,选择1000℃为最佳氧化温度.
2.4 Nafion膜干燥管反吹流量
标准气体经高温燃烧炉氧化后的产物在进入 SO2分析仪前需去除其中的水蒸气,以免水蒸气对的 SO2检测造成干扰和对分析仪造成损害.实验证实 Nafion膜干燥管反吹流量为 100~360mL/min时,检测出的SO2峰面积较为理想.
2.5 最佳气提时间及气提温度
在最佳捕集温度5℃、最佳解析温度150℃、最佳氧化温度 1000℃、Nafion膜干燥管的最佳反吹流量 100mL/min的实验条件确定下,依照1.4.2中的流程,固定气提时间20min,改变气提温度(25~75℃),检测结果如图2所示.
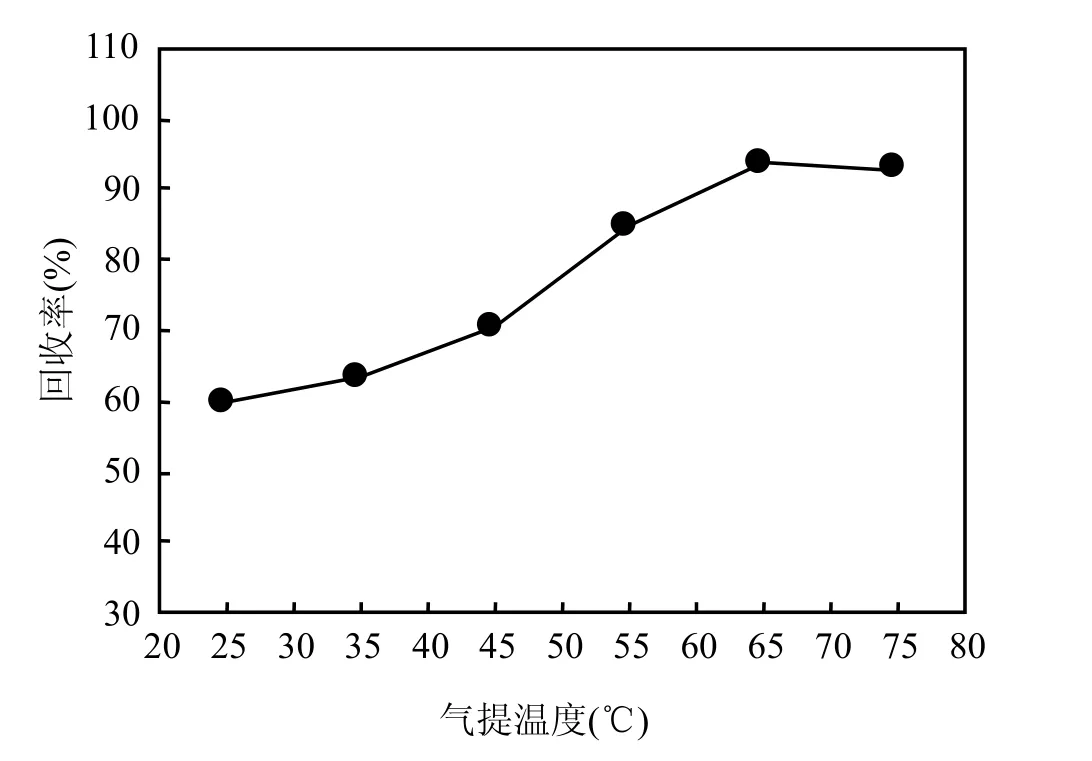
图2 气提室温度对DMS回收率的影响Fig.2 Influence of the temperature of purge room on DMS recovery
图2表明,气提时间20min,气提室温度<65℃时,DMS经过气提室的回收率为 60.1%~84.8%,温度≥65℃时 DMS标准气体经过气提室的回收率约为93.0 %,据此选择气提温度65℃.
固定气提温度 65℃,改变气提时间(5~25min),DMS标气经过气提室的回收率检测结果如图3所示.当气提时间为5~15min,高纯氮气吹扫 DMS经过气提室的回收率为 40.2%~55.7%,气提时间为 20、25min,回收率分别为93.8%、94.1%.由于气提时间>30min,待测气体会穿透捕集管,从实验效率和回收率角度考虑,选的气提时间为20min.
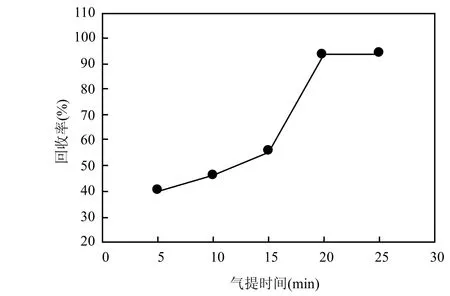
图3 气提时间对回收率的影响Fig.3 Influence of the purge time on DMS recovery
2.6 无水CaCl2除水性能及对DMS的吸附影响不同颗粒大小的干燥剂其效果也是不同的.颗粒过大,干燥效果不理想;颗粒小,干燥效果好,可是容易造成气路阻塞[6].本研究选用直径为 1~2mm颗粒状的无水 CaC12填充水气分离器.水气分离器温度为18℃,吹扫时间>10min时,DMS可完全穿透水气分离器而不会在无水 CaCl2上吸附.水气分离器温度为 35℃,吹扫时间>5min时,DMS即可完全穿透水气分离器.
2.7 无机硫化物吸收管对DMS的吸附影响
根据酸碱中和原理,填充有片状NaOH的无机硫吸收管可以吸收气提时随高纯氮吹出的无机硫化物(如SO2、H2S),并且没有副产物产生,对后续检测不造成影响.图 4表明室温下吹扫时间>3min,300mL/min高纯氮气可将DMS标准气体完全吹出无机硫吸收管而不在其上吸附.
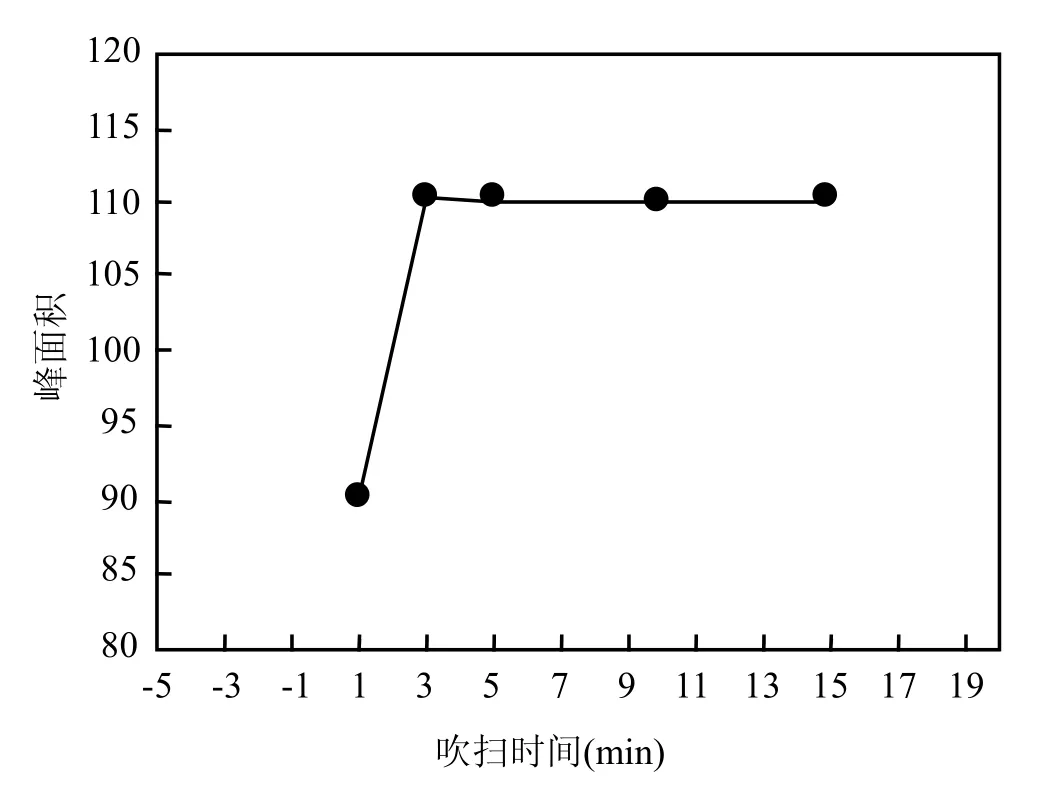
图4 室温下无机硫吸收管的吹扫时间对DMS穿透影响Fig.4 Influence of the flowing time of inorganic sulfur absorption tube at room temperature on DMS penetrating
2.8 方法的精密度及回收率
总挥发性硫化物方法的精密度(用相对标准偏差RSD表示)由体积分数为25.1×10-6的DMS标准气体在同一实验条件下进行 3次平行实验求得.定量管体积分别为 0.08, 0.16, 0.24, 0.31,0.39mL,对应的精密度分别为 5.3, 5.5, 4.5, 3.9,3.8%,其不同体积定量管与对应的峰面积的拟合方程为:y=394.53x-10.729,相关系数为 0.9817.捕集管对 DMS标准气体的回收率范围是93.9%~120.6%,证实了挥发性有机硫化物能够在5℃捕集管中有效捕集,能够在150℃的捕集管完全解析.
2.9 标准溶液工作曲线的绘制及方法的检出限
取一定量二甲基硫标样加入内含甲醇的容量瓶中,立刻旋紧瓶塞,定容、摇匀 20~30min,放置电子天平上称重,计算该储备液的准确浓度为2425ng/L,储备液封好后放在冰箱内避光保存.使用时用此储备液配制成 24~1940ng/L的标准溶液,按1.3步骤进行分析,根据不同浓度的DMS所对应的峰面积 A,在双对数坐标纸上绘制工作曲线(图5).

图5 DMS工作曲线Fig.5 Working curve for DMS
将20.00mL超纯水作为空白样品,进行5次全程空白试验,计算相对标准偏差S,由根据公式,检测限=空白值的平均值+3×空白值测定的标准偏差,其挥发性有机硫化物的检测限为 6ng/L,具有较高的灵敏度.
3 加标回收率及水中总挥发性有机硫化物的检测
取 20.00mL青岛市某池塘水样进行检测分析,检测结果中总挥发性有机硫化物的含量为1503~1911ng/L.另取相同浓度的池塘水样19.50mL,并往其中加入浓度 40.02μg/L、体积0.50mL DMS标准溶液,分别进行3次平行实验(表1),其加标回收率大于91.6%.
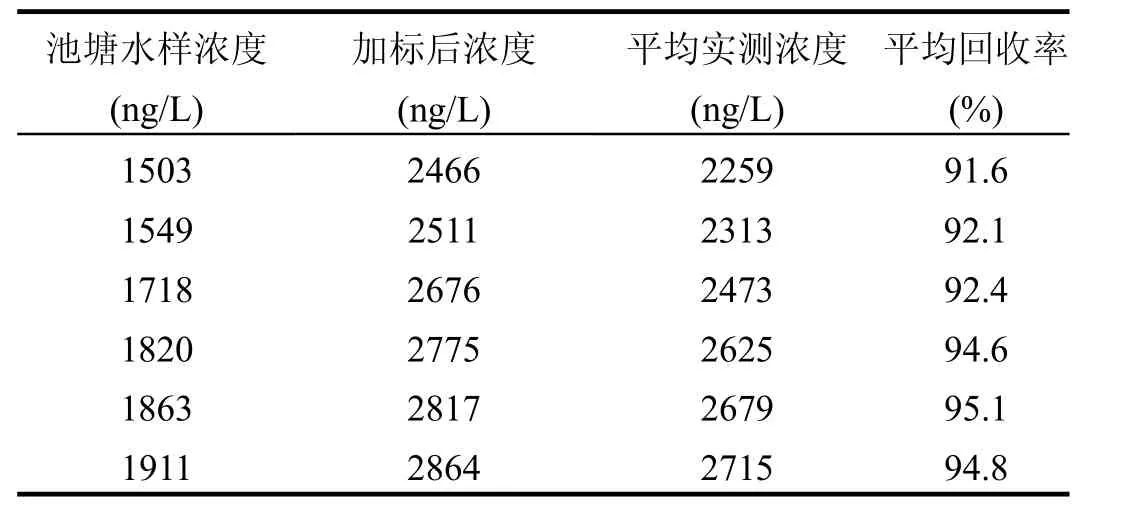
表1 池塘水水样的加标回收率Table 1 Recovery for the spiked samples
挥发性有机硫化物的不同检测方法及仪器的性能对比见表2.
表2表明,本文建立的检测方法具有较好的精密度,回收率和检测限,可以用于环境水中总挥发性有机硫化物的检测.

表2 挥发性有机硫化物检测方法的对比Table2 Comparison of detection method of VSCs
4 结论
4.1 建立了一种捕集、解析、氧化、紫外荧光检测技术,可用于水中痕量总挥发性有机硫化物的检测.
4.2 所建立方法的捕集温度 5℃,解析温度150℃,氧化温度 1000℃,气提室温度 65℃,气提时间20min,精密度5.5%,检测限6ng/L,加标回收率为 91.6%~95.1%.利用该装置对青岛市某池塘水样进行检测分析,检测结果中总挥发性有机硫化物的含量为1503~1911ng/L.
[1]聂亚峰,张晋华,张 震.挥发性有机硫化合物释放对全球环境的影响 [J]. 上海环境科学, 2000,19(10):466-468.
[2]吴 婷,易志刚,王新明.吹扫捕集-GC-MS-SIM 法测定水中挥发性硫化合物 [J]. 分析试验室, 2007,26(4):54-57.
[3]田旭东,胡 敏.中国近海大气和海水中挥发性硫化物的测定:[D]. 北京:北京大学, 2004.
[4]胡 敏,唐孝炎,李金龙,等.海水中二甲基测定方法的研究 [J].环境化学,1995,14(2):157-163.
[5]Ivey J P, Swan H B. An automated instrument for the analysis of atmospheric dimethyl sulfide and carbon disulfide [J]. Analytica Chimica Acta, 1995,306(2/3):259-266.
[6]杨桂朋,康志强,景伟文,等.海水中痕量DMS和DMSP分析方法的研究 [J]. 海洋与湖沼, 2007,38(4):93-98.
[7]Sciare J, Mihalopoulos N, Nguyen B C. Spatial and temporal variability of dissolved sulfur compounds in European estuaries[J]. Biogeochemistry, 2002,59(1/2):121-141.
[8]杨桂朋,厉丞烜.海水中二甲基硫的光化学氧化研究[J].中国海洋大学学报, 2010,40(10):79-84.
[9]王永华,焦念志.顶空气相色谱法测定海水二甲基硫和浮游植物细胞二甲基硫丙酸的研究 [J]. 海洋与湖沼, 1996,27(1):46-50.
[10]Ras M R, Borrull F, Marce R M. Determination of volatile organic sulfur compounds in the air at sewage management areas by thermal desorption and gas chromatography-mass spectrometry [J]. Talanta, 2008,74(4):562-569.
[11]Bravo-Linares C M, Mudge S M. Temporal trends and identification of the sources of volatile organic compounds in coastal seawater [J]. Journal of Environmental Monitoring,2009,11(3):628-641.
[12]Yang G P, Zhang H H, Su L P, et al. Biogenic emission of dim ethylsulfide (DMS) from the North Yellow Sea, China and its contribution to sulfate in aerosol during summer [J]. Atmospheric Environment, 2009,43(13):2196-2203.
[13]Sharma S, Lavoue D, Cachier H, et al. Long-term trends of the black carbon concentrations in the Canadian Arctic [J]. Journal of Geophysical Research, 2004, 109(15):D15203.1-15203.10.
[14]Albro T G, Dreifuss P A, Wormsbecher R F. Quantitative determination of sulfur compounds in FCC gasolines by AED: a study of the effect of catalyst type and catalytic conditions on sulfur distribution [J]. Journal of High Resolution Chromatography, 1993,16(1):13-17.
[15]Chan C Y, Chan L Y, Wang X M, et al. Volatile organic compounds in roadside microenvironments of metropolitan Hong Kong [J]. Atmospheric Environment, 2002,36(12):2039-207.
[16]Chung T Y, Chayase F, Kato H. Volatile components of ripe tomatoes and their juices, purées and pastes[J].Agricultural and Biological Chemistry ,1983,47(2):343-351.
[17]Eschenbruch R, DE Mora S J, Knowles S J, et al. The formation of volatile sulphur compounds in unclarified grap juice [J]. Vits,1986,25(1):53-57.
[18]Richards S R, Rudd J W M, Kelly C A. Organic volatile sulfur in lakes ranging in sulfate and dissolved salt concentration over five orders of magnitude [J]. Limnology and Oceanography, 1994,39(3):562-572.
[19]Sullivan J J, Quimby B D. Characterization of a computerized photodiode array spectrometer for gas chromatography-atomic emission spectrometry [J]. Analytical Chemistry, 1990,62(10):1034-1043.
[20]Wardencki W. Problems with the determination of environmental sulphur compounds by gas chromatography [J]. Journal of Chromatography A, 1988,793(1):1-19.
