CTB-Aβ42融合蛋白的原核表达条件优化及鉴定
2012-01-07程晶晶潘斯科钟云平张涵铭
程晶晶,潘斯科,钟云平,张涵铭,王 驰,余 帅,于 威,李 司
(浙江理工大学生命科学学院生物化学研究所,浙江省家蚕生物反应器和生物医药重点实验室,浙江 杭州310018)
阿尔茨海默病(Alzheimer disease,AD)最显著的神经病理学特征是老年斑。老年斑主要由β淀粉样蛋白(Aβ)42的聚集而形成。若能有效抑制Aβ42寡聚体的生成或者加速它的清除,则能有效治疗AD症状,改善认知功能。采用主动的Aβ免疫疗法,即通过抗Aβ的抗体降低脑组织内Aβ肽的水平,是AD预防和治疗的有效策略[1-3]。CTB(霍乱毒素B亚单位)是一种良好的免疫佐剂和输送抗原载体,将其与目的抗原偶联成融合蛋白后可增强其佐剂和载体作用 。
本研究将 CTB-Aβ42融合蛋白在大肠杆菌pGEX-4T-1表达系统中表达,探索得可溶性表达和胞内表达的最适条件,纯化得融合蛋白,为Aβ疫苗的研制奠定基础。
1 材料
原核表达载体pGEX-4T-1、大肠杆菌(Escherichia Coli)表达菌株BL21由浙江理工大学生化所保存;兔抗CTB抗体购自Sigma公司;过氧化物酶标记山羊抗兔IgG购自北京鼎国公司;异丙基-β-D-硫代半乳糖苷(IPTG)、还原型谷胱甘肽(GSH)、Glutathione Sepharose 4B亲和色谱柱,Aersham公司;聚偏氟乙烯膜(PVDF),Millipore公司;其他试剂均为国产分析纯。
1600凝胶成像系统,Tanon公司;EPS601二维电泳仪,Amersham公司;SCIENTZ-ⅡD超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Neofuge 13R台式高速冷冻离心机,Heal Force公司;himac CR 21G大型高速冷冻离心机,HITACHI公司。
2 方法
2.1 诱导表达条件的优化及表达产物的SDSPAGE分析
将构建好的表达菌株37℃培养4 h,新鲜菌按1∶100 接种,不同温度(25,30,37,42 ℃)条件下培养,分别加入不同浓度的 IPTG(0.1,0.2,0.5,1.0 mmol/L),并诱导不同时间(1,2,3,4,5,6 h),12 000 r/min离心15 min,收集菌体,每20 mL原始菌液以磷酸盐缓冲液(PBS)1 mL重悬,冰上超声裂解,超声条件:超声5 s,停5 s。12 000 r/min离心20 min,分别收集上清和沉淀,通过SDS-PAGE[7]检测目的基因的表达情况。12%分离胶和5%浓缩胶,电泳结束后进行考马斯亮蓝R-250染色,并用凝胶成像系统成像扫描分析。
2.2 融合蛋白的纯化和复性
2.2.1 融合蛋白的洗涤 菌液6 000 r/min离心15 min,收集沉淀,去离子水洗涤,重悬后,6 000 r/min离心15 min;取沉淀称重,每1 g湿菌用裂解缓冲液(100 mmol/L NaCl,8 mmol/L EDTA,50 mmol/L Tris,pH 8.0)9 mL重悬,室温下摇床30 min;超声裂解15 min,超声条件:超5 s,停5 s。12 000 r/min 离心15 min,所得沉淀重悬于9倍体积包涵体洗涤液Ⅰ(5 mmol/L EDTA,1%Triton-X-100,20 mmol/L Tris,pH 8.0),室温放置 10 min,12 000 r/min 离心10 min,洗涤3次,再用包涵体洗涤液Ⅱ(5 mmol/L EDTA,4 mol/L 尿素,20 mmol/L Tris,pH 8.0)洗涤3次,收集沉淀。
2.2.2 融合蛋白的溶解 洗涤后的沉淀每1 L原始菌液加入溶解液(8 mol/L尿素,5 mmol/L EDTA,100 mmol/L β-巯基乙醇;20 mmol/L Tris,pH 8.0)30 mL,室温搅拌30 min至液体澄清;12 000 r/min离心10 min,收集上清。
2.2.3 融合蛋白的超滤复性 超滤管装适量上清,6 000 r/min离心7 min,加PBS重悬,收集样品。
2.2.4 融合蛋白的分离纯化 将收集的上清上样,经pH 7.3 PBS预平衡的Glutathione Sepharose 4B亲和色谱柱,流速1 mL/min,收集洗脱液500 μL,重复3次。用5倍柱体积的pH 7.3 PBS充分洗涤后,用50 mmol/mL Tris-HCl缓冲液(pH 8.0,含10 mmol/L GSH)20 mL洗脱柱上结合的GST-CTB-Aβ42融合蛋白,并收集洗脱液500 μL,重复2次,SDS-PAGE凝胶电泳检测。
2.3 表达产物的Western blot鉴定
样品经SDS-PAGE电泳后,通过干法电转移至PVDF膜上,放入TBS中轻轻摇动洗膜10 min;去除TBS,加封闭液(含3%BSA的PBS溶液),37℃轻摇2 h;再用含兔抗CTB抗体(1∶2 000稀释)37℃ 1.5 h;TBST洗膜3次,每次5 min,加入山羊抗兔 IgG(用TBST以1∶1 000稀释),室温下缓摇1 h后,先TBST洗膜3次,每次10 min,再TBS洗膜2次,每次5 min;将膜转入DAB显色液中,室温暗处显色5 min,待有明显条带出现时用去离子水漂洗终止反应。
3 结果
3.1 诱导表达条件的优化及表达产物的SDSPAGE分析
可溶性表达的最适诱导表达条件为30℃,0.1 mmol/L IPTG,诱导2 h。30℃诱导的上清中融合蛋白表达量明显高于25和37℃中的蛋白表达量(图1)。30℃时在各IPTG浓度下诱导表达,0.1 mmol/L时融合蛋白的表达量最高(图2)。30℃,以0.1 mmol/L诱导,诱导时间为2 h时,表达量最高(图3)。
胞内表达的最适诱导表达条件为37℃,0.1 mmol/L IPTG,诱导4 h。37℃条件下融合蛋白以包涵体形式胞内表达量较25和42℃时多60%(图4)。37℃时在各IPTG浓度下诱导表达,0.1 mmol/L时融合蛋白的表达量最高(图5)。37℃,以0.1 mmol/L诱导,诱导时间为4 h时,表达量最高(图6)。
3.2 融合蛋白的纯化和复性
3.2.1 上清中融合蛋白的纯化 洗脱的主要蛋白条带分子质量约为45 kD,与GST-CTB-Aβ42融合蛋白的预测分子质量一致(图7)。

图1 不同诱导温度对GST-CTB-Aβ42融合蛋白在上清表达的影响Fig.1 Effects of different induction temperatures on soluble expression of GST-CTB-Aβ42

图2 不同IPTG浓度对GST-CTB-Aβ42融合蛋白在上清表达的影响Fig.2 Effects of different IPTG concentrations on soluble expression of GST-CTB-Aβ42

图3 不同诱导时间对GST-CTB-Aβ42融合蛋白在上清表达的影响Fig.3 Effects of different induction durations on soluble expression of GST-CTB-Aβ42

图4 不同诱导温度对GST-CTB-Aβ42融合蛋白胞内表达的影响Fig.4 Effects of different induction temperatures on intracellular expression of GST-CTB-Aβ42
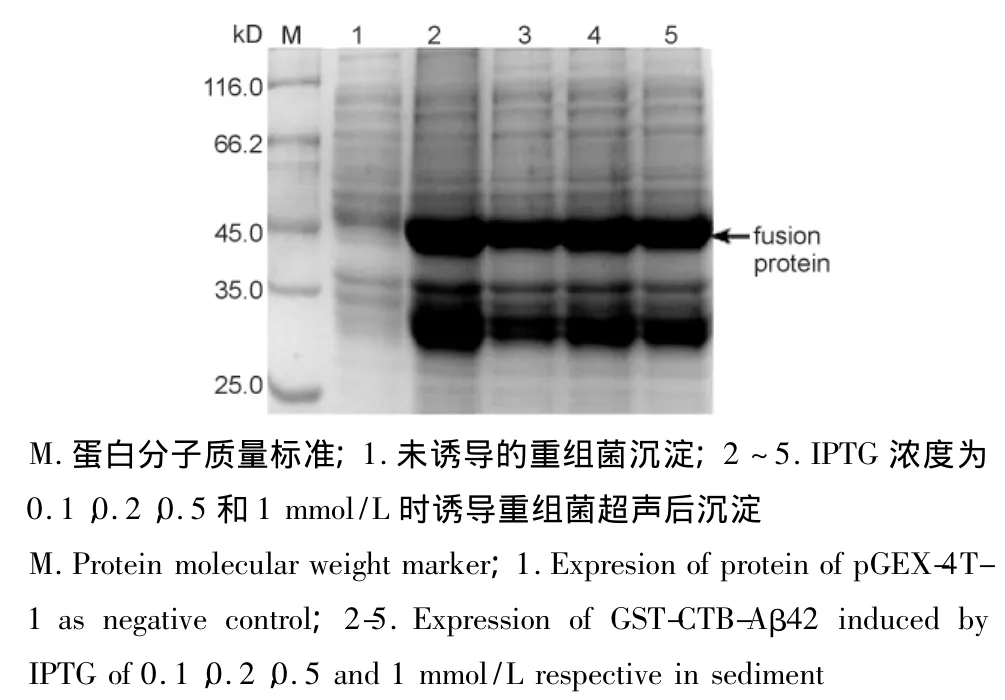
图5 不同IPTG浓度对GST-CTB-Aβ42融合蛋白胞内表达的影响Fig.5 Effects of different IPTG concentrations on intracellular expression of GST-CTB-Aβ42

图6 不同诱导时间对GST-CTB-Aβ42融合蛋白胞内表达的影响Fig.6 Effects of different induction durations on intracellular expression of GST-CTB-Aβ42

图7 SDS-PAGE分析上清中的融合蛋白的纯化Fig.7 SDS-PAGE analysis of purification of fusion protein in soluble expression
3.2.2 包涵体的纯化和超滤复性 粗制包涵体和精制包涵体蛋白的条带分子质量约为45 kD,与预期一致(图8)。
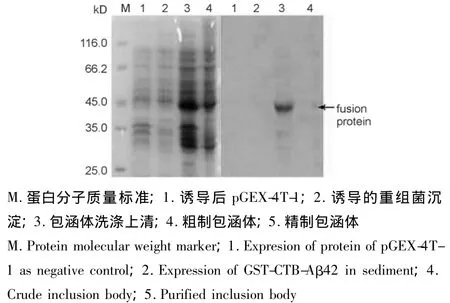
图8 SDS-PAGE分析包涵体融合蛋白的纯化Fig.8 SDS-PAGE analysis of purification of fusion protein in intracellular expression
3.3 表达产物的Western blot鉴定
将纯化所得融合蛋白进行Western blot鉴定,蛋白条带分子质量约为45 kD,与抗CTB抗体发生特异性反应(图9)。
4 讨论
外源基因在大肠杆菌中的表达受到很多因素的影响,如载体与宿主菌、诱导温度、诱导时机和诱导剂用量,培养基成分等[8]。而且大肠杆菌中缺乏真核生物翻译后修饰蛋白所需的酶类和辅助因子,如折叠酶或分子伴侣等,致使中间产物大量聚集,从而形成包涵体[9]。

图9 GST-CTB-Aβ42融合蛋白的Western blot分析Fig.9 Western blot analysis of GST-CTB-Aβ42 fusion protein
诱导温度是融合蛋白表达的重要因素,最适合大肠杆菌生长的温度为37~42℃,在此温度下表达外源蛋白极易生产包涵体,低温培养条件下表达外源蛋白能有效地增加可溶蛋白的比例[10]。本实验中,37℃诱导,分泌表达少,但表达总量很多;降低温度至25℃诱导,表达总量少,但分泌表达所占比例最高;选取30℃诱导,对优化蛋白表达体系有重要作用。
IPTG是β-半乳糖苷酶的活性诱导物质,它诱导条件简单,效率高,并且不被大肠杆菌所代谢,是一种有效的乳糖操纵子的诱导剂,可与阻遏物结合促进基因的表达。本实验中,探索可溶性表达最佳条件时发现,以0.1 mmol/L IPTG诱导与1.0 mmol/L IPTG诱导效果相似,由于IPTG本身有毒性,价格昂贵,因此选取0.1 mmol/L IPTG进行诱导。
本实验表明,在30℃,0.1 mmol/L IPTG诱导4 h,蛋白的可溶性表达量最高;在37℃,0.1 mmol/L IPTG诱导4 h,蛋白的总表达量最高,但由于融合蛋白本身易聚集形成包涵体,可溶性表达的蛋白比例不高。
由于包涵体中的融合蛋白与部分破碎的细胞膜、膜蛋白及脂体粘连在一起,所以在溶解包涵体之前要先洗涤包涵体,通常用低浓度的变性剂如2 mmol/L尿素在 50 mmol/L Tris(pH 7.0~8.5),1 mol/L EDTA中洗涤[11]。通过洗涤包涵体沉淀得到粗制的融合蛋白,高浓度的变性剂能使包涵体溶解,如6 mol/L的盐酸胍或8 mol/L的尿素,通过离子间的相互作用,破坏包涵体蛋白间的氢键而使大部分包涵体蛋白溶解。为获得有生物活性的蛋白,需将溶解后的蛋白进行复性,传统的复性方法有稀释、透析和超滤复性[12]。超滤复性是选择合适载留分子质量的膜,允许变性剂通过膜而蛋白质通不过,达到除去高浓度尿素的效果。本实验用8 mol/L尿素处理包涵体,超滤后用GST柱进行纯化,得到了GST-CTB-Aβ42融合蛋白。这为Aβ疫苗的研究提供了充分的实验条件,有利于Aβ的主动免疫治疗的深入研究和探索,也为具有更强免疫原性的Aβ疫苗的制备工艺提供了一种新思路。
[1] Schenk D,Barbour R,Dunn W,et al.Immunization with amyloidbeta attenuates Alzheimer-disease-like pathology in the PDAPP mouse[J].Nature,1999,400:173-177.
[2] Janus C,Pearon J,McLaurin J,et al.A beta peptide immunization reduces behavioural impairment and plaques in a model of Alzheimer's disease[J].Nature,2000,408:979-982.
[3] Hardy J,Selkoe D J,The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J].Science,2002,297:353-356.
[4] Holmgren J,Lycke N,Czerkinsky C.Cholera toxin and cholera B subunit as oral-mucosal adjuvant and antigen vector systems[J].Vaccine,1993(12):1179-1184.
[5] Arakawa T,Yu J,Chong D K,et al.A plant-based cholera toxin B subunit-insulin fusion protein protects against the development of autoimmune diabetes[J].Nat Biotechnol,1998,16:934-938.
[6] Yu J,Langridge W H.A plant-based multicomponent vaccine protects mice from enteric diseases[J].Nat Biotechnol,2001,19:548-552.
[7] J萨姆布鲁斯,D W拉塞尔.分子克隆实验指南[M].北京:科学出版社,2002.
[8] 朱红裕,李 强.外源蛋白在大肠杆菌中的可溶性表达策略[J].过程工程学报,2006,6(1):150-153.
[9] 龙英娜,刘焕奇,王明志.重组包涵体的纯化与复性[J].兽医临床,2008(4):70-71.
[10]严小芳,张 佩,董 硕.霍乱毒素无毒B亚单位(CTB)黏膜免疫佐剂的研究进展[J].生命科学,2009,21(1):53-55.
[11]夏启玉,肖苏生,邓柳红,等.包涵体蛋白的复性研究进展[J].安徽农业科学,2008,36(14):5801-5803.
[12] Clark E D B.Refolding of recombinant proteins[J].Curt Opin Biotechnol,1998,9(2):157-163.
