亚低温对大鼠颅脑损伤后不同时段线粒体DNA缺失和酶活性变化的影响*
2012-01-06何建国邓扬嘉唐文渊钱冠华丁嵩涛彭惠民
何建国,邓扬嘉,唐文渊,钱冠华,丁嵩涛,彭惠民△
(1.重庆市红十字会医院 400020;2.重庆市第一人民医院ICU 400011;3.重庆医科大学附属第一医院神经外科 400016;4.重庆医科大学细胞生物学与遗传学教研室 400016;5.重庆医科大学基础医学实验教学中心 400016)
颅脑损伤后出现继发性缺血、缺氧、细胞因子释放等一系列病理过程,神经元能量衰竭,同时伴有细胞内各种生化变化。线粒体是细胞质中(细胞损伤)惟一含有DNA的细胞器,当处于缺血缺氧性颅脑损伤状态时,线粒体DNA (mitochondrial DNA,mtDNA)易发生突变,因而线粒体是颅脑损伤的亚细胞目标。目前,亚低温已较为广泛的应用于临床,被证实起到了一定的脑保护作用,但其具体机制尚不清楚。本研究在亚低温治疗重型颅脑损伤动物模型上,探讨亚低温对颅脑损伤后不同时段神经细胞mtDNA缺失及缺失DNA所编码的酶活性变化的影响,探讨最佳治疗时机。
1 材料与方法
1.1重型颅脑损伤及亚低温治疗重型颅脑损伤动物模型的建立 重型颅脑损伤及亚低温治疗重型颅脑损伤动物模型的建立参照参考文献[1]。
1.2实验动物分组 普通型SD大鼠225只,雌雄不限,体质量300~350 g,由重庆医科大学实验动物中心提供。随机分为正常组,损伤后6、12、24、48、72、96、120 h组,降温6、12、24、48、72、96、120 h组,共15组,每组15只。
1.3脑细胞线粒体的制备[2]在无酶条件下称取大鼠脑组织100 mg在匀浆介质IM1(0.25 mmol/L蔗糖,1 mmol/L EDTANa2,50 mmol/L Tris-HCl,pH=7.5)中匀浆,将匀浆以1 000×g,4 ℃离心10 min,取上清液以15 000×g,4 ℃离心15 min,沉淀即为线粒体,移入IM2中―30 ℃保存。提取的线粒体送电镜检查,证实为线粒体,其内包含少许膜小体,见图1。
1.4PCR检测mtDNA的缺失 引物序列按照大鼠mtDNA全序列设计[3],并由上海生工生物工程技术服务有限公司合成。(1)下列引物位于mtDNA的无缺失区,扩增产物657 bp,引物1:L15758-15777,5′-ACA GGC ATC TGG TTC TTA CT -3′;引物2:H117-98,5′-CAT GTC TAA TCT TAC CTC CA-3′。(2)下列引物横跨mtDNA常见的缺失区,5 430 bp扩增产物为正常mtDNA,409 bp扩增产物为缺失型mtDNA,引物3:L7687-7709,5′-GCT TAG AGC GTT AAC CTT TTA AG-3′;引物4:H13117-13099,5′-AAG CCT GCT AGG ATG CTT C-3′。提取大鼠脑细胞mtDNA,按杭州维特洁生化技术有限公司提供的血细胞/培养细胞基因组DNA制备试剂盒的说明操作。扩增后均能见到409 bp及5 430 bp两条带,但为了去除5 430 bp带对409 bp带的影响,以TaqⅠ酶切模板mtDNA,酶切位点位于TCGA(5′-T/ CGA-3′)。以经过上述酶切过程的模板mtDNA加入相同的扩增缺失mtDNA的反应体系中,反应条件同前,扩增409 bp产物。确认并分析PCR扩增产物。将琼脂糖凝胶电泳结果用Microtec ScanMaker E6系统扫描,输入Image Master VDS Software 2.0图像采集及分析系统软件包进行分析,测定代表mtDNA缺失的条带(409 bp处的扩增产物)和与之同一时段代表线粒体总DNA条带(657 bp处的扩增产物)的绝对积分光密度(OD)值,结果以409 bp处的扩增产物的绝对积分OD值用与之配对的657 bp处的扩增产物绝对积分OD值的比值表示。将酶切后经PCR扩增的409 bp带处的琼脂糖凝胶切割、纯化、回收。
1.5神经细胞线粒体Na+-K+-ATP酶、细胞色素氧化酶活性 Na+-K+-ATP酶测试盒(南京建成生物工程研究所)测定大鼠脑神经细胞线粒体Na+-K+-ATP酶活性。细胞色素C氧化酶活性测定试剂盒(Sigma公司)测定大鼠脑神经细胞线粒体细胞色素氧化酶活性。操作方法参照试剂盒说明书进行。

2 结 果
2.1各组大鼠不同时间段脑神经细胞mtDNA的缺失 损伤及降温各组的缺失/总mtDNA的比值较正常组均明显升高(P<0.05)。损伤6、12、24、48 h组及降温6、12、24、48 h组的缺失/总mtDNA的比值均呈逐渐上升趋势,但降温6、12、24、48 h组的该比值低于相应时间的损伤组(P<0.05);72 h后该比值到达一平台期,且降温72、96、120 h组与相应时间的损伤组比较,差异无统计学意义(P>0.05)。见表1,图2。
2.2各组大鼠脑神经细胞线粒体细胞色素氧化酶活性的比较 损伤及降温各组细胞色素氧化酶活性较正常组均明显下降(P<0.05)。损伤6、12、24、48 h组及降温6、12、24、48 h组的细胞色素氧化酶活性均呈逐渐下降趋势,但降温6、12、24、48 h组该酶活性高于相应时间的损伤组(P<0.05)。损伤72、96、120 h组及降温72、96、120 h组呈逐渐恢复回升趋势,但相同时间的损伤组和降温组该酶活性比较,差异无统计学意义(P>0.05)。见表1。
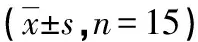
表1 各组大鼠脑神经细胞缺失/总mtDNA的比值、线粒体细胞色素氧化酶、Na+-K+-ATP酶的活性
☆:P<0.05,与正常组比较;△:P<0.05,与相同时间的损伤组比较。
2.3各组大鼠脑神经细胞线粒体Na+-K+-ATP酶活性的比较 损伤及降温各组Na+-K+-ATP酶活性较正常组均明显下降(P<0.05)。损伤6、12、24、48 h组及降温6、12、24、48 h组的Na+-K+-ATP酶活性均呈逐渐下降趋势,但降温6、12、24、48 h组该酶活性高于相应时间的损伤组(P<0.05)。损伤72、96、120 h组及降温72、96、120 h组中该酶活性呈一平台期,但相同时间的损伤组和降温组该酶活性比较,差异无统计学意义(P>0.05)。见表1。

图1 大鼠脑组织中提取的线粒体,内有少量

A:正常mtDNA;B:缺失mtDNA;M:Marker。
图2降温各组酶切后的正常和缺失mtDNA琼脂糖电泳图
3 讨 论
线粒体是调控细胞凋亡的关键部位,缺血缺氧性颅脑损伤造成mtDNA缺失,对细胞生化功能影响非常大。而mtDNA的转录、翻译需要在核转录因子的调控下才能完成。在神经元发生缺血时,神经细胞核DNA的转录、翻译受到影响,因此其所编码的蛋白质和调控因子也会发生改变,进而影响了mtDNA的转录与翻译。有学者报道,在前脑缺血3.5 min后,海马CA1区神经元mtDNA的表达呈选择性和进行性降低[4]。脑组织急性缺血和缺血-再灌注均可引起mtDNA的缺失[5]。点突变和缺失突变是mtDNA突变的两种主要形式。mtDNA缺失碱基片段通常在1.3~7.6 kb,所谓“普通缺失”。此缺失在8 482位碱基至13 459位碱基之间,共缺失4 977碱基,包括编码部分ATP合酶亚单位8、ATP合酶亚单位6和细胞色素C氧化酶亚单位Ⅲ以及ND1~ND5基因[6]。大鼠mtDNA与人类mtDNA相似,也存在类似的缺失,缺失片段为4.8 kb[7]。脑组织缺血缺氧后,神经元将经过一个毒性级联反应,开始于能量障碍,mtDNA可能受到多种因素的损害。另外,在线粒体氧化磷酸化过程中,大约有1%~4%的摄入氧转化为氧自由基。氧自由基电子传递系统溢出,最易损伤mtDNA,其易损伤程度高于核DNA的16倍以上,可引起mtDNA发生片段缺失。
脑组织高度依赖有氧代谢保持离子平衡、膜稳定性、神经功能和结构完整。mtDNA缺失,将直接影响ATP酶和细胞色素C氧化酶的活性。而细胞色素C氧化酶是呼吸链的终端酶,为传递电子复合物Ⅳ,在细胞的有氧代谢和氧化磷酸化耦联中起着重要作用,是神经细胞内源性代谢的标志。
另外,NO及其衍生物抑制细胞线粒体呼吸链或竞争性地抑制细胞色素氧化酶[8-9]。而细胞色素氧化酶是神经细胞内源性代谢的标志。本实验观察到大鼠脑组织线粒体的细胞色素氧化酶活性在损伤72 h内呈下降趋势,可以推断脑组织的能量障碍已开始加重。脑组织ATP的形成主要依赖葡萄糖的有氧分解,而生物体90%分子氧的消耗过程都在细胞色素氧化酶处完成。当细胞色素氧化酶活性降低后,ATP合成将减少,使原已存在的能量匮乏更加严重,导致ATP酶活性进一步下降。
近些年来,有关亚低温在颅脑损伤中的研究很多。已有一些研究证明其具有一定的临床疗效[10-14]。本实验观察到在损伤72 h内大鼠脑组织缺失/总mtDNA的比值明显升高、组细胞色素氧化酶活性和Na+-K+-ATP酶活性明显降低。降温6、12、24、48 h组与损伤6、12、24、48 h组比较,缺失/总mtDNA的比值明显降低、细胞色素氧化酶活性和Na+-K+-ATP酶活性明显升高。而损伤72、96、120 h组与降温72、96、120 h组比较差异无统计学意义(P>0.05)。说明亚低温治疗在72 h内,能够缓解mtDNA的缺失突变,由mtDNA参与编码的细胞色素氧化酶、Na+-K+-ATP酶活性在此阶段也有所上升。但72 h之后,mtDNA的缺失已进入一平台期,亚低温治疗对其影响不大,Na+-K+-ATP酶活性也无显著变化。从而证实了,亚低温治疗在一定的时间范围内(损伤72 h内)对大鼠颅脑损伤的脑线粒体能量代谢障碍和mtDNA缺失有保护作用。
[1]何建国,唐文渊.亚低温治疗重型颅脑损伤模型的建立与评估[J].中华损伤杂志,2005,21(4):244-246.
[2]马宇洁,杨兴易,林兆奋,等.心肺复苏后大鼠脑线粒体通透性转换孔变化在细胞能量代谢障碍中的作用及机制[J].医学研究杂志,2010,39(10):37-40.
[3]Sasaki C,Kitagawa H,Zhang WR,et al.Temporal profile of cytochrome c and caspase-3 immunoreactivities and TUNEL staining after permanent middle cerebral artery occlusion in rats[J].Neurol Res,2000,22(2):223-228.
[4]Lemasters JJ.Selective mitochondrial autophagy,or mitophagy,as a targeted defense against oxidative stress,mitochondrial dysfunction,and aging[J].Rejuv Res,2005,8(1):3-5.
[5]戢翰升,汪林涛,徐峰,等.重型颅脑损伤亚低温治疗的温度、时机和时程对疗效的影响[J].中国临床神经外科杂志,2005,10(1):45-46.
[6]Calabrese V,Lodi R,Tonon C,et al.Oxidative stress,mitochondrial dysfunction and cellular stress response in Friedreich′s ataxia[J].J Neurol Sci,2005,233(1-2):145-162.
[7]黎洁,杨丽彩,周彩风,等.脑缺血预处理诱导海马CA1区神经元Bad磷酸化及其蛋白表达的变化[J].解剖学杂志,2010,33(4):484-487.
[8]Brown GC,Borutaite VO.Cytochrome C and mitochondria[J].Biochem Soc Symp,1999,66(1):17-25.
[9]Bolanos JP,Almeida A,Medina JM.Nitric oxide mediates brain mitochondrial damage during perinatal anoxia[J].Brain Res,1998,787(1):117-122.
[10]只达石,张赛,肖绪林,等.亚低温对急
性重型颅脑损伤患者治疗机理及临床疗效研究[J].中华神经外科杂志,2001,17(5):51-55.
[11]邹国英,蒋洪敏.颅脑损伤患者外周血髓过氧化物酶的变化及临床意义[J].重庆医学,2011,40(29):2915-2917.
[12]Curfman GD.Hypothermia to protect the brain[J].N Engl J Med,2002,346(8):546-556.
[13]王琴,黄慧玲,刘锐,等.亚低温对急性颅脑损伤大鼠线粒体呼吸链酶活性的影响[J].天津医药,2008,36(7):524-526.
[14]班桂玲.亚低温疗法治疗急性期脑出血108例疗效观察[J].山东医药,2009,49(18):78-79.
