APOR后处理流程1B槽中锝的走向
2012-01-04贾永芬刘占元
王 辉,魏 艳,刘 方,贾永芬,刘占元
中国原子能科学研究院 放射化学研究所,北京 102413
基于有机还原剂的先进乏燃料后处理流程(advanced purex process based on organic reagents,缩写为APOR)是一种我国自主研发创新的后处理工艺流程。该流程的显著特征是在铀钚分离工艺(1B槽)中采用小分子有机试剂作为还原剂,实现工艺的无盐化。其中比较典型的是采用二甲基羟胺(DMHAN)-甲基肼(MMH)作为还原剂[1]。在铀钚分离工艺中,锝会与多种还原剂发生复杂的氧化还原反应[2-4],是后处理工艺中较为关注的元素。Tc(Ⅶ)可以被TBP/煤油萃取,而低价态的锝基本不被萃取,因此锝与还原剂之间的氧化还原反应对锝的走向有重要影响。在硝酸介质中锝(Ⅶ)会与甲基肼发生较慢的反应,而与二甲基羟胺基本不发生反应[5],但在含铀、钚的条件下其反应情况尚不清楚,其对锝走向的影响有待研究。本工作针对该情况,拟对含铀或钚的体系中锝与无盐试剂的反应动力学进行研究,并综合串级萃取实验、台架实验结果,对锝在1B槽的走向进行解释。
1 实验部分
1.1 主要试剂及仪器
甲基肼,分析纯,航天三院生产;二甲基羟胺,纯度97.8%,自制;高锝酸铵(99Tc),分析纯,美国橡树岭实验室;硝酸钚,用阴离子交换纯化制备;硝酸铀酰,市售分析纯;三甲基吡啶,分析纯,美国Fluka公司。
LS6000型液体闪烁计数仪,美国贝克曼公司;恒温水浴槽,金坛仪器公司;漩涡混合器,其林贝尔公司。
1.2 实验方法
锝与无盐试剂反应动力学:配制Tc(Ⅶ)与还原剂的反应溶液,置于水浴槽中反应,按一定的时间间隔取样分析其中Tc(Ⅶ)浓度,通过跟踪Tc(Ⅶ)浓度变化情况来表征反应进程。将所取的样品加入到碳酸钾溶液中,然后用三甲基吡啶萃取Tc(Ⅶ)(低价锝不被萃取),取含锝的吡啶有机相进行液体闪烁法测量。
1BP中锝总浓度的分析:取一定量1BP样品,加到1 mol/L HNO3-0.1 mol/L NaNO2溶液中,放置20 min后用0.05 mol/L PMBP/二甲苯萃取分离其中的钚;向萃余水相加入重铬酸钾溶液,置于60 ℃水浴中将低价锝氧化为+7价;向其中加入碳酸钾溶液,用三甲基吡啶萃取Tc(Ⅶ),然后取样用液体闪烁法进行测量。
1BP中Tc(Ⅶ)浓度分析:取1BP样品加入到1 mL碳酸钾溶液中,用三甲基吡啶萃取Tc(Ⅶ);取出三甲基吡啶有机相,用同样浓度的碳酸钾溶液将其洗涤1次,再取样进行液体闪烁法测量。
2 结果和讨论
2.1 反应动力学实验
2.1.1Tc(Ⅶ)与甲基肼反应动力学 分别在含铀与不含铀的硝酸介质中进行了一系列Tc(Ⅶ)与甲基肼的反应动力学实验,典型的动力学曲线示于图1。魏艳等[5]研究表明,在不含铀的硝酸介质中Tc(Ⅶ)与甲基肼的反应分为诱导期、快反应期和反应终止阶段,即图1中反应曲线1所反映的情况。有铀存在时,反应历程与无铀存在时类似,但在快反应阶段Tc(Ⅶ)与甲基肼的反应速率显著提高,并且在硝酸浓度较低时反应速率更快(见图1中反应曲线2、3)。在曲线1条件下,在快速反应期w(Tc(Ⅶ))从90%下降到约10%所需时间约为8 h,而在曲线2和3条件下,即使在更低的温度下(30 ℃),所需时间仅为3 h左右(0.45 mol/L HNO3)、1.5 h(1.5 mol/L HNO3)。
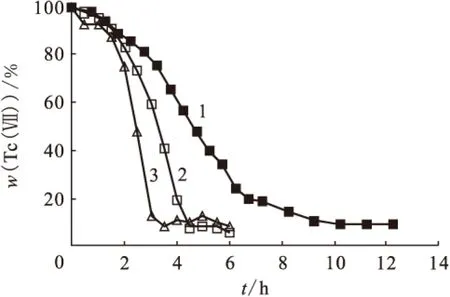
图1 硝酸介质中Tc(Ⅶ)与甲基肼反应动力学曲线
2.1.2Tc(Ⅶ)与二甲基羟胺反应动力学 分别在不含铀与含铀的硝酸介质中进行Tc(Ⅶ)与二甲基羟胺的反应动力学实验,所得动力学曲线示于图2。由图2可知,无论是否有铀存在,在20 h之内Tc(Ⅶ)质量浓度无明显的下降趋势,说明二甲基羟胺不与Tc(Ⅶ)发生显著的反应。在含钚硝酸介质中进行了Tc(Ⅶ)与二甲基羟胺的反应动力学实验,结果示于图3。由图3可知,含钚硝酸介质中Tc(Ⅶ)与二甲基羟胺基本不发生反应。由于二甲基羟胺可将钚从四价快速还原至三价,该实验结果也表明,Pu(Ⅲ)在所研究的条件下与Tc(Ⅶ)也基本不发生反应。因此在1B工艺中,Tc(Ⅶ)被还原至低价态主要是甲基肼所导致。
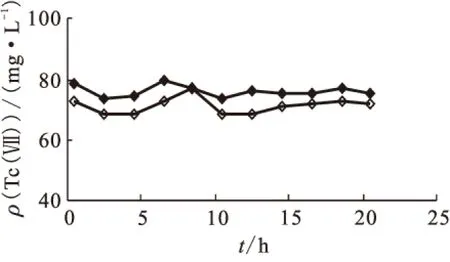
图2 硝酸介质中Tc(Ⅶ)与二甲基羟胺反应动力学曲线
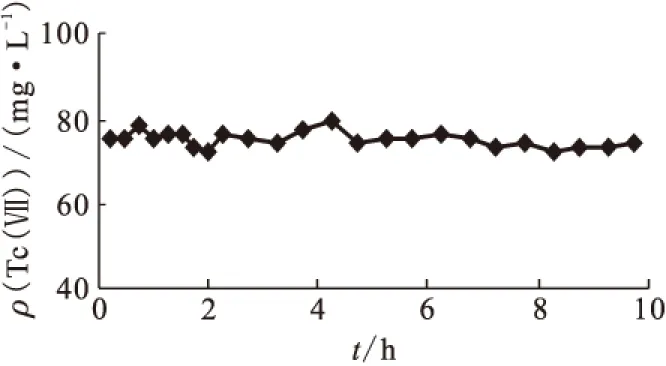
图3 含钚硝酸介质中Tc(Ⅶ)与二甲基羟胺反应动力学曲线
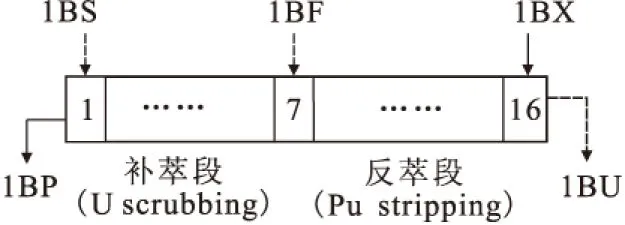
图4 1B工艺简图
2.2 1B工艺串级实验中锝的走向
按APOR流程1B工艺 (见图4)进行了多次串级实验,比较典型的锝走向情况示于图5。从1BU锝浓度看,在26排以后锝基本上达到平衡。从26排开始计算,约48%走向1BP,52%走向1BU(有机相与水相体积比为5∶1)。另外在串级实验中均观察到锝在补萃段积累的现象(见图6)。锝在串级实验中的走向及分布可由以下两个方面解释。
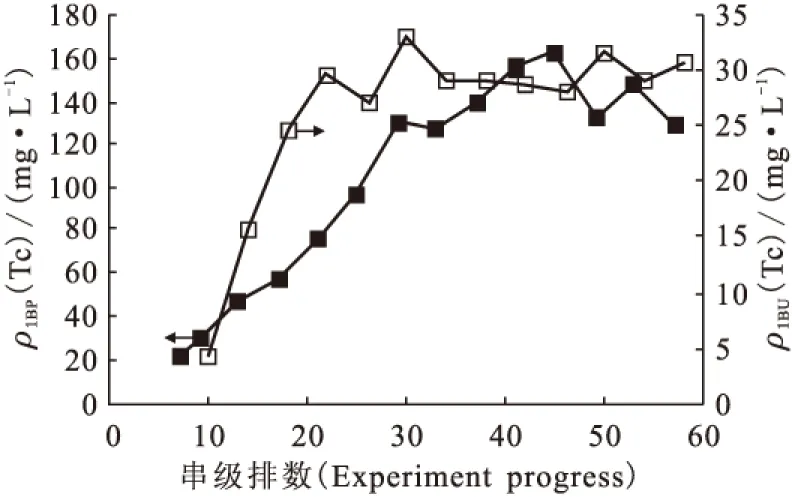
图5 1B工艺串级实验1BP、1BU锝质量浓度分析结果
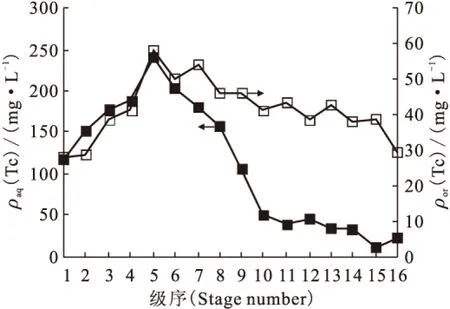
图6 1B工艺串级实验各级锝质量浓度分布
(1)在串级实验中大部分锝以可萃取的Tc(Ⅶ)价态存在。在串级萃取实验中每次分液时均将水相全部转移到上一级,这导致每次从第16级新加入的1BX与反萃下来的Tc(Ⅶ)均从诱导期开始反应。在诱导期Tc(Ⅶ)被还原的速率非常慢,1B槽水相条件下Tc(Ⅶ)与甲基肼反应诱导期在1~2 h,而1BX在串级实验中的平均停留时间约为90 min(每一排串级实验耗时5~6 min),大致处于反应诱导期,因此实际上1B工艺串级实验中大部分锝均以Tc(Ⅶ)存在。
(2)1BS的加入导致补萃段锝内循环。有机相中的Tc(Ⅶ)在反萃段被反萃至水相进入补萃段,在补萃段第1级由于1BS加入,使Tc(Ⅶ)被萃取进入有机相;在有机相向1BF加料级移动的过程中,一部分锝又被反萃进入水相,形成锝的内循环。
2.3 台架实验1B槽中锝的走向
在台架实验中分析了锝在1B槽中的走向、各级分布及价态分布。分析结果表明,1BU中锝质量浓度处于10-6g/L量级,绝大部分锝仍然走向1BP,该结果与串级实验存在较大的差异。
在连续运行的台架实验中,混合澄清槽每一级会存留一定量的水相,在水相中Tc(Ⅶ)会与甲基肼进行反应。由于不是将水相完全转移至上一级,新加入的甲基肼与Tc(Ⅶ)的反应无需重新开始反应历程。随着台架实验连续运行,当某一级中甲基肼与Tc(Ⅶ)反应跃过诱导期之后,从有机相反萃进入该级水相的Tc(Ⅶ)会立即与甲基肼进入快速反应期,使Tc(Ⅶ)在相对较短的时间内被还原为不被萃取的低价锝形态,从而使Tc(Ⅶ)在有机相与水相的分配平衡向反萃的方向移动,使更多的锝被反萃进入水相。台架实验中所使用的混合澄清槽每一级总体积为17 mL,其中水相约占二分之一(8~9 mL),1BX流速为0.79 mL/min,则1BX液流在1B槽每级中的平均停留时间约为11~12 min,在1B槽的总平均停留时间约为170 min,约为串级实验中每级平均停留时间的2倍,并且1B槽6-16级基本上处于图1所示曲线3的快反应期条件,因此与串级实验相比,可将更多的Tc(Ⅶ)还原至低价。在反萃段中,被反萃到水相的锝被快速还原至低价态,使Tc(Ⅶ)在两相的分配平衡被打破,锝被不断反萃进入水相被还原。同时由于Tc(Ⅶ)在TBP/煤油-硝酸体系中的分配比较低(1B反萃段条件下约为0.6~0.8),经过10级还原反萃,使得1BU样品中锝浓度降到很低的水平。在补萃段中,由于水相锝大部分以低价形式存在,1BS对低价锝基本不萃取,故1-7级锝浓度基本保持一致,不至于出现串级实验中明显的内循环。
1BP中Tc(Ⅶ)的含量列于表1。由表1可知,在运行达到平衡后1BP中大部分锝以低价形态存在,w(Tc(Ⅶ))已接近于图1所示反应终止阶段低价锝的w(约10%)。值得注意的是,台架实验运行18、24 h的1BP样品中,Tc(Ⅶ)的含量仍然明显高于48 h后的样品,说明此前1B槽中某些级数中仍然处于连续运行的诱导期积累过程,该过程远比Tc(Ⅶ)与甲基肼自身反应诱导期长得多。
1B槽中锝在各级的分布情况示于图7、表2。由图7可知,1B槽补萃段水相锝质量浓度波动较小(第1、2级略低,其原因可能是其上游的1A槽工艺运行状况出现较大波动所致,1AP中锝分析浓度就存在15%左右的波动),未出现显著的内循环现象。在靠近1BU出口的槽体中锝质量浓度已经降至非常低的水平,远远低于图6中相应级序的锝浓度数值。
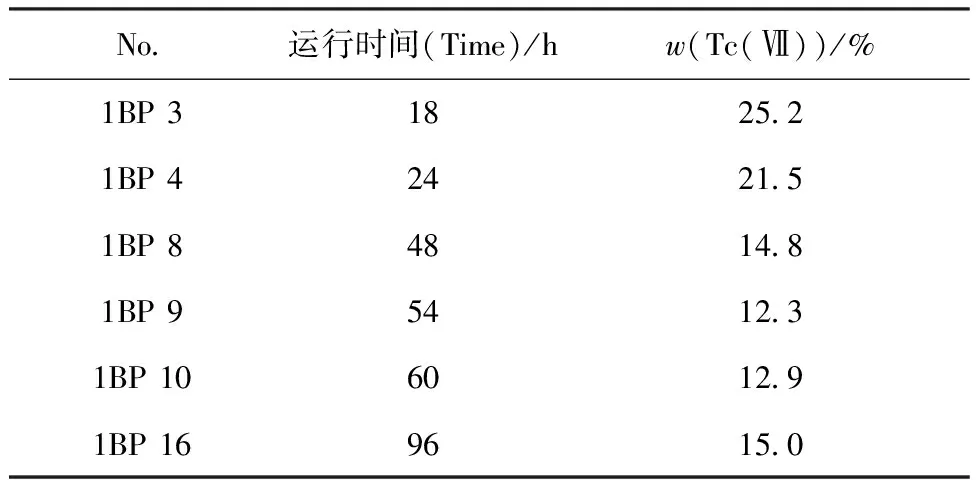
表1 混合澄清槽台架实验1BP样品中Tc(Ⅶ)的含量
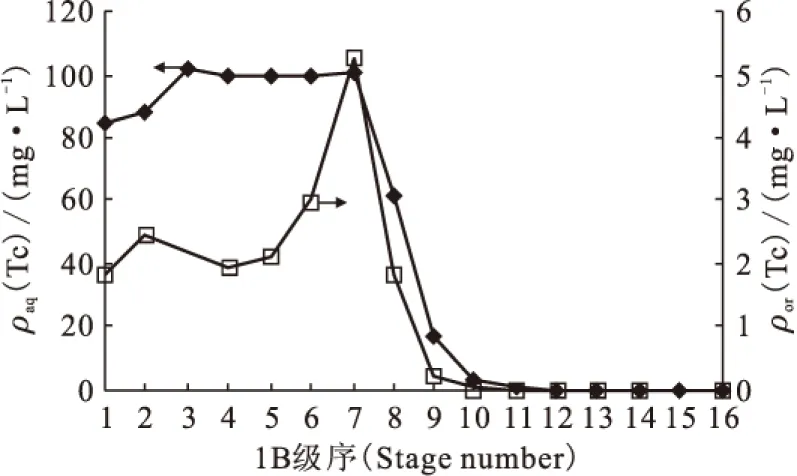
图7 台架实验1B槽锝在各级的分布
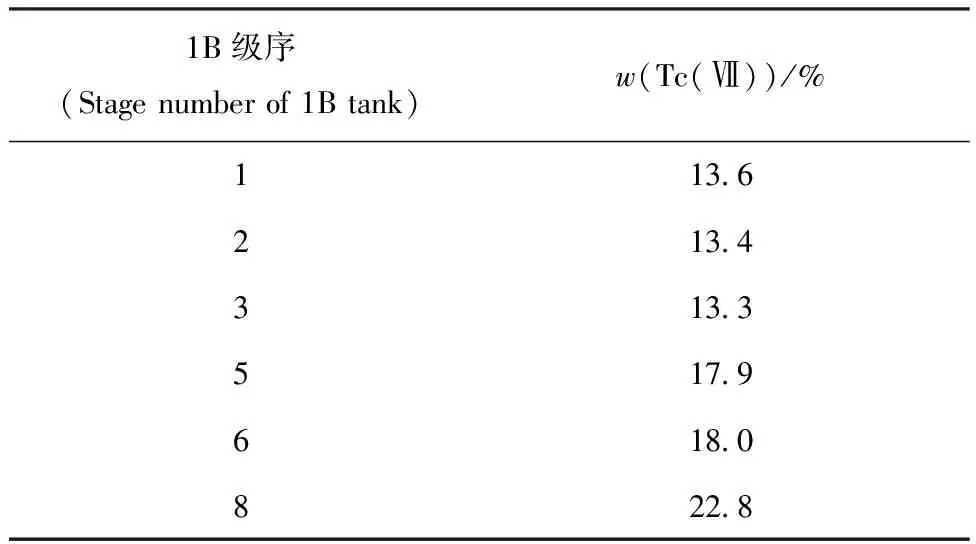
表2 1B槽1—8级水相中Tc(Ⅶ)的含量
3 结 论
本工作综合了反应动力学研究、串级实验研究以及台架实验结果对APOR流程中锝的走向原因进行了分析,并重点分析了1B串级实验与连续台架实验中锝走向的差异原因。主要结论如下:
(1)Tc(Ⅶ)基本不被二甲基羟胺还原,在所研究的条件下也基本不被Pu(Ⅲ)所还原;Tc(Ⅶ)可被甲基肼还原,该反应存在诱导期,并且铀的存在可以使其反应速率提高2~4倍,这是锝在1B槽被还原的主要因素;
(2)在1B工艺串级实验中,进入1BP、1BU的锝各占总量的50%左右,并且在补萃段存在锝的内循环,该情况主要是由于串级萃取实验方式使工艺流程中Tc(Ⅶ)与甲基肼的反应基本处于较慢的诱导期,加上较短的平均停留时间,使得工艺中大量锝仍然以可萃取的七价形态存在所导致;
(3)在台架实验1B槽中99.9%以上锝走向1BP,这是由于1B槽经过长期连续运行,各级中Tc(Ⅶ)与甲基肼的反应均已进入到快反应阶段,使被反萃进入水相的Tc(Ⅶ)与甲基肼直接进入快反应期,锝以相对较快的速率还原为不被萃取的低价态;串级实验与台架实验锝走向的差异是由锝与甲基肼反应的诱导期以及液流在工艺中停留时间的差异所导致。
[1]何辉.N,N-二甲基羟胺在铀钚分离中的应用和计算机程序的开发[D].北京:中国原子能科学研究院,1998.
[2]张丕禄,齐占顺,朱志瑄.PUREX流程中Tc(Ⅶ)对U(Ⅳ)反萃Pu(Ⅳ)的影响[J].核化学与放射化学,1999,21(2):219-227.
[3]Garraway J,Wilson P D.The Technetium-Cata-lysed Oxidation of Hydrazine by Nitric Acid[J].Less-Common Metals,1984,88: 191-196.
[4]Koltunov V S,Taylor R J,Gomovona T V.The Oxidation of Hydroxylamine by Nitrous Acid in the Presence of Technetium(Ⅶ)[J].Radiochim Acta,2000,88: 422-430.
[5]魏艳.硝酸介质中七价锝与无盐试剂的反应动力学研究[D].北京:中国原子能科学研究院,2006.
