食品添加剂过氧化氢中铅含量的测定
2011-12-29吴秀玲
吴秀玲
(东营职业学院 工业工程系,山东 东营 257091)
食品添加剂过氧化氢中铅含量的测定
吴秀玲
(东营职业学院 工业工程系,山东 东营 257091)
用PAR分光光度法测量食品添加剂过氧化氢中的铅含量。结果表明:p H值在8.0~9.0,显色剂4-(2-吡啶偶氮)-间苯二酚(PAR)与铅反应形成二元配合物,在波长530 nm处有最大吸收;铅含量在0~6.0μg/mL范围内符合朗伯比耳定律,有良好的线性关系,相关系数为0.998 7,检出限为1.0μg/mL,重现性小于3.0%,加标回收率大于92%;与双硫腙光度法对比,偏差小于±2.0%,符合分析要求。
食品添加剂;过氧化氢;4-(2-吡啶偶氮)-间苯二酚;分光光度法;铅
食品添加剂过氧化氢H2O2具有氧化性,在使用过程中不会带入新的杂质,过量部分容易分解为水和氧气,氧气从体系中逸出后不增加新物种,从而被广泛用作乳品、饮料、果汁等食品生产加工的消毒剂、杀菌剂和防腐剂等。GB 22216-2008食品添加剂过氧化氢标准规定,铅含量不大于4×10-6。测定铅含量的方法主要有原子吸收分光光度法及ICPAES法、双硫腙分光光度法[1-3]等,笔者采用PAR分光光度法测量食品添加剂过氧化氢中铅含量。
1 实 验
1.1 实验原理
应用分光光度法原理,在p H值为8.0~9.0的酸度范围内,显色剂4-(2-吡啶偶氮)-间苯二酚(PAR)与铅反应形成较稳定的二元配合物,在波长530 nm处有最大吸收,铅含量在较大范围内有良好的线性关系,该法可用于食品添加剂过氧化氢中铅含量的测定。
1.2 主要仪器
UV1801紫外可见分光光度计(北京瑞利分析有限公司);EL204电子天平(上海梅特勒-托利多仪器有限公司);p HS-3C型酸度计(上海宇隆仪器有限公司);QYQ-100耐腐蚀型连续可调移液器(北京青云卓立精密设备有限公司)。
1.3 试剂
铅离子标准储备液:称取1.598 4 g硝酸铅(AR,99%,105℃干燥2 h),用少量去离子水溶解,转移入1 000 m L容量瓶中,用去离子水(二级)稀释至刻度,此溶液Pb2+质量浓度为1 000μg/m L。
铅离子标准使用液:取铅离子标准储备液10 m L,用去离子水定容至100 m L容量瓶中,此溶液Pb2+质量浓度为100μg/m L。
4-(2-吡啶偶氮)-间苯二酚(PAR)溶液:称取0.860 8 g PAR,用0.1 mol/L氨水75 m L溶解,移入500 m L容量瓶中,定容;再移取5 m L于100 m L容量瓶中,定容,得86.08μg/m L PAR溶液。
氨-氯化铵缓冲溶液:称取40 g NH4Cl,溶于适量水,加8.8 m L浓氨水(15 mol/L),用去离子水定容至500 m L,该溶液p H值约为8.5。
1.4 测试方法
在25 mL容量瓶中,依次加入适量铅离子标准使用液或样品溶液、3.0 mL PAR溶液、3.0 mL缓冲溶液、1.0 mL溴化十六烷基三甲基铵(CTMAB)、1.0 mL 10%KCN溶液,加水定容至刻度。在另一25 mL容量瓶中,加入3.0 mL PAR溶液、2.0 mL缓冲溶液、1.0 mL溴化十六烷基三甲基铵(CTMAB)、1.0 mL 10%KCN溶液,加水定容至刻度,用作参比溶液。将以上配制好的溶液室温放置20 min,用1 cm比色皿在波长530 nm处测其吸光度。
2 实验条件
2.1 测量波长
在波长480~580 nm内对4.0μg/m L Pb2+溶液进行波谱扫描表明,Pb-PAR在530 nm处有最大吸光度,由此选定本实验的测量波长为530 nm。
2.2 显色剂用量
仅改变显色剂PAR溶液用量进行测定,绘出溶液吸光度随显色剂用量变化的曲线(图1)。结果表明,PAR溶液用量在3.0~5.0 mL溶液吸光度较大且平稳,由此选定本实验的PAR溶液用量为3.0 mL。
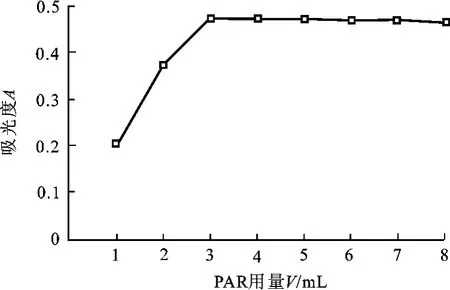
图1 溶液吸光度随显色剂用量变化曲线
2.3 显色时间及温度
仅改变显色时间或温度进行测定,绘出吸光度变化曲线。结果表明:显色时间在15~60 min,溶液吸光度较大且平稳,由此选定本实验的显色时间为20 min;显色温度为15~35℃,溶液吸光度较大且平稳,由此选定本实验的显色温度为室温。
2.4 缓冲溶液p H值
仅改变缓冲溶液p H值进行测定,绘出溶液吸光度随缓冲溶液p H值的变化曲线(图2)。结果表明,p H值在8.0~9.0溶液吸光度较大且平稳,由此选定本实验的缓冲溶液p H值为8.5。
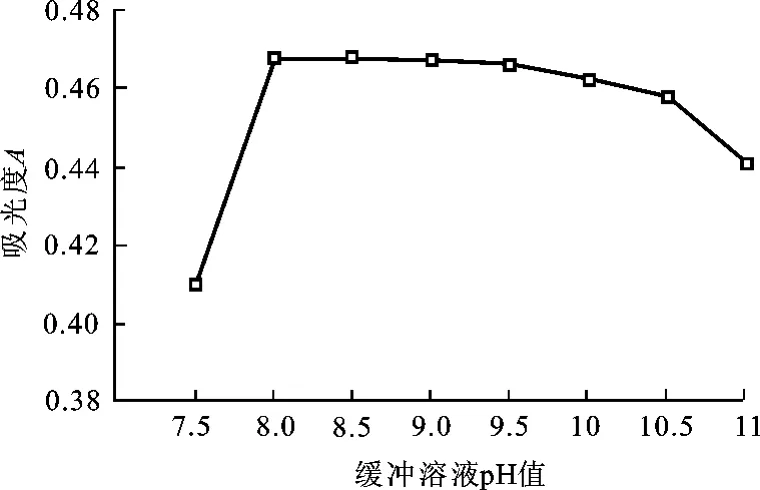
图2 溶液吸光度随缓冲溶液p H值的变化曲线
2.5 缓冲溶液用量
仅改变缓冲溶液用量进行测定,绘出溶液吸光度随缓冲溶液用量的变化曲线(图3)。结果表明,缓冲溶液用量在2.5~4.5 m L溶液吸光度较大且平稳,由此选定本实验的缓冲溶液用量为3.0 m L。
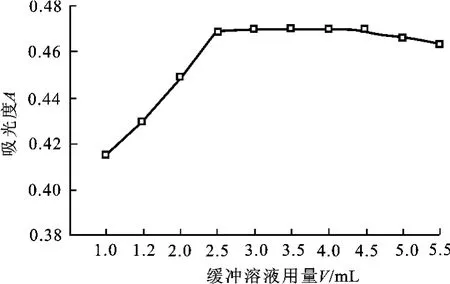
图3 溶液吸光度随缓冲溶液用量变化曲线
2.6 表面活性剂与掩蔽剂
张丽萍等[4]实验证明了加入溴化十六烷基三甲基铵(CTMAB)时,能增强显色剂在水相中溶解度,增大体系的吸光度,提高显色反应的灵敏度,本实验采用加入1.0 m L CTMAB。
在实验条件下,试样中的Cu2+、Zn2+等离子会干扰Pb2+的测定,可加入KCN来掩蔽Cu2+、Zn2+等[5]。由于KCN剧毒,使用时要保障安全,使用后的废液可加入NaOH和FeSO4溶液,使生成铁氰化钾而转化为低毒物质。本实验采用加入1.0 m L 10%KCN溶液。
3 食品添加剂过氧化氢样品分析
3.1 样品溶液制备
取3种不同乳品厂使用的食品添加剂过氧化氢样品25.00 m L于小烧杯中蒸干,用去离子水定容到25 m L容量瓶中,计作样品1、2、3。
3.2 样品加标溶液制备
将30μL的100μg/m L的铅离子标准使用液分别加入25 m L容量瓶中。
3.3 实验步骤
取15.0 m L样品溶液平行测定5次,由回归方程计算样品中铅含量。用双硫腙光度法做对比实验。再取15.0 m L样品加标溶液由回归方程计算样品加标溶液中铅含量,再求出所加标准溶液中铅含量,计算回收率。
4 实验结果分析
4.1 标准曲线
分别测量一系列铅离子标准使用溶液吸光度,绘出标准曲线, 其线性回归方程为A=0.124 6ρ-0.028 1,其中ρ为铅质量浓度,μg/m L。相关系数r=0.998 7,呈良好的线性关系,线性范围为0~6.0μg/m L。该方法检测下限为1.0μg/m L。
4.2 偏差和回收率对比
将实验样品测定结果与双硫腙光度法所测结果进行对比(表1)。样品加标溶液的铅回收率见表2。
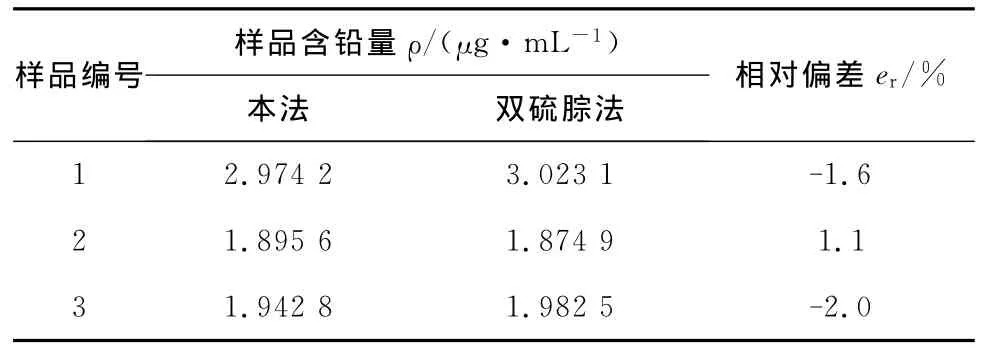
表1 过氧化氢样品分析结果

表2 铅测定回收率
从表1和表2可见,该法与双硫腙光度法测量结果的相对偏差在±2.0%,铅回收率大于92%,重现率小于3.0%,证明该法准确度较高,测定结果可靠。由实验结果可知,所测食品添加剂过氧化氢样品中铅的含量均小于国家标准,符合国家食品卫生安全要求。
5 结束语
用PAR分光光度法测定食品添加剂过氧化氢中铅的含量,可直接测定水相中铅的含量,是对GB 22216-2008食品添加剂过氧化氢标准中铅含量测定方法的补充,该法简化了测定步骤和分析成本,经用于过氧化氢样品分析,结果符合分析要求。
[1] 高荣,张长立,勾艳玲.微波消解-ICP-AES法测定茶叶中铅[J].中国卫生检验杂志,2005,15(3):330,367.
[2] 董晓芳,魏三泽,刘高年.双硫腙分光光度法测定水中铅含量[J].中国医学理论与实践,2003(2):221.
[3] 屈明华,费学谦,丁明.石墨炉原子吸收光谱法对高钙营养强化剂中痕量铅的测定[J].分析测试学报,2008(10):1132-1134.
[4] 张丽萍,李伟辉,蒋小云.茶叶中铅含量分析方法研究[J].食品研究与开发,2008,29(12):99-101.
[5] 朱翠娟,贺秀媛,石冬梅,等.饲料中铅含量的双硫腙法测定[J].饲料研究,2009(5):45-47.
TS207.51< class="emphasis_bold">[文献标识码]A[文章编号]
1673-5935(2011)03-0022-02
2011-04-28
吴秀玲(1968-),女,山东东营人,东营职业学院工业工程系副教授,硕士,主要从事化学与化工分析研究。
[责任编辑] 辛艳萍
