大豆卵磷脂中脑苷脂类物质的分离纯化研究
2011-11-14胡长鹰王丽丽刘元法王兴国
韩 雪 汪 勇 胡长鹰 王丽丽 刘元法 王兴国
(暨南大学食品科学与工程系1,广州 510632)
(江南大学食品学院2,无锡 214122)
大豆卵磷脂中脑苷脂类物质的分离纯化研究
韩 雪1汪 勇1胡长鹰1王丽丽1刘元法2王兴国2
(暨南大学食品科学与工程系1,广州 510632)
(江南大学食品学院2,无锡 214122)
脑苷脂(Cerebroside,Cer)是动植物组织内主要的鞘脂类(Sphingolipids,SL)物质,具有一定的生理活性。以大豆卵磷脂(Lecithin)为主要原料,用石油醚萃取大豆卵磷脂中的中性脂质,获得粗脑苷脂类物质。通过单因素试验和正交试验,确定了石油醚萃取分离粗脑苷脂类物质的最佳条件为料液比1∶1、提取温度50℃,提取时间30 min,在此条件下得到6.58%的粗脑苷脂。粗脑苷脂用硅胶柱层析分离纯化,采用氯仿/甲醇溶剂体系梯度洗脱。通过二次柱层析,分离得到了高纯度的脑苷脂类物质。
大豆卵磷脂 脑苷脂 神经酰胺 硅胶柱层析
脑苷脂最初是从脑组织中提取出来的,故称脑苷脂。在大豆中发现的脑苷脂主要是葡糖苷脂鞘氨醇,包含一个葡萄糖分子[1-2],它是由鞘氨醇、脂肪酸和D-半乳糖所组成,脂肪酸和鞘氨醇的氨基结合,鞘氨醇C-1上的OH基与D-半乳糖上的β-OH基结合成β-糖苷键。根据脂肪酸碳链中是否含有羟基分成非羟基脂肪酸(Nonhydroxy fatty acid,NHFA)和羟基脂肪酸(Hydroxy fatty acid,HFA)。鞘氨醇有3种结构,含有不饱和双键的鞘氨醇称为神经鞘氨醇(Sphingosine),饱和的鞘氨醇称为二氢神经鞘氨醇(Sphinganine),含有4个羟基的鞘氨醇称为植物鞘氨醇(Phytosphingosine)[3]。由于脑苷脂是由亲水性的糖和亲脂性的神经酰胺结合而成,这种结构使之成为生物膜的重要脂质组分之一[4]。据研究报道,脑苷脂具有抗肿瘤[5]、抗病毒[6]、抗溃疡[7]、免疫调节等作用[8],可望开发成为防治慢性疾病的新药。另外脑苷脂对毛发还具有保湿作用,因此还可以作为护肤和护发产品广泛应用于化妆品行业[9]。
由于脑苷脂类化合物在动植物组织中含量较少,一般质量分数为万分之二左右,因此提取纯化较为困难。Kawatake等[10]从斑砂海星中分离出6个脑苷脂组分的,并鉴定了其结构。Yamada K等[11]从虎纹海参中分离出葡糖脑苷脂,并确定其结构。以上两人都是用氯仿甲-醇提取,再用乙酸乙酯-正丁醇萃取,用冷丙酮洗涤,得到丙酮不溶物。魏静等[12]分析测定了不同提取溶剂对魔芋飞粉中神经酰胺提取效果的影响,比较了氯仿甲醇混合液和95%乙醇的提取率。由于原料昂贵,成本高,不适合用于食品、化妆品和医疗行业中鞘脂类的大规模工业化提取生产。
Wang等[13]分析了大豆种子不同生长阶段的鞘脂类含量。由于脑苷脂在农产品中的含量较低,如要获得高纯度的脑苷脂产品,需要消耗较多的原料,提取脑苷脂后的原料的综合利用直接关系到经济效益。大豆卵磷脂是大豆油加工过程中的副产品,含有0.1% ~0.5%左右的脑苷脂,是一般农产品含量的10倍以上,是制备脑苷脂的理想原料[14-15],提取脑苷脂后的卵磷脂原料可以回收利用,因此从大豆卵磷脂中提取脑苷脂类化合物具有较大工业化意义。本试验主要研究利用石油醚萃取去除大豆卵磷脂中的中性脂质,得到粗脑苷脂,粗脑苷脂再经过硅胶柱层析进行分离纯化得到高纯度的脑苷脂类物质。
1 材料和方法
1.1 试验材料与试剂
大豆卵磷脂:中粮东莞中谷油脂有限公司;柱层析硅胶(100~200目):青岛海洋化工厂分厂;硅胶板:烟台化学工业研究所;石油醚、甲醇、氯仿、无水乙醇、硫酸:均为分析纯,天津市富宇精细化工有限公司。
1.2 试验仪器
RE-52旋转蒸发器:上海嘉鹏科技有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义英峪予华仪器厂;DT5-4型高速离心机:北京时代北利离心机有限公司;JB50-D型电磁搅拌器:上海沪西分析仪器厂;DHG-9123A电热恒温鼓风干燥箱:上海恒一科技有限公司;层析柱(20 cm×40 cm):上海精科实业有限公司。
1.3 试验方法
1.3.1 粗脑苷脂的提取
粗脑苷脂的提取分为单因素和正交试验。单因素试验考察提取时间、提取温度和料液比3个因素对粗脑苷脂得率的影响。粗脑苷脂提取L9(34)正交试验安排见表1,每个试验做3次平行试验。
提取步骤如下:称取大豆卵磷脂30.0 g于250 mL的磨口三角瓶中,加入石油醚,连接直型冷凝管,在磁力搅拌下搅拌提取一定时间。提取结束后,冷却。将提取液转让离心管中,在3 000 r/min下离心10 min,倾倒出石油醚溶液,离心管下层固体为粗脑苷脂,称重,粗脑苷脂得率=粗脑苷脂质量/大豆卵磷脂质量×100%。

表1 从大豆卵磷脂中粗脑苷脂提取正交试验因素水平表
1.3.2 粗脑苷脂的预处理
离心得到的粗脑苷脂再用石油醚萃取一次除去多余的中性脂质,得到的褐色粉末状不溶物再用热乙醇萃取3次,收集3次萃取液真空浓缩蒸干,得柱分离所需的粗脑苷脂。
1.3.3 脑苷脂柱层析纯化
称取30.0 g硅胶用洗脱剂浸泡,调成糊状,匀浆湿法装柱,静置过夜,使硅胶沉降。进样前,用洗脱剂以一定流速淋洗层析柱使之达到平衡状态。称取0.50 g浓缩蒸干的脑苷脂用少量氯仿完全溶解后小心倒入硅胶柱中,以氯仿/甲醇混合液为流动相,在梯度洗脱的条件下对脑苷脂有很好的分离。柱层析流速控制在1.20 mL/min,用50 mL的小瓶收集洗脱液。在洗脱过程中用薄层层析(TLC)检测各个洗脱出的样品,用50%的硫酸显色,以确定含有脑苷脂的小瓶。收集洗脱液,蒸干溶剂计算得率和回收率。
一次柱层析得到的组分3和组分4,再上硅胶柱二次层析分离。用氯仿/甲醇(体积比)为100∶1、50∶1、100∶3、25∶1、20∶1、15∶1 和 10∶1 各 100 mL 洗脱,收集液通过TLC监测,合并主要成分相同的洗脱液,顺次得到3个主要成分。
1.3.4 薄层板(TLC)分析[16]
所得样品点样,放入层析缸中,用氯仿∶甲醇∶水(65∶25∶4)展开。当展开剂前缘距硅胶板上端1 cm处,取出硅胶板吹干,用50%的硫酸均匀喷湿层析板,然后将板放入135℃的烘箱中,10 min后取出,可见清晰的碳化斑点。
2 结果和讨论
2.1 粗脑苷脂的提取
2.1.1 提取时间
在大豆卵磷脂中,微量的脑苷脂类物质溶解在以磷脂和中性脂质为主体的体系中。由于脑苷脂类等神经鞘脂类物质极性较大,在石油醚中溶解度很低,而磷脂、三酰甘油以及脂肪酸等中性油脂可以溶解在石油醚中,因此可以采用石油醚等非极性溶剂从大豆卵磷脂中分离脑苷脂物质。向卵磷脂中添加石油醚溶剂时,溶解在卵磷脂中的脑苷脂物质由于溶解度低,而结晶析出。通过离心的方法可将结晶的脑苷脂物质分离出来。离心得到的粗脑苷脂的质量可以用来衡量提取分离的效果。
提取时间对粗脑苷脂得率的影响结果见图1。从理论上讲,提取的时间越长,粗脑苷脂的得率也越高,因为脑苷脂类物质结晶更完全。但是当提取时间超过30 min后,随着提取时间的延长,得率增加趋于平缓,当提取时间超过60 min后,得率反而降低。粗脑苷脂类物质的在非极性溶剂中结晶需要一定的时间,时间过短,结晶的物质颗粒太细,离心时不进入沉淀,得率较低。随着提取时间的延长,粗脑苷脂类物质的得率增加。但是当提取时间过长时,由于磷脂是表面活性剂,具有增溶作用,使得粗脑苷脂类物质在石油醚中的溶解度增加,降低了得率。
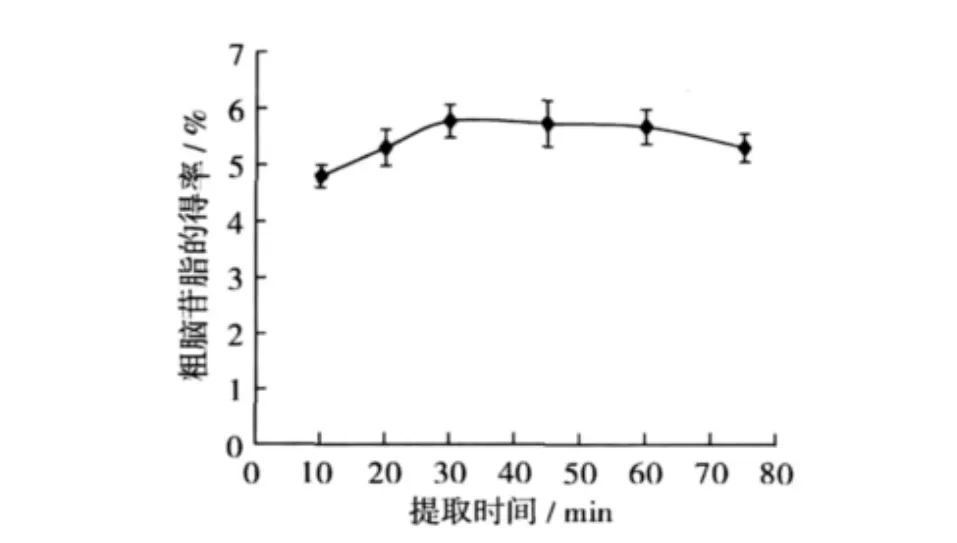
图1 提取时间对粗脑苷脂得率的影响
2.1.2 料液比
测定了不同料液比对大豆卵磷脂中脑苷脂提取效果的影响,其测定结果见图2。由图2可以看出,随着料液比的增加,脑苷脂粗提物的含量逐渐降低,料液比在1∶1时的得率与其他相比有明显的最高。当料液比增加时,也就是石油醚的比例增加。虽然脑苷脂类物质在石油醚中溶解度较低,但是增加溶剂的比例肯定会增加粗脑苷脂类物质在石油醚中的溶解量,降低了得率。
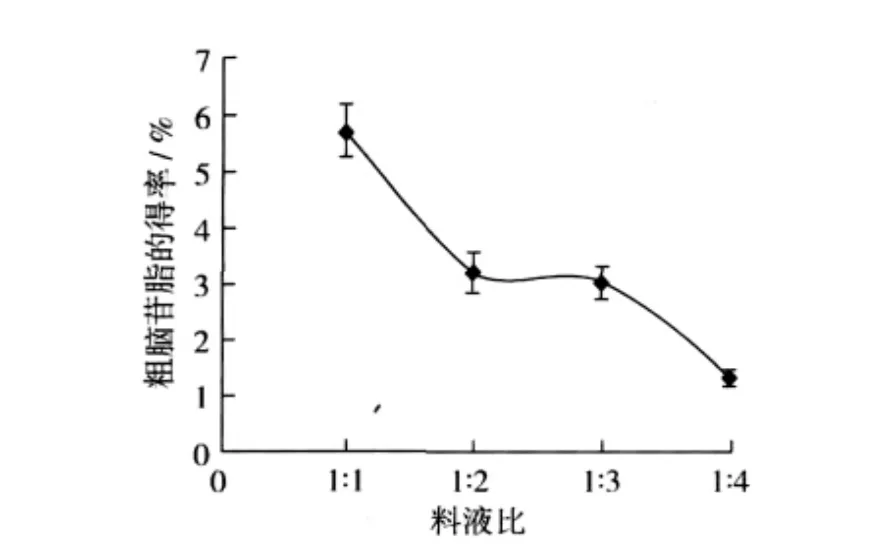
图2 料液比对粗脑苷脂得率的影响
2.1.3 提取温度
测定了不同提取温度对大豆卵磷脂中粗脑苷脂提取效果的影响,其结果见图3。由图3可以看出,脑苷脂类化合物的得率在一定温度范围内(30~45℃)得率略有升高。但是随着温度继续上升,粗脑苷脂得率反而下降。这是因为提取温度过高时,有利于提高溶剂的溶解性,使得脑苷脂类物质在石油醚中的溶解度提高,从而降低了得率。
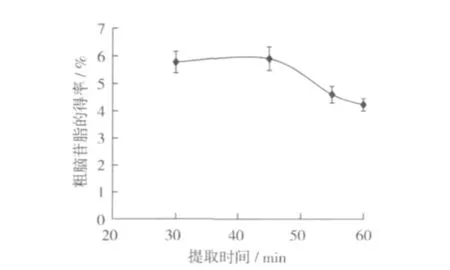
图3 提取温度对粗脑苷脂得率的影响
2.2 正交试验
根据单因素试验的结果,设计一个3因素3水平的试验如表1。确定石油醚提取脑苷脂的最佳工艺参数。以料液比,提取温度和提取时间为考察因素,以粗脑苷脂得率为指标,选用正交表L9(34)对提取工艺进行研究,所得数据用正交设计助手软件处理,正交试验结果如表2所示,方差分析如表3所示。
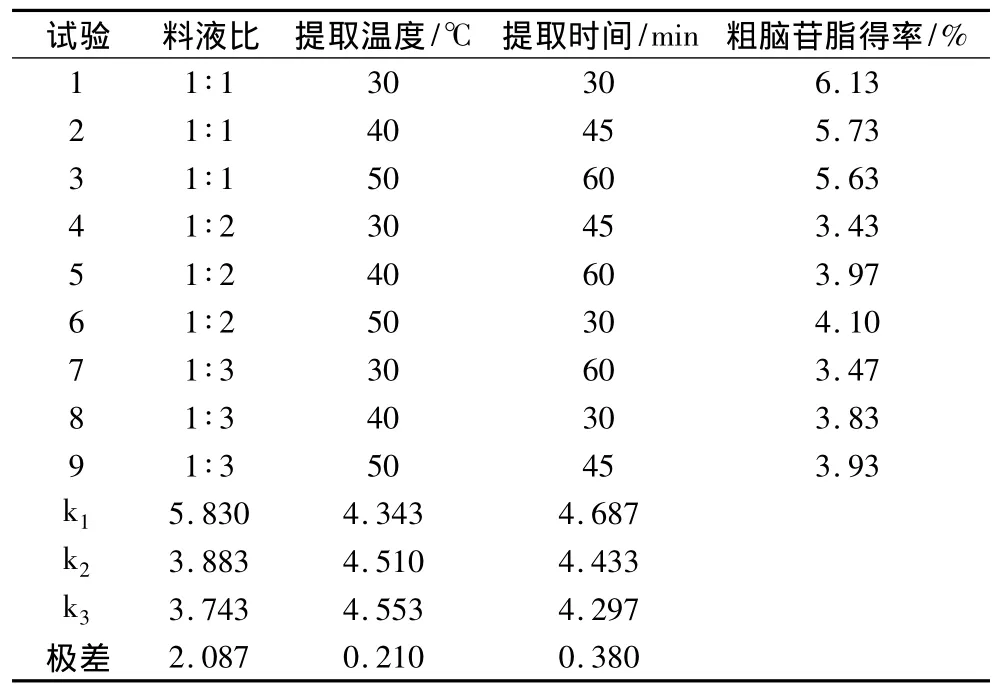
表2 从大豆卵磷脂中粗脑苷脂提取正交试验数据
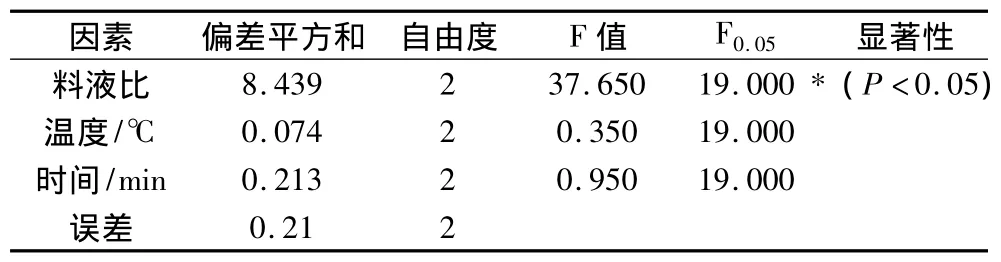
表3 方差分析表
由表3可以看出,乙醚提取脑苷脂工艺中,料液比对脑苷脂含量有显著影响,而提取温度的影响最不显著。通过正交试验可以知道石油醚提取粗脑苷脂的最优条件是料液比1∶1、提取温度50℃下提取时间30 min。在此条件下,大豆粗脑苷脂的得率为6.58%。
2.3 粗脑苷脂的预处理
粗脑苷脂预处理的目的是用石油醚进一步除去中性脂质(磷脂、甘油酯和脂肪酸),同时利用脑苷脂等极性脂质溶解于热乙醇的特性,而一些大极性的低聚糖不溶于乙醇等特性,用乙醇进一步富集粗脑苷脂。石油醚结晶获得的粗脑苷脂的得率为6.58%,再次用石油醚萃取后得率为0.99%(以大豆卵磷脂重量计算)。说明最佳条件下石油醚结晶,虽然得率很高,但是其主要成分还是中性脂质,第2次石油醚萃取可以较好的去除这些中性脂质。脱脂的粗脑苷脂通过热乙醇溶解富集,得到的上层析柱的脑苷脂得率为0.25%(以大豆卵磷脂重量计算)。由于大豆卵磷脂为国产原料,含有较多的乙醚不溶物(机械杂质),热乙醇萃取的目的是去除脑苷脂类物质中的机械杂质,以便于进一步分离纯化。
2.4 硅胶柱层析法纯化粗脑苷脂
称取预处理后的脑苷脂0.50 g用少量氯仿溶解后缓慢倒入层析柱内,用不同极性洗脱剂洗脱。因为粗脑苷脂是从含中性脂35%左右的大豆卵磷脂中提取的,粗脑苷脂中含有较多的甾醇类、甘油酯等极性较低的中性脂。先用中低极性的溶剂正己烷和氯仿各500 mL洗硅胶柱,除去这些低极性的物质。然后依次用不同浓度的氯仿/甲醇溶液各300 mL梯度洗脱(氯仿∶甲醇为100∶1、50∶1、100∶3、25∶1、20∶1、15∶1、10∶1),极性梯度由低到高,可使不同极性的物质按照极性从小到大被洗出来。通过薄层层析监测洗脱液的组成,将组成相近的洗脱液合并收集并浓缩蒸干和称重,得到7个较纯的组分。各收集洗脱液的体积比以及各组分的质量比率数据见表4,除组分7外,其他各组分质量比率都超过了10%。
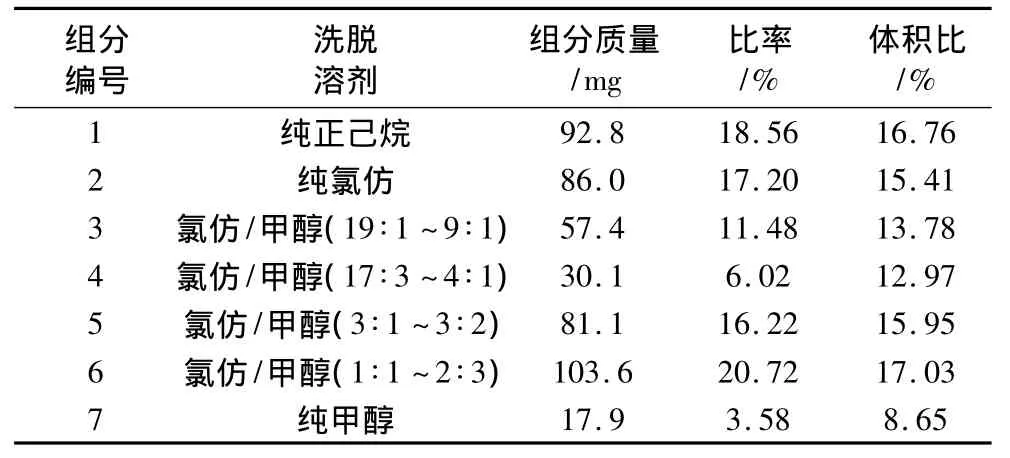
表4 收集液中各组分比率
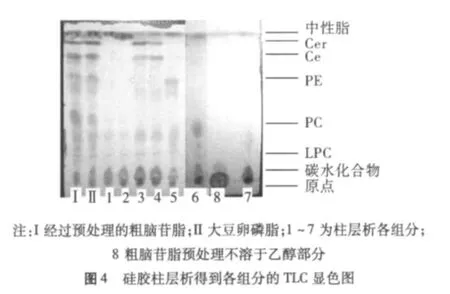
各个收集组分通过硫酸显色的TLC图见图4,可以根据颜色的不同区分其主要成分,其中鞘脂类显紫罗兰色、磷脂类显黄色、其他糖酯及碳水化合物显淡蓝色。从图4上可以看出,虽然采用石油醚萃取脱中性脂以及热乙醇预处理,从大豆卵磷脂中得到的粗脑苷脂其主要成分和卵磷脂类似,只是各种成分含量发生了变化。而预处理不溶于乙醇的部分几乎不含有效成分,主要成分为机械杂质和一些难溶解的粘液质物质。另外也说明,单纯的溶剂萃取不能获得高纯度的目标物质,必需通过柱层析的方法才可以将各种成分进行分离纯化。通过参考文献[16]可知从TLC图从溶剂前沿到点样点顺序,主要成分分别为中性脂,甾醇类、Cer、Ce、PE(Phosphatidylethanemine,磷脂酰乙醇胺)、PC(Phosphatidylcholine,磷脂酰胆碱)、LPC(Lyso - Phosphatidylcholine,溶血磷脂酰胆碱)、碳水化合物。
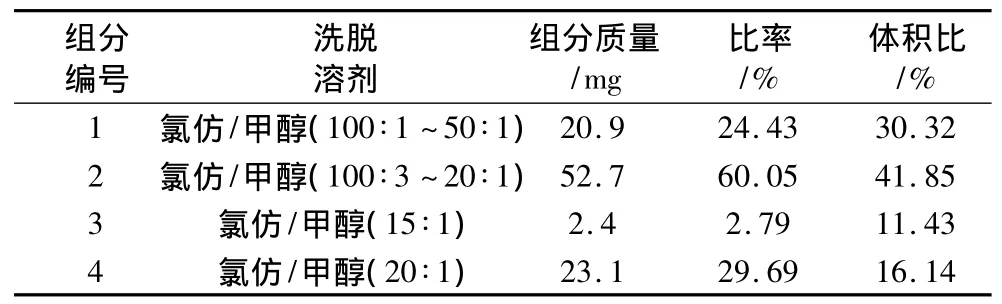
表5 二次过柱后收集液中各组分比率
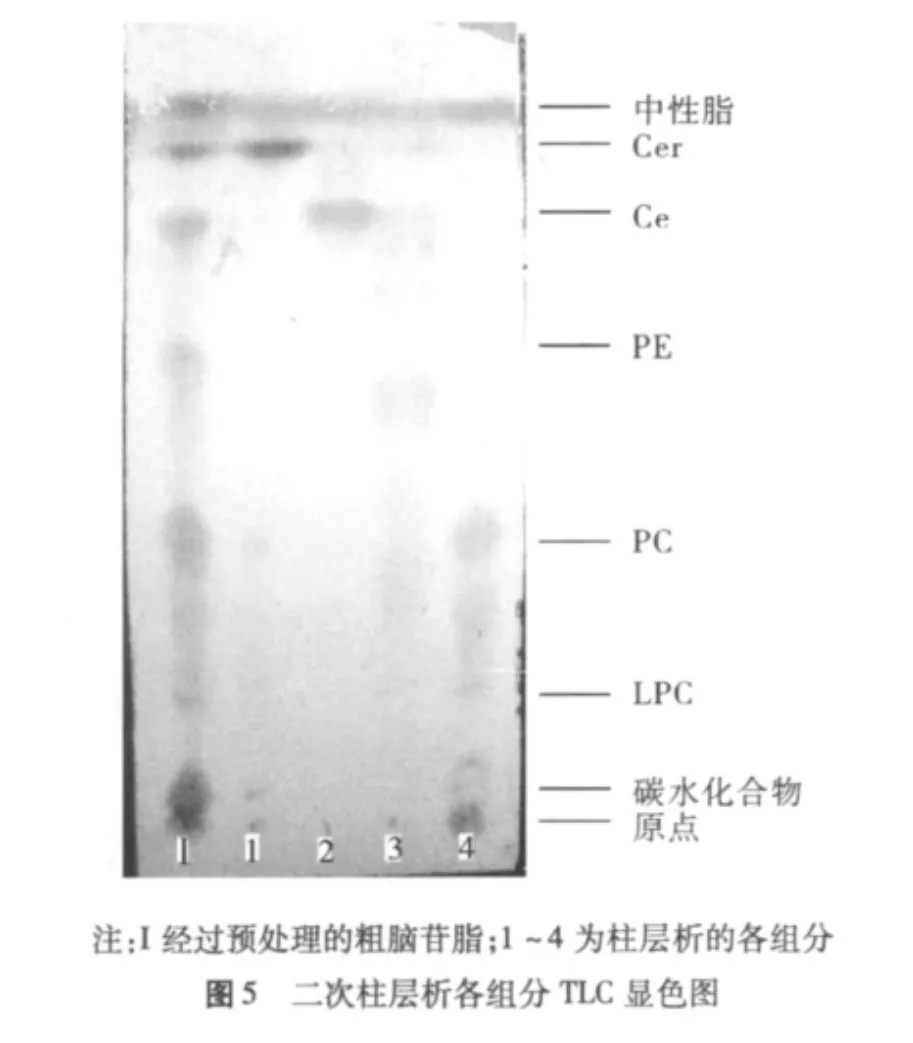
除了组分3和组分4以外,其他各组分大多只有一个点,纯度较高。组分1和组分2是中性脂质组分,显色呈黄褐色,其他各组分的最前端为展开剂溶剂前沿。组分3和组分4包含本研究的目标产物脑苷脂和附加值很高的神经酰胺,由于脑苷脂和神经酰胺极性差别较小,一次柱层析分离不彻底。将组分3和组分4得到的干物质合并,用氯仿溶解后合并再过一次硅胶柱,用氯仿/甲醇(氯仿∶甲醇为 100∶1、50∶1、100∶3、25∶1、20∶1、15∶1、10∶1)各100 mL 洗脱,收集液通过TLC监测,合并主要成分相同的洗脱液,顺次得到3个主要成分,如图5所示,组分1和组分2前端为溶剂前沿。各收集洗脱液的体积比以及各组分的质量比率数据见表5,可以看出组分1为Cer,组分2为Ce,组分3基本为洗脱剂,说明大部分物质在组分1和组分2中,组分4为PC。
3 结论
3.1 采用石油醚提取浓缩大豆磷脂中的粗脑苷脂,正交试验确定石油醚提取脑苷脂的最优条件是料液比1∶1、提取温度为50℃下提取时间30 min,粗脑苷脂的得率为6.58%。经过石油醚二次萃取和热乙醇溶解等预处理后粗脑苷脂的得率为0.25%。
3.2 采用硅胶柱层析,以氯仿/甲醇为洗脱剂,梯度洗脱纯化脑苷脂类物质,通过TLC检测洗脱液成分。通过二次柱层析,可以得到高纯度的脑苷脂和神经酰胺物质。
[1]Vesper H E,Schmelz M Z.Sphingolipids in food and the emerging importance of sphingolipids to nutrition[J].Nutrition,1999,129:1239 -1250
[2]Sullards M C,Lynch D V,Merrill A H,et al.Structure determination of soybean and wheat glucosylceramides by tandem mass spectrometry[J].Journal of Mass Spectromtry,2000,35:347-353
[3]Iwamori M,Costello C,Moser H.Analysis and quantization of free ceramide containing nonhydroxy and 2-hydroxy fatty acids and phytosphingosine by high performance liquid chromatography[J].Journal of Lipid Research,1979,20:86 -96
[4]刘圣红,苟萍.鞘脂类的研究进展[J].生物技术,2009,19:96-98
[5]Fattorusso E,Mangoni A.Progress in the chemistry of natural products[J].New York Springer Wien,1997,72:215 -301
[6]刘晓军,吴梧桐.脑苷脂的制备及其抗溃疡活性研究[J].药物生物术,1995,2:19 -23
[7]Jin W Z,Kenneth L R,Elizabeth A.Ophidiacerebrosidescytotoxic glycosphingolipids containing a novel sphingosine from a sea star[J].Journal of Organic Chemistry,1994,59:44-147
[8]Natori T,Morita M,Akrmoto K,et al.Agelasphins,novel antitumor and immunostimulatory cerebrosides from the marine sponge A gelas Mauritianus[J].Tetrahedrom,1994,50(9):2771-2784
[9]桑已曙,闵知大.脑苷脂类化合物研究进展[J].中国生化药物杂,2000,21:211 -213
[10]Yamada K,Sasaki K,Harada R,et al.Constituents of holothuroidea,12.isolation and structure of glucocerebrosides from the sea cucumber holothuria pervicax[J].Chemical &Pharmaceutical Bulletin,2002,50:1467 -1470.
[11]Kawatake S,Nakamura K,Inagaki M,et al.Isolation and structure determination of six glucocerebrosides from the starfish Luidia maculata[J].Chemical& Pharmaceutical Bulletin,2002,50(8):1091 -1096.
[12]魏静,钟耕,屈浩亮.超声波法提取魔芋飞粉中神经酰胺的初步研究[J].食品科技,2008,1:146-150.
[13]Wang L P,Wang T,Fehr W R.Effect of seed development stage on sphingolipid and phospholipid contents in soybean seeds[J].Journal of Agriculture and Food Chemistry,2006,54:7812 -7816
[14]Wang L P,Wang T,Fehr W R.HPLC quantification of sphingolipids in soybeans with modified palmitate content[J].Journal of Agriculture and Food Chemistry,2006,54:7422-7428
[15]Gutierrez E,Wang T,Fehr W R.Quantification of sphingolipids in soybeans[J].Journal of the American Oil Chemists'Society,2004,81:737 -742
[16]Patrick LS,Peter K.Molecular structure and baking performance of individual glycolipid classes from lecithins[J].Journal of Agriculture and Food Chemistry,2009,57:5597 -5609.
Study on Separation and Purification of Cerebrosides from Soybean Lecithin
Han Xue1Wang Yong1Hu Changying1Wang Lili1Liu Yuanfa2Wang Xingguo2
(Department of Food Science and Engineering,Jinan University1,Guangzhou 510632)
(School of Food Science and Technology,Jiangnan University2,Wuxi214122)
Cerebrosides(Cer)are the predominant sphingolipids(SL)in the tissues of animals and plants with certain biological activity.In this study,soybean lecithin was used as raw material to extract neutral lipids by petroleum ether to obtain the crude cerebrosides.The optimal conditions for extraction obtained by the single factor experiments and the orthogonal experiments were listed as follows:ratio of solvent to stuff of 1∶1,extraction temperature of 50 ℃and extraction time of 30 min.Under these conditions,the highest yield of the crude cerebrosides was 6.58%.The crude cerebrosides were separated and purified by a silica gel column chromatography and gradiently eluted by chloroform/methanol solvent mixture.Cerbrosides with a high purity were obtained by the second column chromatography purification.
soybean lecithin,cerebrosides,ceramide,silica gel column chromatography
TS227
A
1003-0174(2011)03-0011-05
863计划(2010AA101505),中央高校基本科研业务费专项资金(21610501)
2010-04-28
韩雪,女,1984年出生,硕士,食品科学
汪勇,男,1977年出生,副研究员,硕士生导师,粮食、油脂及植物蛋白工程
