乳源性金黄色葡萄球菌肠毒素的检测与基因分型
2011-10-19杨军张驰
杨军,张驰
(南京市产品质量监督检验院国家农副产品质量监督检验中心,南京210028)
乳源性金黄色葡萄球菌肠毒素的检测与基因分型
杨军,张驰
(南京市产品质量监督检验院国家农副产品质量监督检验中心,南京210028)
通过检验各类乳制品收集了大量乳源性金葡菌菌株,应用酶联荧光免疫分析法对菌株的肠毒素进行检测分析,并进一步使用荧光定量PCR法对肠毒素基因进行分型。结果表明,乳源性金葡菌肠毒素的检出率与基因型分布均呈现一定显著特征,应用酶联荧光免疫分析法与荧光定量PCR法对肠毒素的检测结果总体无显著性差异。
乳源性金黄色葡萄球菌;肠毒素;酶联荧光免疫;荧光定量PCR;基因分型
0 引言
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是导致人类食物中毒与化脓性感染的最主要病原体之一[1]。乳及乳制品是金葡菌主要食品宿主,我国生奶中金葡菌的污染率一般在15%~30%之间,奶酪、酸奶等乳制品中金葡菌的检出率也一直居高不下[2,3]。在金葡菌的众多毒力因子中,葡萄球菌肠毒素(Staphylococcal Enterotoxin,SE)是导致食物中毒的关键因素。如不计类肠毒素,SE可分为多种血清型,除20世纪60年代确认的5种(SEA-SEE)外,近年又陆续发现6种,即SEG–SEI,SER–SET[4-6]。金葡菌肠毒素的检测与分型对乳品质量控制与安全预警具有重要的现实意义。本研究将对大量乳品中的肠毒素进行检测分析,并首次应用荧光定量PCR法对产肠毒素菌株进行高通量快速血清分型,探索金葡菌肠毒素检测与分型的新方法。
1 材料及方法
1.1 仪器与试剂
自动酶联荧光分析仪(Mini-VIDAS),荧光定量PCR仪(ABI 7500 Fast),水浴摇床,高速离心机(Sigma3-18K)。
VIDAS Staph enterotoxin II检测试剂条,SYBR Premix EX Taq试剂盒,细菌基因组DNA快速提取试剂盒,培养基;溶菌酶,引物;化学试剂均为分析纯。
1.2 实验方法
1.2.1 乳品的检测与菌株的收集
将国家乳制品专项监督抽查中的生奶、巴氏杀菌乳、酸奶、奶酪等乳品,应用国家标准GB4789.10《食品微生物学检验-金黄色葡萄球菌检验》的方法,即质量分数为7.5%的NaCl肉汤培养基增菌、选择性培养、血浆凝固酶试验的流程,对其中的金黄色葡萄球菌进行检验。分别统计每种乳品中金葡菌的污染比率,收集并冻存所得到的乳源性金黄色葡萄球菌。
1.2.2 乳源性金葡菌肠毒素的检测
将冻存的乳源性金黄色葡萄球菌菌株于3 mL质量分数为7.5%的NaCl肉汤培养基中37℃振摇培养过夜,将培养液以5 000 r/min离心5 min以沉淀菌体,取上清液0.5 mL检测其中的金葡菌肠毒素。在mini-VIDAS仪器上按照检测肠毒素的程序进行设定后,分别将培养上清液、阳性对照液、阴性对照液加入试剂条的加样孔内,运行荧光酶联免疫分析程序,仪器即可自动检测培养上清液中的肠毒素。mini-VIDAS试剂条整合了可特异性结合SEA-SEE的多克隆抗体,其定性检测结果以“阴性”或“阳性”表示。
1.2.3 乳源性金葡菌肠毒素的血清型分型
根据Genbank数据库中已发表的各肠毒素基因序列sea-see,seg-sei,ser-set,设计用于金黄色葡萄球菌这11中肠毒素基因检测的SYBR GREEN荧光定量PCR引物,扩增片段的大小介于73-195 bp之间。具体的引物序列见表1。将所有冻存的乳源性金黄色葡萄球菌菌株于3 mL质量分数为7.5%的NaCl肉汤培养基中37℃振摇培养过夜后,使用细菌基因组快速提取试剂盒提取菌株的基因组DNA,并测定其OD260与OD280验证其浓度与纯度。使用TE缓冲液将基因组DNA稀释至1 g/L用于肠毒素的荧光定量PCR分型。按照SYBR Premix EX Taq试剂盒说明书配制20 μL PCR反应体系,包含SYBR Premix EX Taq 10.0 μL,浓度为10 μmol/L扩增引物各0.4 μL,ROX染料0.4 μL,DNA模板2 μL,灭菌双蒸水6.8 μL。应用ABI 7500 Fast荧光定量PCR仪的SYBR GREEN模式进行扩增,反应条件如下:95℃(30 s)、40个循环的95℃(3 s)加60℃(25 s)。反应结束后,设定一个溶解曲线记录循环以考察引物的特异性。当扩增曲线的Ct值小于35时即判定相应的肠毒素基因型阳性,计算每种肠毒素基因型在乳源性金黄色葡萄球菌中出现的比率。表1为用于检测11种肠毒素血清型的引物序列及其扩增片段。
1.2.4 统计分析
使用SPSS11软件提供的卡方检验比较分析mini-VIDAS法和SYBR GREEN荧光定量PCR法检测乳源性金葡菌肠毒素SEA-SEE在所有菌株中出现的频率。
2 结果与讨论
2.1 金黄色葡萄球菌的检测与菌株收集
使用国家乳品标准中以培养和生化鉴定为基础的金黄色葡萄球菌检测方法,以血浆凝固酶阳性为判定依据,对多种乳制品中金黄色葡萄球菌进行了检测分析。共检测来自江苏26家乳品企业的生奶228份、巴氏杀菌乳134份、酸奶104份、奶酪78份,金葡菌的检出率分别为生奶18%(42份阳性)、酸奶6%(6份阳性)、奶酪5%(4份阳性),巴氏杀菌乳金葡菌未检出。从上述阳性样品中各分离一株金葡菌,共收集并保存52株乳源性金葡菌菌株。
2.2 乳源性金葡菌肠毒素的检测
使用mini-VIDAS法对上述所有乳源性金黄色葡萄球菌菌株产肠毒素情况进行检测,结果表明,在52株菌株中,有22株为肠毒素阳性,占42%。即在所收集的乳源性金葡菌中,有近一半菌株可产SEA-SEE中的至少一种。
2.3 乳源性金葡菌肠毒素的分型
将收集的52株乳源性金葡菌菌株分别扩增后,提取其基因组DNA,使用SYBR GREEN荧光定量PCR法对每一菌株基因组中的sea-see,seg–sei,ser–set基因进行鉴定。除对照孔外,在同一块96孔扩增板上可同时进行8个菌株的这11种肠毒素基因的检测,检测在45 min内完成,典型的扩增曲线与溶解曲线如图1所示。由图1可以看出,无论针对何种肠毒素血清型,阳性菌株均呈现明显的扩增反应,溶解曲线的Tm值在72~82℃之间,表明本研究设计的针对11种金葡菌肠毒素基因的检测引物特异性良好。52株金葡菌菌株中,各肠毒素血清型的阳性率如表2所示。由表2可以看出,除新近报道的ses和set外,其余9种肠毒素基因型在乳源性金黄色葡萄球菌菌株中均有分布。与以往大量文献报道的食品种的金葡菌肠毒素以sea为主不同[2,3,7]。本研究收集的乳源性金葡菌中,传统的5种肠毒素血清型sea-see以sed最为常见,阳性率显著高于其他4种血清型;其他血清型中,seg和sei作为肠毒素基因簇(egc)的组成基因,其出现频率显著高于其他肠毒素血清型。

表1 引物序列及其扩增片段
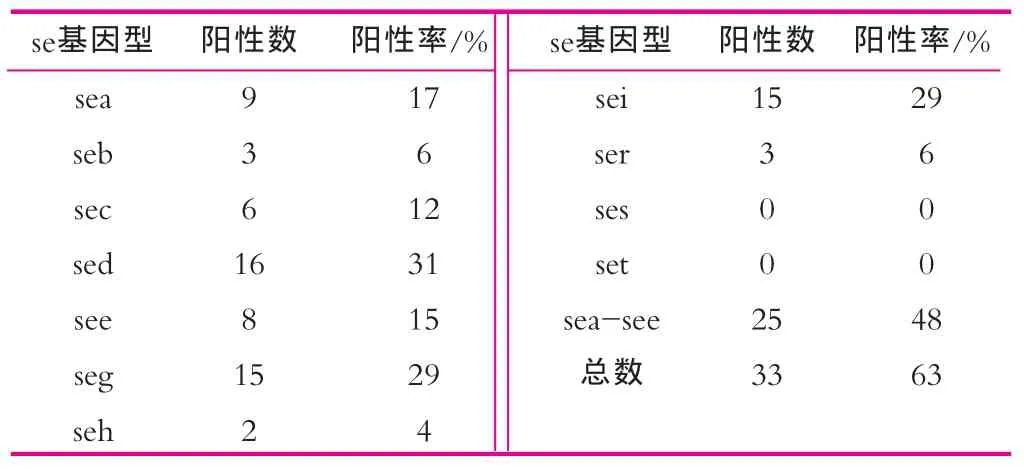
表2 乳源性金葡菌11种肠毒素基因分型结果
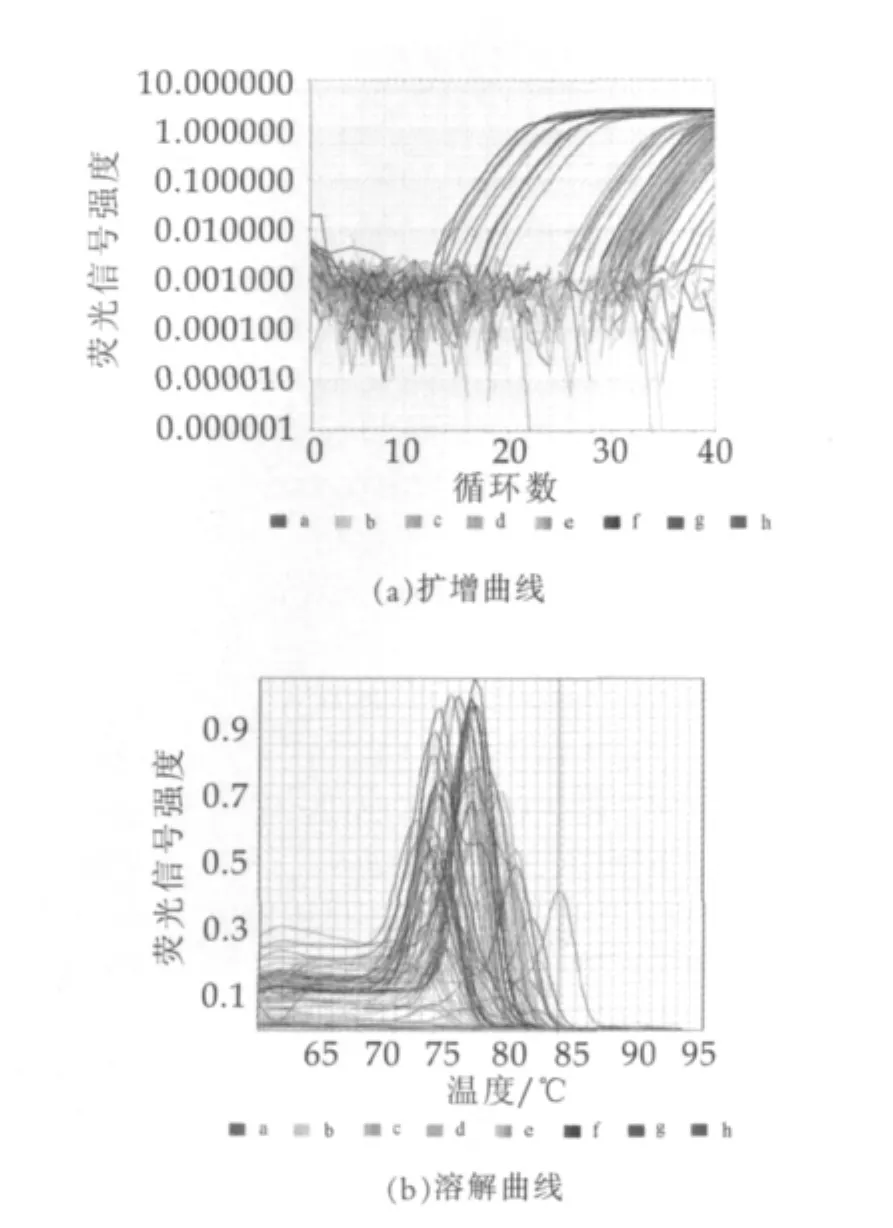
图1 11种肠毒素血清型的扩增和溶解曲线
2.4 两种方法检测金葡菌肠毒素的比较
应用mini-VIDAS法对乳源性金葡菌肠毒素SEASEE检测的阳性率为42%,而应用荧光定量PCR法检测金葡菌肠毒素基因sea-see的阳性率为48%,均低于文献报道的源自临床病例和其他食品中的金葡菌菌株中肠毒素的阳性率。经逐一对比,有3株金葡菌为VIDAS检测阴性,但荧光定量PCR法检出其至少包含一种sea-see基因,表明金葡菌自身的肠毒素基因的表达水平需达到VIDAS检测的阈值才能被之检出,这与国外文献报道的最新研究结论相符[7]。经卡方检验,应用mini-VIDAS与荧光定量PCR法对金葡菌肠毒素SEA-SEE或其基因的检出率总体无显著性差异(P>0.05),表明2种方法具备相似的可信度。
3 结论
(1)各类乳制品中的金葡菌检出率以生奶最高,酸奶和奶酪中也均有检出。使用荧光酶联免疫分析对52株乳源性金葡菌肠毒素的检测表明,近半数的菌株为产肠毒素菌株,低于来自临床病例和其他食品中的金葡菌菌株肠毒素的阳性率。
(2)使用荧光定量PCR法对52株乳源性金葡菌基因组中目前已知的11种肠毒素基因进行快速分型,结果表明大多数肠毒素基因型在乳源性金葡菌中均有分布。与来源于临床病例的菌株不同的是,乳源性菌株中肠毒素以sed和肠毒素基因簇基因(seg和sei)为主。
(3)尽管应用荧光酶联免疫分析与荧光定量PCR法分析肠毒素基因在少数乳源性菌株中出现了基因检测阳性而未检出毒素蛋白的情况,但统计学数据表明两种方法对于肠毒素SEA-SEE或其基因的检测结果无显著差异。
总之,本研究是对乳源性金葡菌关键致病因子肠毒素的检测与分型的首次探索,发现了乳源性金葡菌金葡菌肠毒素基因型分布的新特征,并对肠毒素检测的荧光酶联免疫分析与荧光定量PCR法进行了统计学的方法评价。此外,本研究首次建立的荧光定量PCR法对金葡菌肠毒素快速分型方法,相比于以往文献报道采用的定性PCR与电泳检测的方法,将分型速度与检测通量提高了4-10倍,安全性也具有显著优势,将为乳品安全控制和风险评估提供新的技术支持。
[1] ARVIDSON S,TEGMARK K.Regulation of Virulence Determinants in Staphylococcus aureus[J].Int.J.Med.Microbiol,2001,291(2):159-70.
[2] 徐勤,巢国祥.生牛奶中金黄色葡萄球菌污染状况及耐药性状研究[J].中国卫生检验杂志,2005,15(8):972-973.
[3] 巢国祥,焦新安,周丽萍,等.食源性金黄色葡萄球菌流行特征、产肠毒素特性及耐药性研究[J].中国卫生检验杂志,2006,16(8):904-907.
[4] MARRACK P,KAPPLER J.The Staphylococcal Enterotoxins and Their Relatives[J].Science,1990,248(1):705-711.
[5] OMOE K,IMANISHI K,HU D L,et al.Characterization of Novel Staphylococcal Enterotoxin-Like Toxin Type P[J].Infect Immun,2005,73(1):5540-5546.
[6] ONO H K,OMOE K,IMANISHI K,et al.Identification and Characterization of Two Novel Staphylococcal enterotoxins Types S and T[J].Infect Immun,2008,76(2):4999-5005.
[7] PEREIRA V,LOPES C,CASTRO A,et al.Characterization for Enterotoxin Production,Virulence Factors,and Antibiotic Susceptibility of Staphylococcus aureus Isolates from Various Foods in Portugal[J].Food Microbiol,2009,26(1):278-282.
Detection and serological type identification of enterotoxins in dairy-derived Staphylococcus aureus
YANG Jun,ZHANG Chi
(Nanjing Insititute of Supervision&Testing on Product Quality,Nanjing 210028,China)
In the present study,we collected dairy-derived S.aureus strains in the inspection of various dairy products,and then examined the enterotoxin production of the isolates using enzyme-linked fluorescent assay(mini-VIDAS).Further,Real-time PCR analysis was performed to identify 11 of enterotoxin serological types in these strains.The frequency of enterotoxin-positive isolates presented unique characteristics,as well as the distribution of enterotoxin serological types.In addition,there was no significant difference between the test results of enterotoxin in dairy-derivedS.aureususing VIDAS assay and Real-time PCR.
dairy-derivedStaphylococcus aureus;enterotoxin;enzyme-linked fluorescent assay;Real-time PCR;serological type identification
Q939.9,TS252.7
A
1001-2230(2011)03-0014-03
2010-12-15
杨军(1971-),男,高级工程师,研究方向为食品质量安全检测。
