乳酸菌发酵代谢合成叶酸的影响因素
2011-10-19刘友群周方赵宏飞展海宁张柏林
刘友群,周方,赵宏飞,展海宁,张柏林
(北京林业大学生物科学与技术学院,北京100083)
乳酸菌发酵代谢合成叶酸的影响因素
刘友群,周方,赵宏飞,展海宁,张柏林
(北京林业大学生物科学与技术学院,北京100083)
对嗜酸乳杆菌以及乳酸乳球菌发酵合成叶酸的影响因素进行了研究。结果表明,乳酸菌代谢合成叶酸的产率为17~100 μg/L,菌种、培养时间、pH值、对氨基苯甲酸(PABA)质量浓度会影响乳酸菌合成叶酸的产量。与乳酸乳球菌乳酸亚种相比,嗜酸乳杆菌CH-2生成的叶酸产量要高。不同菌株生成叶酸的能力与pH值有关,嗜酸乳杆菌在pH值为4.2叶酸产率明显下降,乳酸乳球菌乳酸亚种产叶酸的能力则不受pH值影响。添加PABA可以显著提高乳酸菌的叶酸产率。选择适宜的乳酸菌菌株,优化发酵工艺参数可以提高乳及相关食品中叶酸的质量浓度,达到生物方式强化叶酸的效果。
叶酸;乳酸菌;pH值;对氨基苯甲酸
0 引言
叶酸是指四氢叶酸及其衍生物,属B族维生素,是介导一碳单位转移极其重要的辅助因子[1]。叶酸被机体吸收后以辅酶形式参与一碳单位转移,对核苷酸和蛋白质的生物合成及细胞的分裂生长具有特别重要的作用[2]。叶酸缺乏可导致胎儿神经管畸形[3]、巨幼红细胞性贫血,且与心血管疾病、老年性痴呆、直肠癌及子宫颈癌密切相关[4-7]。膳食叶酸对人类至关重要,这是因为哺乳动物细胞不能合成叶酸,但组织的生长需要大量叶酸。植物和微生物可以合成叶酸,是膳食叶酸的重要来源。如植物中的甘蓝、柑橘、大麦、扁豆等。微生物中如酵母产叶酸可达5.16~60.54 μg/g干菌体[8,9],乳酸菌产叶酸可达17~100 μg/L[10]。
本研究从菌种、pH值、对氨基苯甲酸等条件入手,研究乳酸菌代谢合成叶酸的影响因素,为优化叶酸产量工艺以及改善膳食摄入的叶酸途径提供依据。
1 实验
1.1 材料
菌株为工业微生物菌种资源共享平台保存的乳酸菌菌株,乳酸乳球菌乳酸亚种0231及嗜酸乳杆菌0019(CH-2)。
培养基为乳酸乳球菌乳酸亚种用培养基M17进行培养和菌株CH-2用培养基MRS进行培养。
1.2 方法
(1)发酵液中叶酸质量浓度的检测。
样品前处理:发酵液中加入提取缓冲液(浓度为0.05 mol/L磷酸缓冲液中加入质量分数为1%抗坏血酸钠),50℃,搅拌提取1 h;离心8 000 g,10 min;上清液用鸡胰酶酶解1 h,37℃;离心1 000 g,10 min;取上清液0.45 μm膜过滤。
色谱条件:高效液相色谱仪;流动相:甲醇与浓度0.05 mol/L磷酸二氢钾的比为10︰90(pH值为6.4);色谱柱为C18柱(25 cm×4.6 mm,5 μm球形填料,迪马钻石柱);流速为1 mL/min;二极管阵列检测器为280 nm。
(2)菌种。
使用前将菌株CH-2、乳酸乳球菌乳酸亚种按质量分数为2%接种量分别转接至MRS和M17培养基中,37℃培养14 h,使菌株活力得到充分恢复,将已活化好的菌种以2℅接种量转入MRS或M17培养基中,37℃培养14 h后离心(6 000 r/min,20 min)收集菌体。将收集到的菌体悬浮于灭菌的质量分数为8.5‰生理盐水中,调节菌数至108mL-1,然后按质量分数为2%接种量分别接入液体MRS或M17培养基中,37°C厌氧培养12 h,根据样品前处理所述方法取样,采用HPLC法检测发酵液中叶酸质量浓度。
(3)培养时间。
采用吸光光度法测定菌体生长。用分光光度计,在波长600 nm下,以未接种的标准0管调节零点,测定标准管、样品管的光密度值。将活化好的菌株CH-2、乳酸乳球菌乳酸亚种按2%接种量分别接入液体MRS和M17培养基中,按一定时间间隔取样,600 nm处测定吸光值,同时取样测其叶酸质量浓度。
(4)初始pH值。
将活化好的菌株CH-2、乳酸乳球菌乳酸亚种按质量分数为2%接种量分别接入pH值为4.2,5.2及6.2的液体MRS和M17培养基中,37°C厌氧培养24 h,按一定时间间隔取样,测定其OD值及叶酸质量浓度,以pH值为6.2时的结果作为对照。
(5)添加PABA对叶酸产率的影响。
分别接种CH-2、乳酸乳球菌乳酸亚种于MRS或M17液体培养基,其中将3%对氨基苯甲酸(PABA)加入到MRS或M17培养基中,从第4小时开始,每2 h取样检测叶酸质量浓度。
每次实验过程中取样重复3次,取其平均值,并在结果中标示标准偏差范围。
2 结果与讨论
2.1 菌株的影响
图1为不同菌株对叶酸差率的影响。由图1可以看出,不同菌株发酵代谢叶酸产率不同,CH-2发酵12 h时叶酸产量为15.0 μg/L,乳酸乳球菌乳酸亚种为14.0 μg/L,两种菌株之间产量差异远大于各自平行实验间的偏差,可认为嗜酸乳杆菌CH-2叶酸产率略高于乳酸乳球菌乳酸亚种。菌株之间的差异性与M Y Lin等的研究结果一致,他们所选取的德氏乳杆菌保加利亚亚种448与嗜热链球菌MC在复原脱脂乳中培养分别得到叶酸为69.0 ng/mL、59.0 ng/mL。正因为菌株之间存在差异,所以筛选叶酸高产菌株是研究的微生物代谢叶酸的重点之一。
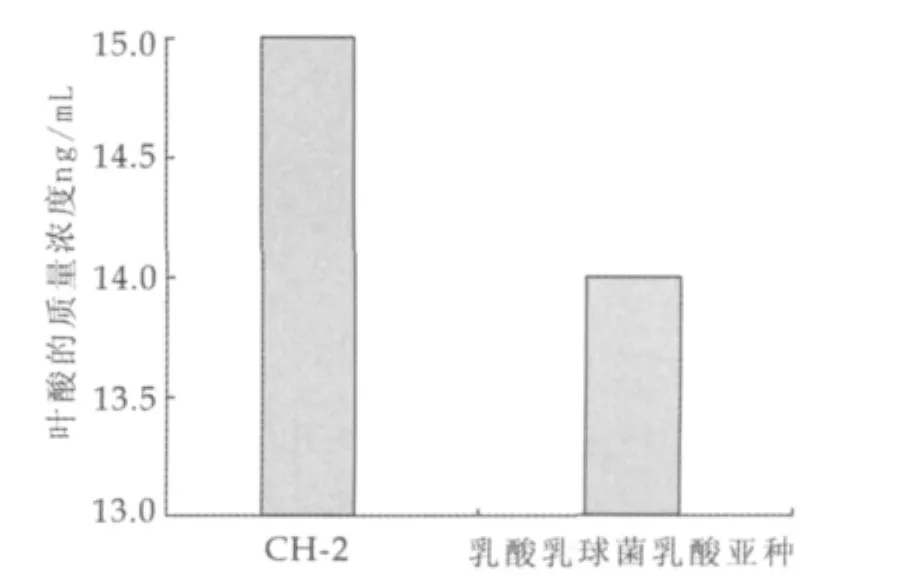
图1 不同菌株对叶酸产率的影响
2.2 培养时间
将活化好的菌株CH-2、乳酸乳球菌乳酸亚种按质量分数为2%接种量分别接入液体MRS、M17培养基中,37℃培养24 h,每隔2 h取发酵液测定其OD600值及叶酸质量浓度。图2和图3为培养时间对CH-2和乳酸乳球菌乳酸亚种叶酸产率的影响。
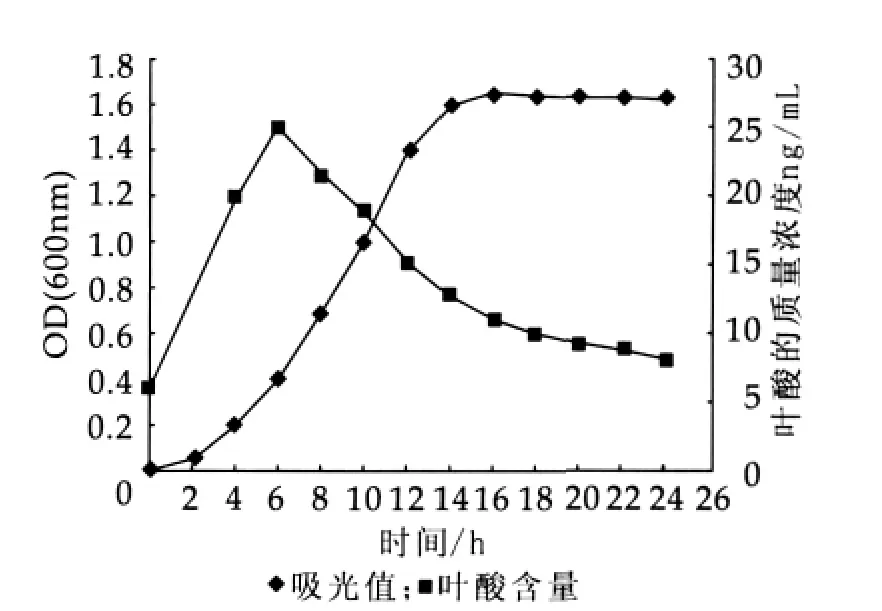
图2 对CH-2叶酸产率的影响
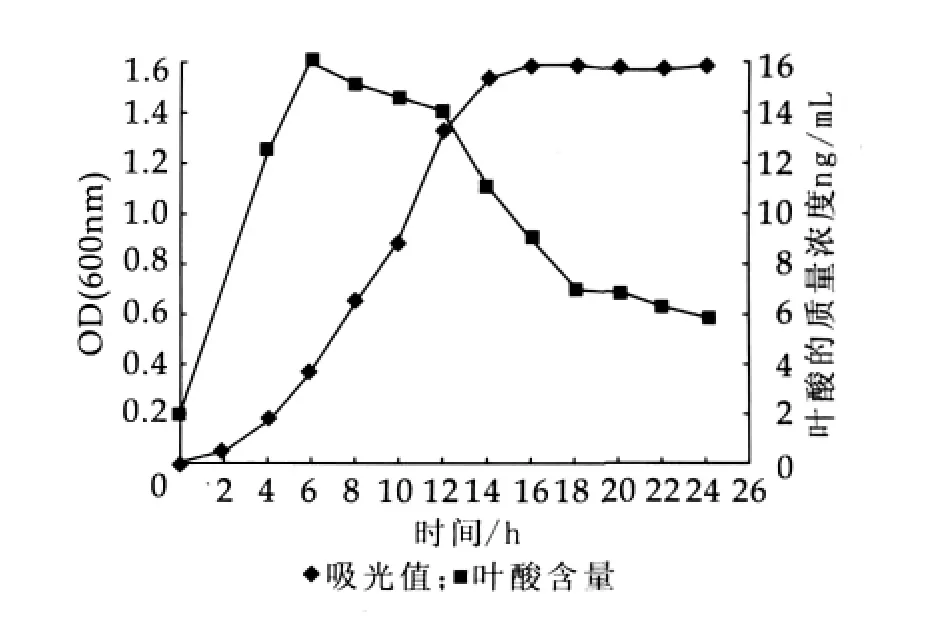
图3 对乳酸乳球菌乳酸亚种叶酸产率的影响
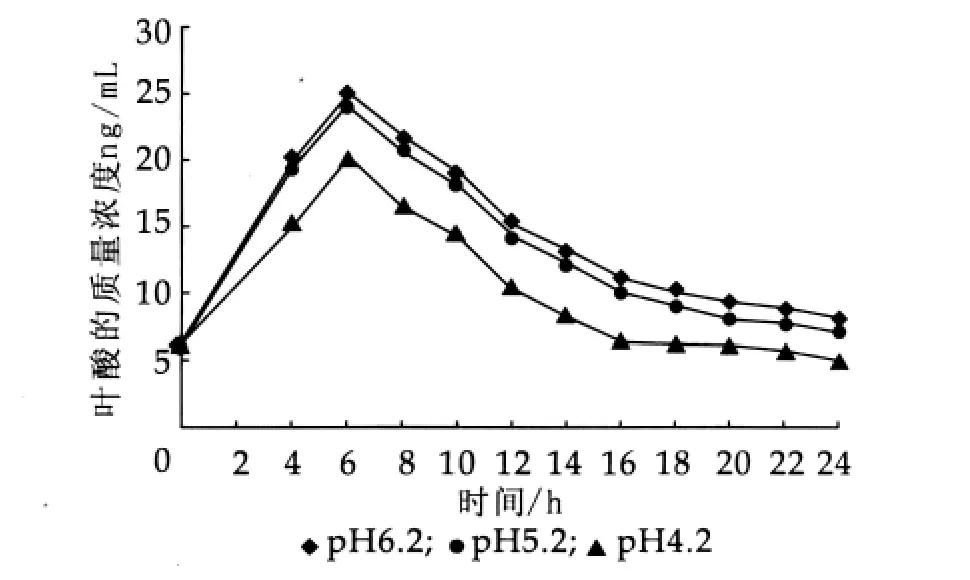
图5 pH值对CH-2叶酸产量的影响
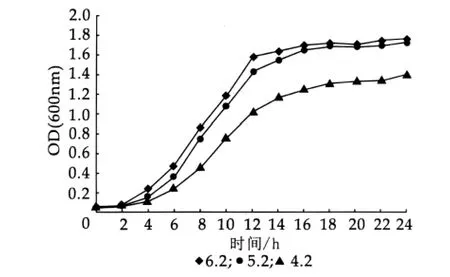
图6 乳酸乳球菌乳酸亚种在不同pH条件下的生长曲线
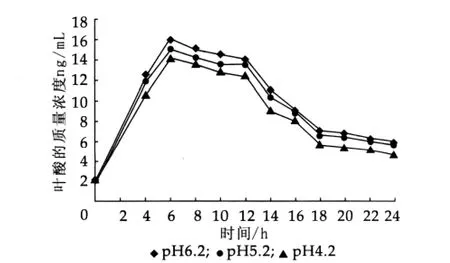
图7 pH值对乳酸乳球菌乳酸亚种叶酸产量的影响
由图2和图3可以看出,两株菌都在2 h左右进入对数生长期,几乎都是在14 h左右结束对数生长期,转入稳定期。乳酸乳球菌乳酸亚种菌体总数稍低于CH-2。6 h左右叶酸产量达到最高,菌体生长处于对数生长期前期,菌体合成大量叶酸以满足繁殖对叶酸的需求。6 h前叶酸合成速度大于叶酸消耗速度,6 h后合成速度低于消耗速度,所以叶酸质量浓度下降。14 h后菌体生长进入稳定期,繁殖速度降低,叶酸的需求量减小,合成量也减少,所以随着时间延长叶酸质量浓度逐步下降。
2.3 初始pH值
将活化好的菌株CH-2、乳酸乳球菌乳酸亚种按质量分数为2%接种量分别接入pH值为4.2,5.2,6.2的液体MRS和M17培养基中,37°C厌氧培养24 h,测定其OD值及叶酸质量浓度,结果如图4~图7。
由图4~图7可以看出,当接种时初始pH值为6.2或pH值为5.2,两个菌种叶酸产量均较初始pH值为4.2时高,且pH值对乳酸乳球菌乳酸亚种的影响要比其对嗜酸乳杆菌影响小一些。初步分析可能存在两个方面的原因:第一,培养基接种pH值为4.2时乳酸菌生长受到一定的抑制,由图4和图6中初始pH值对乳酸菌生长的影响可以看出;第二,pH值低于4.5时,叶酸不稳定,容易分解。
2.4 对氨基苯甲酸(PABA)
分别接种CH-2、乳酸乳球菌乳酸亚种于MRS、M17液体培养基和加入3%对氨基苯甲酸的MRS液体培养基中,从第4 h开始,每2 h取样检测叶酸质量浓度,结果如图8和图9所示。
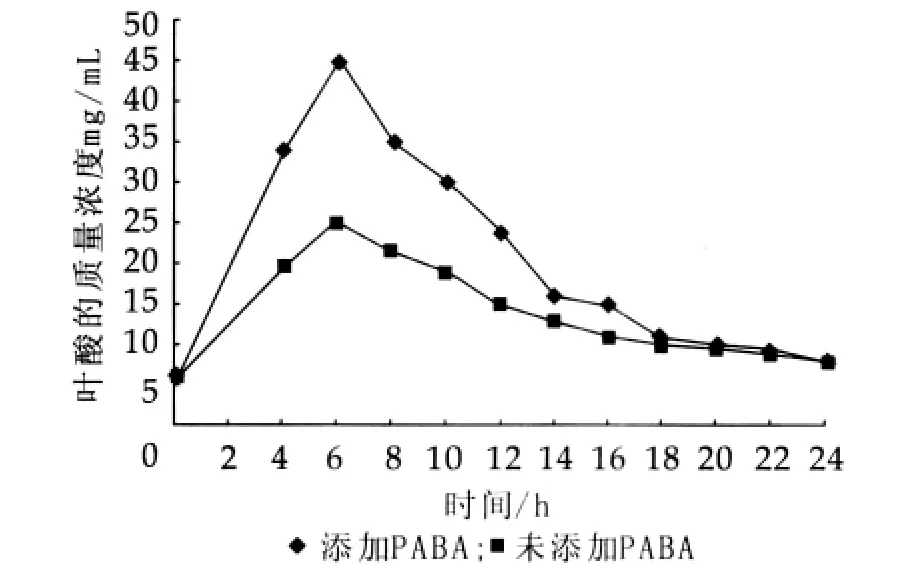
图8 PABA对CH-2代谢叶酸的影响

图9 PABA对乳酸乳球菌乳酸亚种代谢叶酸的影响
由图8和图9可知,对氨基苯甲酸(PABA)可显著提高乳酸菌发酵代谢叶酸的产量,提高大约2倍。微生物细胞中叶酸的合成是利用自身的喋呤、对氨基苯甲酸(PABA)和谷氨酸在叶酸合成酶的作用下完成的,嘌呤经过一系列代谢合成蝶呤,分支酸结合谷氨酰胺在脱氧分支酸合酶(ADCS)作用下合成对氨基苯甲酸(PABA);其次,蝶呤与PABA在二氢蝶酸合酶作用下合成二氢蝶酸;最后,二氢蝶酸结合谷氨酸在二氢叶酸合成酶的作用下合成二氢叶酸,进而在二氢叶酸还原酶催化下生成四氢叶酸[11-16]。Arno Wegkamp等从基因层面证实过量表达PABA合成基因,可大大提高乳酸菌的叶酸合成量。由此可知,PABA是合成叶酸的直接前体物质,在培养基中加入PABA可以加快叶酸的合成,提高发酵液中叶酸的质量浓度。
3 结论
部分乳酸菌株具有代谢生成叶酸的能力,叶酸的产量存在菌株差异性,且受到发酵时间、初始pH值以及前体物质对氨基苯甲酸(PABA)等因素的影响。因此,选择适宜的菌株,优化培养条件可以提高载体中的叶酸产量。
[1] BEKAERT S,STOROZHENKO S,MEHRSHAHI P,et al.Folate Bioforlification in Food Plan[J].Trend Plant Sci.,2007,13:1360-1385.
[2] HANSON A D.ROJE S.One-Carbon Metabolism in Higher Plants[J].Annu.Rev.Plant Physio1.Plant Mol.Biol.,2001,52:119-137.
[3] 熊惠玲,马艳.出生缺陷的病因学研究进展[J].新疆医科大学学报,2006,29(8):765-766.
[4] DUSHIE SJ,NARAYANA NS,BRAND GM,et al.Impact of Folate Deficiency on DNA Stability[J].Nutr.,2002,132(1):2448-2449.
[5] GIOVAMN CCIE.Epidemiologic Studies of Folate and Colorectal Neoplasia-a Review[J].Nutr.,2002,132(1):2350S-2355S
[6] FANG J Y,XIAO S D.Alteration of DNA Methylation in Gastrointestinal Carcinogenesis[J].Castroenterol.Hepatol,2001,16(9):960-968.
[7] LEVIN B.An overview of preventive strategies for pancreatic cancer[J].Ann Oncol,1999,10(4):193-196.
[8] 方尚玲.叶酸及其检测[J].武汉工业学院学报,2000(1):8-12.
[9] 吴周和,吴传茂,李小燕,等.酵母发酵制备叶酸功能食品的研究[J].食品科学,2004,25(1):78-81.
[10] LIN M Y,YOUNG C M.Folate Levels in Cultures of Lactic Acid Bacteria[J].International Dairy Journal,2000(10);409-413.
[11] 阚静,李莉,许激扬.叶酸的生物合成及其代谢工程研究进展[J].中国生化药物杂志.2009,30(4):284-286.
[12] QUINLIVAN E P,ROJE S,BASSET G,et al.The Folate Precursor P-Aminobenzoate is Reversibly Converted to Its Glucose Ester in the Plant Cytosol[J].J.Biol Chem,2003,278(23):20731-20737.
[13] BASSET G J C,QUINLIVAN E P,RAVANEL S,et al.Folate Synthesis in Plants:The P-Aminobenzoate Branch is Initiated by a Bifunctional PabA2PabB Protein That Is Targeted to Plastids[J].PNAS,2004,101(6):1496-1501.
[14] WEGKAMP A,VAN OORSCHOT W,DE VOS W M,et al.Characterization of the Role of Para-Aminobenzoic Acid Biosynthesis in Folate Production byLactococcus lactis[J].Appl Environ Microbiol,2007,73(8):2673-2681.
[15] KLAUS S M J,WEGKAMP A,SYBESMA W,et al.A Nudix Enzyme Removes Pyrophosphate from Dihydroneopterin Triphosphate in the Folate Synthesis Pathway of Bacteria and Plants[J].J.Biol.Chem,2005,280(7):5274-5280.
[16] BABAL T,ARAL T,HASEGAWAL M,et al.Construction of Escherichia coli K-12 in-frame,Single-Gene Knockout Mutants:the Keio Collection[J].Mol Syst.Biol,2006,0008:1-11.
Factors affecting the production of folic acid bylactic acid bacteria
LIU You-qun,ZHOU Fang,ZHAO Hong-fei,ZHAN Hai-ning,ZHANG Bo-lin
(College of Biological Sciences&Biotechnology,Beijing Forestry University,Beijing 100083,China)
The factors affecting the synthesis of folic acid byLactobacillus acidophilusandLactococcus lactissubsp.lactiswere studied.Lactic acid bacteria produced folate of 17~100 μg/L by fermentation,depending on strains,fermentation time,pH and para-aminobenzoic acid(PABA).L.acidophilus strainCH-2 produced more folic acid thanL.lactissubsp.lactisdid.L.acidophilusCH-2 significantly had a low folate yield as pH in media decreased to 4.2,whereas the level of folic acid produced byL.lactissubsp.lactismight be pH-independent.Addition of PABA to media significantly improved the yields of folic acids formed by twolactic acid bacteria.The present study means that use of folateproducing strains,in combination with good fermentation,can fortify the contents of folic acid from milk or related foods.
folic acid;Lactic acid bacteria;pH;para-aminobenzoic acid(PABA)
Q93-335
A
1001-2230(2011)03-0010-04
2010-11-10
国家高技术研究发展计划(863计划)“益生菌定向筛选与功能开发关键技术(2008AA10Z335)”项目。
刘友群(1986-),女,硕士研究生,主要从事食品生物技术研究工作。
张柏林
