酪蛋白与明胶的酶促交联与产物的流变学性质
2011-10-19张伊宁赵新淮
张伊宁,赵新淮
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
酪蛋白与明胶的酶促交联与产物的流变学性质
张伊宁,赵新淮
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
利用转谷氨酰胺酶对酪蛋白和明胶进行酶促混合交联。在酪蛋白与明胶比例为4︰1(质量比)时,以交联产物中羟脯氨酸质量分数为指标,采用单因素试验研究酶添加量、反应时间和温度对交联反应的影响。优化后的适宜交联条件为:底物质量浓度固定为50 g/L,酶添加量为每克蛋白质20 U,反应时间为4 h,温度为45℃。SDS-聚丙烯酰胺凝胶电泳分析表明产物中含有蛋白质聚合物。与原料酪蛋白、转谷氨酰胺酶促交联的酪蛋白相比,所得到的产物的分散液表观黏度和黏弹性均有显著的改变,表明转谷氨酰胺酶催化的酪蛋白和明胶混合可以用于改善其流变学性质。
转谷氨酰胺酶;酪蛋白;明胶;交联;流变学性质
0 引言
蛋白质交联是通过一定的化学试剂或催化剂,在蛋白质分子之间或分子内形成共价键[1],它可以影响食品蛋白质的功能性质[2]。常用的方法有化学法和酶法,且酶法大多采用转谷氨酰胺酶[3]。
转谷氨酰胺酶(EC 2.3.2.13,TG)能够催化蛋白质分子内或分子间形成-(γ-谷氨酰基)赖氨酸共价键[4,5]。利用它处理后的蛋白质,蛋白质的乳化性质变化[6],制作的食用膜有较好的阻水性[7],凝胶的微观结构更为紧密[8]或者是强度增强[9]。采用TG交联单一蛋白质的研究较多,而对两种以上蛋白质的混合交联则不多。本研究利用TG催化酪蛋白与明胶混合交联,以产物中羟脯氨酸质量分数为指标,单因素试验确定适宜的反应条件,用电泳验证交联反应的发生,并对交联产物的流变学性质进行评价。
1 实验
1.1 材料
酪蛋白(蛋白质质量分数89.4%),明胶(蛋白质质量分数90.6%,等电点pH值为8.0~9.0),转谷氨酰胺酶,L-羟脯氨酸,其他化学试剂均为分析纯。
1.2 主要设备
UV-2401PC型紫外可见分光光度计,Gemini II高级流变仪,AL204型分析天平,Alpha 1-4中型冻干机,HZQ-F160型全温振荡培养箱,DELTA 320型精密pH计,H-1型微型漩涡混合器,DK-98-1型电热恒温水浴锅。
2 方法
2.1 交联反应条件的优化
2.1.1 酪蛋白与明胶的混合交联
分别配置蛋白质质量浓度50 g/L的酪蛋白与明胶溶液,用浓度为0.2 mol/L的NaOH调节pH值至7.5,二者以4︰1体积比混合。然后采用单因素实验,通过测定反应后交联产物中羟脯氨酸的质量分数,考察酶添加量、反应时间和反应温度的影响作用,以确定适宜的交联反应条件,并在优化的条件下制备混合交联蛋白质。反应结束后样品在沸水浴加热15 min灭酶,冷却至室温。
用浓度为1 mol/L的HCl将样品溶液pH值调至4.6,使交联酪蛋白等电点沉淀并除去未混合交联的明胶,11 000 g离心15 min,弃去上清液,重复2次,沉淀为交联产物(混合交联蛋白),100℃烘干至恒重。
2.1.2 羟脯氨酸的测定
称取100 mg样品于水解管中,加入4 mL浓度为7.5 mol/L的HCl和1 mL质量分数为5%苯酚,封口后置于110℃下水解24 h,取出后用浓度为10 mol/L的NaOH调节pH值至6.0并且定容至25 mL,用乙酸盐-柠檬酸盐缓冲溶液(浓度为0.88 mol/L乙酸钠,0.24 mol/L柠檬酸,0.21 mol/L乙酸和0.85 mol/L氢氧化钠,pH值6.0)稀释到适当浓度。取2 mL稀释液于试管中,加入1 mL氯胺-T溶液(浓度为0.06 mol/L氯胺-T溶于体积分数为50%的正丙醇),混匀后室温下反应20 min;再加入2 mL对二甲氨基苯甲醛试剂(浓度为0.05 mol/L对二甲氨基苯甲醛,浓度为3.7 mol/L高氯酸溶于体积分数为60%的正丙醇),摇匀,60℃恒温水浴中反应20 min。迅速冷却,550 nm处测定吸光值,平行3次。
以L-羟脯氨酸为标准品,配置不同浓度的L-羟脯氨酸标准溶液,同上测定。以L-羟脯氨酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线[10]。
2.1.3 SDS-PAGE分析
采用稳压法电泳。分离胶质量分数为12%,浓缩胶质量分数4%,低分子量标准蛋白质的质量浓度为0.1 g/L,样品蛋白质质量浓度为5 g/L,每孔进样10 L。样品在浓缩胶时电压为80 V,待溴酚蓝前沿进入分离胶后,加压至120 V,待溴酚蓝距离下缘0.5~1.0 cm时结束电泳。胶片取下后固定30 min,染色6 h,然后脱色直至条带清晰、背景色完全褪去为止,并在凝胶系统成像[11]。
2.2 交联产物的流变学性质测定
2.2.1 表观黏度与剪切速率关系曲线
配制质量浓度为10 g/L的混合交联蛋白质分散液、质量浓度为100 g/L的交联酪蛋白分散液和质量浓度为120 g/L的酪蛋白分散液,调节pH值至7.0。测试选用夹具为平板(直径20 mm),测试间距为500 μm,剪切速率的范围为0.1 s-1~100 s-1[12],取30个点进行测试。
2.2.2 黏弹性
振幅扫描:配制质量浓度为10 g/L的混合交联蛋白质分散液、100 g/L的交联酪蛋白分散液、100 g/L和120 g/L的酪蛋白分散液。测试夹具和间距同2.2.1,测定参数条件如下:应变范围为0.1%~100%,在频率为1 Hz的条件下进行振幅扫描。
频率扫描:测试夹具和间距同2.2.1,用振幅扫描试验确定出线性黏弹区内的最优应变值进行频率扫描测试,频率范围为0.1~5 Hz。
2.3 数据统计分析
采用SPSS 13.0软件中Duncan’s multiple range tests对试验数据进行统计分析(α=0.05),利用Excel 2003软件绘图报告结果,其中每组试验重复数为3次。
3 结果与讨论
在转谷氨酰胺酶的作用下,理论上,不仅酪蛋白、明胶可以发生交联反应,酪蛋白和明胶之间也可以发生交联反应。羟脯氨酸是机体胶原蛋白的主要成分之一,而在其它蛋白中则不存在[13]。明胶中含有羟脯氨酸,酪蛋白中并无此种氨基酸。由于明胶的等电点在8~9,所以pH值4.6下的酸沉淀处理,可以除去未与酪蛋白结合的明胶。故此,测定混合交联产物中的羟脯氨酸质量分数,不仅可以证实明胶与酪蛋白之间发生交联反应,还可以衡量出混合交联蛋白中明胶的相对水平。
3.1 反应条件对交联产物中羟脯氨酸质量分数的影响
3.1.1 酶添加量
在底物质量浓度为50 g/L,50℃下反应时间4 h时,酶添加量对交联产物中羟脯氨酸质量分数的影响如图1所示。由图1可以看出,随着酶添加量的增加,产物中羟脯氨酸质量分数也增加。酶添加量从每克蛋白质5 U增加到20 U时,羟脯氨酸的质量分数从34.64 mg/g增加到41.29 mg/g。但当酶添加量高于每克蛋白质20 U时,统计分析结果显示产物中羟脯氨酸质量分数并无显著性增加,故此选择酶添加量为每克蛋白质20 U。
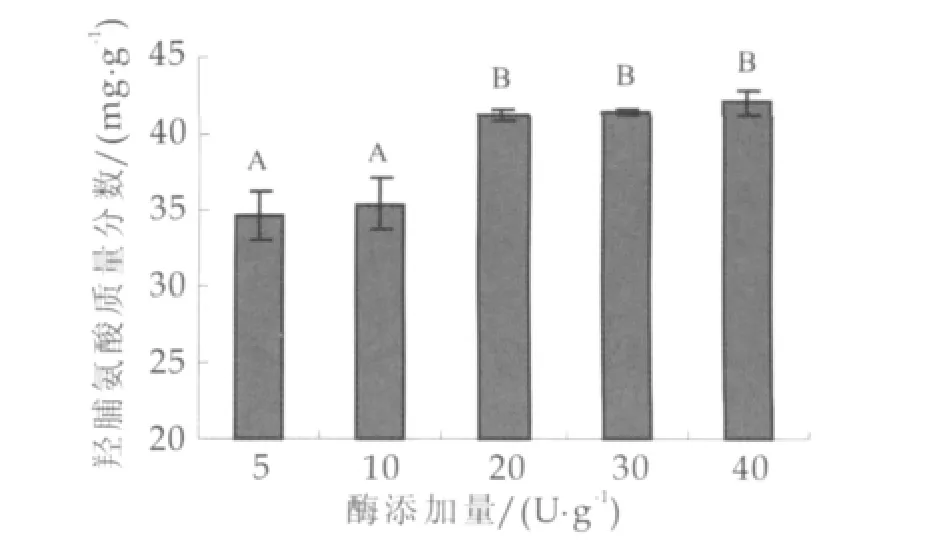
图1 酶添加量对羟脯氨酸质量分数的影响
3.1.2 反应时间
在底物质量浓度为50 g/L,酶添加量为每克蛋白质20 U,反应温度为50℃的条件下,反应时间对交联产物中羟脯氨酸质量分数的影响如图2所示。由2可以看出,随着反应时间的延长,产物中羟脯氨酸质量分数也随之增加,从28.16 mg/g增加到37.40 mg/g;反应超过4 h后,产物中羟脯氨酸质量分数无显著性增加。所以适宜的反应时间确定为4 h。
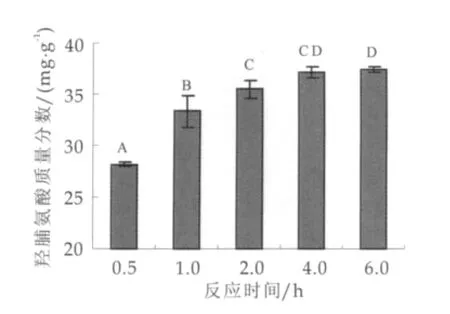
图2 时间对羟脯氨酸质量分数的影响
3.1.3 反应温度
在底物质量浓度为50 g/L、酶添加量为每克蛋白质20 U,反应时间为4 h时,研究反应温度(40~60℃)对交联产物中羟脯氨酸质量分数的影响,结果如图3所示。由图3可以看出,当温度从40℃升高到50℃时,产物中羟脯氨酸质量分数增加;当温度高于50℃时,羟脯氨酸质量分数反而下降。这种现象与酶自身的特性相符,即在适宜的温度下活力最高,当温度高于最适温度时,酶的活力反而下降。当反应温度为45℃时,产物中羟脯氨酸质量分数为40.69 mg/g;而反应温度为50℃时,产物中羟脯氨酸质量分数为41.46 mg/g。统计分析结果表明,二者并无显著性差异,所以选择45℃为反应温度。

图3 温度对羟脯氨酸质量分数的影响
通过上述分析可知,当酪蛋白与明胶质量浓度固定为50 g/L时,混合交联反应的最优条件:酶添加量为每克蛋白质20 U,反应时间为4 h,反应温度为45℃。
3.2 SDS-PAGE电泳分析
在优化条件下制备混合交联蛋白质,同时按照这个条件制备交联酪蛋白。将混合交联蛋白、交联酪蛋白、酪蛋白同时进行SDS-PAGE分析,结果如图4所示。由图4可以看出,混合交联蛋白质(泳道1)与交联酪蛋白(泳道2)中均有分子质量大于97.4 ku的蛋白质存在,并且没有酪蛋白的特征条带,而酪蛋白(泳道3)中则没有分子质量大于97.4 ku的蛋白质存在。这说明在转谷氨酰胺酶作用下生成了交联蛋白。Chambi等[14]用转谷氨酰胺酶催化明胶和酪蛋白交联制备可食性薄膜,SDS-PAGE分析显示交联样品有分子质量大于212 ku的蛋白质。Jiang等[15]在葡萄糖胺存在下用转谷氨酰胺酶催化大豆分离蛋白,SDS-PAGE分析结果产物中也有分子质量大于97.4 ku的蛋白质聚合物。本研究结果与这两个研究的结果一致,即转谷氨酰胺酶有效地催化底物生产交联蛋白。
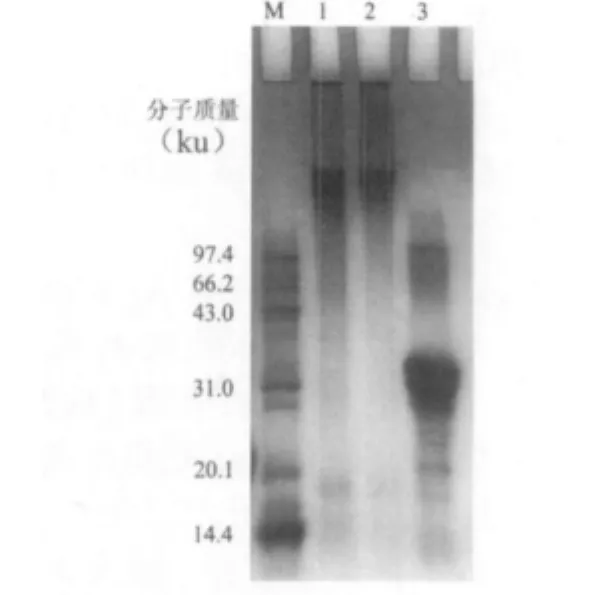
图4 SDS-PAGE分析结果
3.3 交联产物的流变学性质
3.3.1 表观黏度
在0.1 s-1~100 s-1的剪切速率下,3种蛋白质分散液的表观黏度与剪切速率关系如图5所示。图5中,3种不同蛋白质分散液的表观黏度的大小顺序为:10 g/L混合交联蛋白质>100 g/L交联酪蛋白>120 g/L酪蛋白。显然,若分散液中蛋白质质量浓度一致,混合交联蛋白质分散液的表观黏度会更大。蛋白质分散液的表观黏度受蛋白质分子大小,溶剂-蛋白质间相互作用,蛋白质-蛋白质间相互作用的影响[16]。酶促交联形成了大分子物质,导致蛋白质分散液表观黏度增大;由于明胶的引入,混合交联产物的表观黏度有了显著增加。所以,交联产物具有更好的增稠作用。
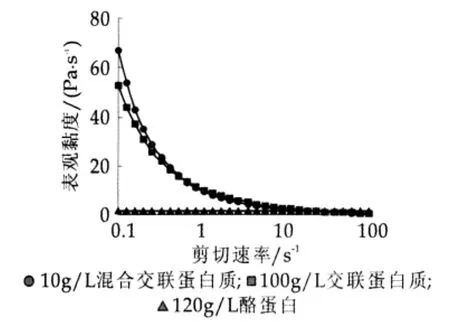
图5 表观黏度与剪切速率曲线
3.3.2 黏弹性
在0.1~5 Hz的频率范围内,测定混合交联蛋白质、交联酪蛋白和酪蛋白分散液的黏弹性,结果如图6所示。由图6可以看出,3个蛋白质分散液的黏性模量、弹性模量由大到小的顺序为:混合交联蛋白质分散液、交联酪蛋白分散液、酪蛋白分散液。黏弹性的变化是由于酶促交联形成的大分子蛋白质物质,使黏弹性增加。明胶本身具有很好的黏性和弹性,所以混合交联蛋白质中由于明胶的引入,使其黏弹性有了很大程度的增加。这些结果进一步表明,交联产物具有更好的增稠作用。

图6 三种蛋白质分散液的黏性模量和弹性模量曲线
4 结论
(1)利用转谷氨酰胺酶催化酪蛋白与明胶进行混合交联,SDS-聚丙烯酰胺凝胶电泳分析表明,产物中含有蛋白质聚合物。化学分析表明,交联产物中含有一定数量的羟脯氨酸,表明有明胶与酪蛋白交联结合。
(2)通过对交联产物中羟脯氨酸质量分数的评价,在酪蛋白与明胶溶液的蛋白质质量浓度为50 g/L,二者体积比为4︰1的条件下,单因素实验得到的最适反应条件为:酶添加量为每克蛋白质20 U,反应时间4 h,反应温度45℃。
(3)混合交联蛋白质的流变学性质得到改善。流变学分析结果表明,混合交联蛋白质的分散液具有显著增加的表观黏度、黏性模量、弹性模量。研究结果表明,转谷氨酰胺酶催化酪蛋白和明胶的交联产物,具有更好增稠作用,具有潜在的应用价值。
[1] FEENEY R E,WHITAKER J R.Importance of Cross-Linking Reactions in Proteins[M]//In Ad vances in Cereal Science and Technology:Volume IX.American Association of Cereal Chemists,Inc.:St Paul,USA,1988.
[2] GERRARD J A,MEADE S J,MILLER A G,et al.Protein Cross-Linking in Food[J].Annals of the New York Academy of Sciences,2005,1043:97-103.
[3] GERRARD J A.Protein-Protein Crosslinking in Food:Methods,Consequences,Applications[J].TrendsinFoodScienceand Technology,2002,13(12):391-399.
[4] DICKINSON E.Enzymic Cross-Linking as a Tool for Food Colloid Rheology Control and Interfacial Stabilization[J].Trends in Food Science and Technology,1997,8(10):334-339.
[5] MOTOK M,SEGURO K.Transglutaminase and Its Use for Food Processing[J].Trends in Food Science and Technology,1998,9(5):204-210.
[6] HINZ K,HUPPERTZ T,KULOZIK U,et al.Influence of Enzymatic Cross-Linking on Milk Fat Globules and Emulsifying Properties of Milk Proteins[J].International Dairy Journal,2007,17(4):289-293.
[7] 李红.利用谷氨酰胺转胺酶生产大豆蛋白食用保鲜膜的研究[J].食品科学,2001,22(1):73-75.
[8] FARNSWORTH J P,LI J,HENDRICKS M.Effects of Transglutaminase Treatment on Functional Properties and Probiotic Culture Survivability of Goat Milk Yogurt[J].Small Ruminant Research,2006,65(1-2):113-121.
[9] JONGJAREONRAK A,BENJAKUL S,VISESSANGUAN W,et al.Skin Gelatin from Bigeye Snapper and Brownstripe Red Snapper:Chemical Compositions and Effect of Microbial Transglutaminase on Gel Properties[J].Food Hydrocolloids,2006,20(8):1216-1222.
[10] EDWARDSCA,O’BRIENWD.ModifiedAssayfor Determination of Hydroxyproline in a Tissue Hydrolyzate[J].Clinica Chimica Acta,1980,104(2):161-167.
[11] LAEMMLI U K.Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J].Nature,1970,227(5259):680-685.
[12] PURWANDARI U,SHAH N P,VASILJEVIC T.Effects of Exopolysaccharide-Producing Strains of Streptococcus thermophilus on Technological and Rheological Properties of Set-Type Yoghurt[J].International Dairy Journal,2007,17(11):1344-1352.
[13] 杨秀颖,杜冠华.组织羟脯氨酸含量微量测定方法及应用[J].中国药理学通报,2004,20(7):836-837.
[14] CHAMBI H,GROSSO C.Edible Films Produced with Gelatin and Casein Cross-Linked with Transglutaminase[J].Food Research International,2006,39(4):458-466.
[15] JIANG S J,ZHAO X H.Transglutaminase-Induced Cross-Linking and Glucosamine Conjugation in Soybean Protein Isolates and Its Impacts on some Functional Properties of the Products[J].European Food Research and Technology,2010,231(5):679-689.
[16] DAMODARAN S.Amino Acids,Peptides and Proteins[M]//In Food Chemistry:3rd edition.Inc.,New York,USA,1996.
Transglutaminase-induced cross-linking of casein and gelatin and rheological properties of the products
ZHANG Yi-ning,ZHAO Xin-huai
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Cross-linking of casein and gelatin catalyzed by transglutaminase was studied in this work.When the ratio of casein to gelatin was fixed at 4∶1(w/w)and the content of hydroxyproline in the obtained product was used as index,the addition level of transglutaminase,reaction temperature and time were studied by single factor experiments.The optimal cross-linking conditions obtained were that protein concentration was fixed at 5%(w/v),enzyme addition level was 20 U/g proteins,reaction time was 4 h and reaction temperature was 45℃.SDSPAGE analysis demonstrated that some protein polymers existed in the obtained product.Compared to casein and transglutaminase-induced cross-linked casein,the dispersion of the obtained product exhibited markedly improved apparent viscosity and viscoelastic behaviors.Our result indicated that cross-linking of casein and gelatin could improve their rheological properties.
transglutaminase;casein;gelatin;cross-linking;rheological properties
Q936
A
1001-2230(2011)03-0020-04
2010-11-08
黑龙江省高等学校科技创新团队建设计划项目(2010td11)。
张伊宁(1985-),女,硕士研究生,研究方向为食品科学。
赵新淮
