1,3-丙二醇发酵液后提取技术研究进展
2011-09-29吴如春许赟珍刘德华
吴如春,许赟珍,刘德华
1 清华大学化工系应用化学研究所,北京 100084
2 广西民族大学化学与生态工程学院 化学与生物转化过程新技术广西高校重点实验室,南宁 530006
1,3-丙二醇发酵液后提取技术研究进展
吴如春1,2,许赟珍1,刘德华1
1 清华大学化工系应用化学研究所,北京 100084
2 广西民族大学化学与生态工程学院 化学与生物转化过程新技术广西高校重点实验室,南宁 530006
1,3-丙二醇是一种重要的化工原料,以甘油或葡萄糖为原料发酵法制备1,3-丙二醇具有原料可再生、反应条件温和等优点,是近年来国内外的研究热点。由微生物发酵获得的 1,3-丙二醇发酵液是含多种强极性的醇及盐类的稀溶液,这使得采用传统的分离方法难以经济、有效地的将 1,3-丙二醇从发酵液中纯化出来,后提取过程成为发酵法工业化生产1,3-丙二醇的瓶颈。1,3-丙二醇后提取过程主要包括微生物菌体等高分子物质的去除,盐的去除、回收,有机物的纯化和水的去除。以下对应用于以上分离过程的技术的研究进展进行讨论,提出在该领域应该重视的发展方向。
1,3-丙二醇,发酵液,后提取,研究进展
Abstract:1,3-propanediol is an important raw material in chemical industry. Microbial conversion of glycerol or glucose into 1,3-propanediol has been given much attention due to its renewable resource, mild reaction conditions, and other advantages. It is a challenge to efficiently separate 1,3-propanediol from a mixture of multiple components, such as 1,3-propanediol, 2,3-butanediol, water, residual glycerol, ethanol, macromolecules and salts, for the reason that 1,3-propanediol, glycerol and 2,3-butanediol are all very hydrophilic and have intense polarity. The conventional evaporation and distillation techniques used in the purification of 1,3-propanediol suffer from the problem of high energy consumption and low recovery. It makes the recovery of 1,3-propanediol from a fermentation broth become a bottleneck in industrial production. The down-stream processing of biologically produced 1,3-propanediol mainly includes the removal of protein,salts, water and other impurities. This paper analyze the research progress of these separation technologies and point out the developing direction worth further investigation.
Keywords:1,3-propanediol, fermentation broth, down-stream processing, research progress
1,3-丙二醇 (PDO) 是一种重要的化工原料,其最主要的一个用途是与对苯二甲酸生成聚对苯二甲酸丙二醇酯 (PTT)[1-2]。目前 1,3-丙二醇的生产方法有化学合成法和微生物发酵法[3-5]。相对于化学合成法,微生物发酵生产1,3-丙二醇具有原料可再生、操作简便、反应条件温和、副产物较少、环境污染小等优点。随着石油资源的日益匮乏,利用可再生资源发酵生产1,3-丙二醇的路线越来越受到关注[6-7],其中以甘油为底物发酵制备 1,3-丙二醇的路线更是研究的热点,这是由于甘油不仅是一种可再生资源,并且随着生物柴油生产规模的不断扩大,其副产物甘油的产量不断增加,价格不断下降,使得以甘油为底物发酵制备 1,3-丙二醇的工艺路线越来越具竞争力。在利用微生物发酵生产 1,3-丙二醇时,由于发酵液体系的复杂性使得产品的分离纯化成本占生产总成本的50%以上,成为大规模生产1,3-丙二醇的瓶颈问题。
在微生物发酵生产 1,3-丙二醇的过程中,菌体在产生目标产物 1,3-丙二醇的同时还会产生 2,3-丁二醇及丁二酸、乙酸、乳酸等有机酸,使得发酵过程中发酵液的pH值不断下降,影响菌体的生长,所以需要加入碱液 (如氢氧化钠溶液) 来中和这些有机酸以保持发酵液中pH值的稳定,同时发酵培养基中含有硫酸铵等无机盐类,因此发酵结束时发酵液是一种含目标产物 1,3-丙二醇的稀溶液,发酵液中的杂质包括大分子物质 (菌体、可溶性蛋白质、核酸和多糖等)、有机物 (甘油、2,3-丁二醇等)、盐 (碱液与丁二酸、乙酸和乳酸等作用形成的盐及培养基中未耗完的盐) 和水。由于目标产物1,3-丙二醇在发酵液中的含量通常为80~110 g/L,同时1,3-丙二醇、2,3-丁二醇和甘油都是高沸点 (三者在常压下的沸点分别为 214 ℃、184 ℃和 290 ℃)、亲水性强的物质,因此将 1,3-丙二醇从这样的复杂体系中分离出来是一项艰巨的任务[8],特别是盐和2,3-丁二醇的存在会降低 1,3-丙二醇的最终收率而使整个提取成本增加。如在采用反应萃取法提纯 1,3-丙二醇时,盐的存在会使得作为催化剂的强酸性阳离子树脂的催化效率下降;而在采用蒸发、精馏法提纯 1,3-丙二醇的时候,盐的浓度会随着蒸发过程的进行不断增加,最终使料液呈浆状,不仅降低 1,3-丙二醇的收率,甚至会堵塞管路使过程无法进行。副产物2,3-丁二醇则由于其物化性质与 1,3-丙二醇接近,会使得多种提纯方法难以进行,如常用的有机物提纯方法-溶剂萃取法就无法实现二者的分离,而对于传统的精馏法,二者沸点的相近使得分离所需的回流比增加,大大增加了能耗。目前 1,3-丙二醇后提取过程迫切需要寻找一条高效、低耗、环保的工艺路线。一些研究者尝试引入新的技术来解决以上问题[9-10],如采用反应萃取法降低 1,3-丙二醇的强极性和强亲水性后实现 1,3-丙二醇的分离和采用电渗析法来实现脱盐过程中污染的减少等。另一些研究者考虑改进传统的分离技术来适用于这个体系[11-12],如采用多效蒸发以降低过程能耗和开发新的适用于该体系的絮凝剂来实现较完全地去除大分子物质的目的。这些研究都取得了很大进展。一般而言,分离纯化1,3-丙二醇需要3个步骤 (图1),第一步是通过膜过滤、高速离心和溶剂沉淀等方法去除菌体等高分子物质;第二步是通过离子交换、电渗析等方法去除盐类,最后一步是通过双水相萃取、精馏和离子交换层析等方法纯化 1,3-丙二醇。本文综述了这些研究在经济、高效地分离1,3-丙二醇方面取得的进展,并展望了今后发展的重点和方向。
1 生物高分子物质的去除
发酵结束后发酵液中生物高分子物质主要包括菌体及其细胞碎片、可溶性杂蛋白、核酸和其他胶状物,从发酵液中分离 1,3-丙二醇的第一步是这些生物高分子物质的去除,否则随着后续减压蒸馏除水过程的进行,发酵液中残留的蛋白、核酸和多糖等大分子物质的浓度会随着水分的减少而逐渐升高,使料液呈浓浆状,阻碍蒸馏操作的顺利进行,并降低最终产物的收率。可以采用的分离方法主要有高速离心法、超滤法、有机溶剂沉淀法和絮凝法。
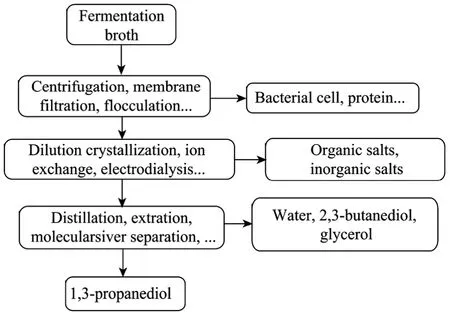
图1 从1,3-丙二醇发酵液中回收、提纯1,3-丙二醇的步骤及主要使用的分离方法Fig. 1 General scheme and major methods studied for the recovery and purification of 1,3-propanediol from fermentation broth.
1.1 高速离心法
该法属于机械法,当离心机转速到达一定后能将菌体等大分子物质沉降下来,实验室采用这种方法可以实现1,3-丙二醇发酵液中大分子物质的去除,但该方法应用于工业规模时存在设备投入成本高、运行能耗大的缺点,经济性差。
1.2 絮凝
絮凝法是通过加入絮凝剂后产生的电中和或桥连等作用促进液体中不易沉降的固体悬浮微粒结合成团、沉降后再经过过滤或离心来达到去除固体悬浮微粒的目的。Hao等[13]采用壳聚糖和聚丙烯酰胺两种絮凝剂耦合对 1,3-丙二醇发酵液进行了絮凝处理,实验结果表明发酵液中蛋白质的去除率大于99.0%。李凡锋等[14]用天然絮凝剂Ⅱ型 B组分处理1,3-丙二醇发酵液时发现絮凝处理后可以加快后续电渗析脱盐时的速度。鲁诗峰等[15]对12种絮凝剂进行了筛选和工艺优化,其中分子量 4万的壳聚糖絮凝效果较好,发酵液中菌体和蛋白质去除率分别为99.97%和 91.56%。该方法工业应用存在的问题是难以获得便宜且高效的絮凝剂。
1.3 有机溶剂沉淀法
有机溶剂沉淀法是在含蛋白质、糖等物质的水溶液中加入乙醇、丙酮等能与水互溶的有机物,使高分子物质的溶解度显著降低并从溶液中沉淀出来而达到分离目的的方法。修志龙等[16]利用乙醇来沉降生物大分子和回收有机酸盐,实验表明乙醇可以在去除 1,3-丙二醇浓缩液中的蛋白和核酸等大分子物质的同时使浓缩液中的有机酸盐出现溶析现象,从而将大部分的盐也分离出去。有机溶剂沉淀法具有分辨率高,溶剂易实现循环使用的优点,但该方法工业应用存在的问题是溶剂用量大,部分溶剂的残留会影响最终1,3-丙二醇产品的质量。
1.4 超滤
超滤是根据物质相对分子质量的不同来进行分离的膜技术,其传质推动力为静压差,其截留物质的分子量范围为5 000~500 000 Da,是一种应用最广泛的膜分离技术。我国研究开发的膜品种有以醋酸纤维素 (CA)、聚砜 (PS)、聚砜酰胺 (PSA)、磺化聚砜 (SPSF)、聚丙烯腈 (PAN)、聚氯乙烯 (PVC)、聚偏氟乙烯 (PVDF)、聚醚砜 (PES) 和聚醚酮(PEK)等为材料的有机膜和以陶瓷、多孔玻璃、氧化铝等为材料的无机膜。
发酵液体系中存在大量的蛋白质、糖、色素和菌体等杂质,对所用膜的孔隙大小,耐酸性及膜通量方面都有较高的要求。鲁诗峰等[17]使用三醋酸中空纤维透析膜对 1,3-丙二醇发酵液进行超滤处理,菌体和蛋白质的去除率分别为 100%和 92.1%。我们应用截留分子量为5 000 Da的陶瓷膜对实际发酵液进行了超滤处理,蛋白质的去除率大于95%,渗透液平均通量大于30 L/(m2·h),有工业应用的价值。
因此相比较而言,超滤法是目前较经济可行的去除生物高分子的方法,具有操作时间短、膜通量高、高分子杂质去除效果好等优点,如果能进一步减少操作过程中膜的污染,提高膜的耐溶剂能力和使用寿命,该方法有望大规模应用于 1,3-丙二醇发酵液中高分子杂质的去除。
2 盐的去除
微生物发酵时盐的来源有两种,一种是为中和发酵过程产生的副产物如乙酸、乳酸、丁二酸等产生的有机盐,一种是在发酵过程添加的培养基中所包含的无机盐。这些盐分在后续的浓缩和精馏操作过程中含量会不断增加,使发酵液呈浆糊状,阻止蒸馏操作的进行,并且还会使有机物的沸点增加,增加精馏过程的能耗和降低产物的最终收率。通常采用的除盐方法有溶析结晶法、离子交换法和电渗析法。
2.1 溶析结晶
溶析结晶是利用被分离物质与溶剂分子间相互作用力的差异,通过改变溶剂的性质来选择性地溶解其中一种组分,从而使另一组分最大限度地从溶剂中结晶析出的过程。如加入甲醇或乙醇能显著降低铬酸钾在水中的溶解度[18]。应用溶析结晶法可以有效地分离出生物大分子,其典型的工业应用是蛋白质及多糖的分离提取。我们用溶析结晶法对 1,3-丙二醇发酵液进行了脱盐实验,实验结果表明分离效果不理想,需要加入大量的溶剂但盐析出不完全,且有部分1,3-丙二醇、2,3-丁二醇和甘油一并析出。该方法存在的主要问题是溶剂加入量大,回收困难且分离效率低。
2.2 离子交换法
据我们实验结果可知,采用离子交换法处理1,3-丙二醇发酵液也可以取得较好的效果,同时还可以去除部分色素,改善最终产品的色度。该方法工业化应用存在的问题是由于发酵液中盐含量高使得树脂容易达到饱和,需要频繁再生,而树脂的再生需消耗3~5倍的酸、碱和大量的水,这不仅增加了过程能耗,还产生大量的酸、碱废液导致环境污染问题。
2.3 电渗析
电渗析是利用离子交换膜和直流电场的作用,从水溶液和其他不带电组分中分离带电组分的一种电化学分离过程,已广泛应用于各种天然水淡化,海水浓缩制盐,有机溶液中电解质离子的去除等领域。实验证明[19-20],用电渗析法可以有效脱除 1,3-丙二醇发酵液中90%以上的有机酸盐和无机盐,具有能耗低、操作简便、环境污染小等优点,同时采用结晶的方法可以部分回收高附加值的盐类[21],是去除1,3-丙二醇发酵液中盐分的有效方法。
目前,电渗析法除盐存在的最大问题是过程能耗相对较高,膜的价格较贵,但随着膜技术的不断发展,膜的性能不断地提高而价格在不断地下降,目前国产异相离子交换膜的价格就有一定的吸引力(如上海产异相离子交换膜yk04价格为187元/m2,使用寿命2~4年)。另一方面,随着国家对生产过程环保要求的提高,该方法由于不形成二次污染,不需要添加化学品,能部分回收发酵液中的盐,具有较高的生态和环境效益,因此是目前较可能大规模应用于1,3-丙二醇发酵液脱盐的方法。
3 醇的分离
去除了菌体、蛋白质等高分子物质和盐分后,1,3-丙二醇发酵液中目标产物 1,3-丙二醇、甘油和2,3-丁二醇的含量分别为10%、2%和2% (质量) 左右。这时需要将大量的水去除,回收 2,3-丁二醇和甘油,但由于这三种醇极性较强,彼此的物化性质比较接近,在发酵液中的浓度都比较低,这给分离提纯带来了很大的困难。传统的精馏技术与反应萃取等新技术相比各有优缺点。
3.1 多效蒸发+精馏
精馏是最传统的分离醇、水混合物的方法。发酵液中1,3-丙二醇、2,3-丁二醇和甘油在常压下沸点分别为214 ℃、184 ℃和290 ℃,所以传统的精馏法可以实现三者的分离,但传统的蒸发和精馏存在着能耗高、产物收率低等问题。因此许多研究者对蒸馏技术进行改进以降低能耗[22-23],如采用四效蒸发将质量分数为5%~15%的1,3-丙二醇水溶液浓缩到80%以上,甚至达到90%后再通过精馏获得合格的1,3-丙二醇产品[24]。总的来说,由于发酵液中1,3-丙二醇的浓度较低,需处理的发酵液量比较大,因此该方法存在的问题是过程能耗比较高,并且需要脱盐、脱蛋白质等预处理过程。
3.2 萃取
3.2.1 有机溶剂萃取
溶剂萃取法具有效率高、生产能力大、能耗低等优点,是 1,3-丙二醇提纯技术研究的一个热点,许多研究者都试图找到一种适合工业化需要的萃取剂。但由于 1,3-丙二醇的极性较强,使其在普通疏水溶剂中的溶解度较小,用物理萃取法难以达到满意的结果[25]。如 Janusz等[26]采用 ESP(Extractant screening program) 程序选择萃取剂,该程序利用UNIQUAC基团分配法来计算多组分液液平衡,主要考察醇的同分异构体和含有功能基团的醇类的萃取能力,实验结果表明对于直链醇分配系数随着碳个数增加减小,同碳的异构物分配系数较大,但与少一个碳的直链醇差不多,二元醇的分配系数比一元醇的高。但体系中存在的 2,3-丁二醇、甘油与溶剂的亲和力较大而使得 1,3-丙二醇的选择性降低。Baniel等[27]研究使用戊醇、丙醇、己醇、蓖麻油等萃取分离1,3-丙二醇,该方法很难大规模应用,其原因在于该过程需加入大量的溶剂且分配系数很低。
3.2.2 络合萃取
具有Lewis酸性或Lewis碱性的物质可以与醇发生络合作用实现醇溶液的分离。向波涛等[28]选取磷酸三丁酯、己酸、辛酸为络合剂,对 1,3-丙二醇的稀溶液进行络合萃取。实验结果表明随着磷酸三丁酯体积分数的增加,分配系数增大,但最大也仅仅为 0.07;使用纯的己酸和辛酸进行萃取时,分配系数也仅为0.07和0.03,远远小于这三种萃取剂对乙醇稀溶液进行萃取时的分配系数,可见由于 1,3-丙二醇的强亲水性,络合萃取的方法对该体系不适用。
3.2.3 反应萃取
由上可知,只有降低 1,3-丙二醇的强极性和强亲水性后萃取法才可能应用于 1,3-丙二醇体系,其中一种降低 1,3-丙二醇亲水性的方法是将其羟基屏蔽,如用醛类物质与 1,3-丙二醇的伯羟基进行可逆缩醛反应以屏蔽羟基,得到亲水性大大降低的化合物后再采用萃取法将其分离,再生后可得到纯的1,3-丙二醇。这就是目前的另一个研究热点—反应萃取分离法[29-30]。Janusz等[31]以强酸性树脂为催化剂,加入乙醛与 1,3-丙二醇发生可逆缩醛反应,生成 2-甲基-1,3-二 烷 (2MD),脱去有机相中水后,用邻二甲苯、甲苯或乙苯萃取2MD,最后2MD水解得到 1,3-丙二醇。实验结果表明使用甲苯进行同步萃取可以改变反应的平衡位置,促使平衡向生成2MD的方向移动,使得最终的1,3-丙二醇转化率和2MD收率 (分别为98%和91%) 都高于不加萃取剂时。反应萃取工艺较为经济合理,但其所得到的 1,3-丙二醇产品中会残留一定浓度的乙醛,该产品用来生产 PTT时会对其纤维产品的多项质量指标产生影响,其中对纤维染色的上染效果以及染色稳定性的影响尤为显著,因此该方法得到的 1,3-丙二醇需要采用其他方法处理后才可用于PTT的聚合过程。如徐泽辉等[32]使用颗粒白土来处理含有残余醛基物质的 1,3-丙二醇。该方法除了乙醛残留问题以外,还存在2MD水解较为困难,1,3-丙二醇收率低和强酸性树脂催化效果受盐影响较大等问题,也难以应用于工业实际。
3.2.4 双水相萃取
双水相萃取具有萃取条件温和、容量高等优点,常用于高附加值产品的小规模生产。已经有研究者开发出新的双水相体系如使用短链醇等来降低萃取剂的价格和避开反萃取操作[33],实验结果表明由强极性溶剂和含高价态阴离子的盐组成的双水相体系能有效地从1,3-丙二醇发酵液中萃取1,3-丙二醇,如在乙醇/硫酸铵组成的双水相体系中,1,3-丙二醇的分配系数可达到 4.08,回收率为 93.7%,并且可直接应用于未去除高分子物质的发酵液。该方法可以实现微生物菌体与 1,3-丙二醇的同时分离,简化分离过程,具有一定的经济价值,有工业放大的可能性,但其存在的问题是萃取后目标产物 1,3-丙二醇的回收研究尚未进行,分离所得盐的回收也未考虑,这些盐直接排放将造成经济损失和环境污染,因此需进一步研究得到较完整的工艺后再重新评估该方法大规模应用的可行性。
3.3 分子筛分离
原位分离是目前分离研究的另一个热点,在1,3-丙二醇生产期间如能将 1,3-丙二醇及时分离出来可以避免产物对细胞生长的抑制和促进 1,3-丙二醇总产量的增加。Gunzel 等[34]用脱铝 NaY和硅沸石处理1,3-丙二醇水溶液,可以实现每克沸石负荷0.112 g 1,3-丙二醇,但该实验没有研究甘油的选择性。Schlieker 等[35]使用活性炭分离1,3-丙二醇,发现由于甘油显著的非特异性吸附使得活性炭在吸附 1,3-丙二醇的同时也部分吸附甘油,导致最终甘油发酵产率大大降低。Schoellner等[36]检验了几种沸石的吸附性能,沸石吸附存在的问题是盐也可能会被沥滤到沸石中,此外还需考虑如何将 1,3-丙二醇从沸石中回收。Li等[37-38]使用ZSM-5型沸石膜分离1,3-丙二醇,根据动力学半径与扩散速率的不同,可以实现绝大部分 1,3-丙二醇 (0.61 nm) 分子被吸收到ZSM-5通道中 (0.62 nm),而甘油、水和葡萄糖大部分不经过沸石通道而达到分离 1,3-丙二醇的目的,但该实验只考察了模拟液,没有对实际发酵液进行研究。总的来说,分子筛法存在单程产率低,沸石的机械强度和热稳定性较差,耗时较长等问题。
3.4 阳离子交换树脂吸附
利用磺化聚苯乙烯阳离子树脂中磺酸基(SO3H)的离子交换功能,可以吸附醇类。Ahmad等[39]采用模拟移动床使发酵液与磺化聚苯乙烯阳离子树脂接触,进行吸附后加入溶剂洗脱被树脂吸收的组分,最后在洗脱液中回收 1,3-丙二醇。实验结果表明使用三种不同类型的树脂 (Na型UB K555 型,Ca型UB K555 型和Ca 型CS11GC350 型) 1,3-丙二醇的回收率都达到95%以上。但磺酸基对极性水分子的吸附作用也很强,这使得该方法的单程转化率较低,为得到高收率的产品,必须循环操作,循环操作不仅增加动力消耗,也增加树脂损失,使得整个过程的经济性下降。因此,只有在获得对 1,3-丙二醇具有高选择性的树脂并且提高其抗磨损性能后该方法才有望实现工业化。
由上可知,许多新技术被应用于 1,3-丙二醇的提纯研究中,但许多技术仅仅在小规模操作时有效,涉及大规模生产时存在各种问题,比较而言传统的蒸发+精馏法具有工艺成熟、产品回收率高等优点而备受瞩目,特别是通过采用多效蒸发和真空精馏技术后该方法的能耗大大降低,经济可行性大大提高。
综上所述,鉴于实际发酵液成分的复杂性和工业化生产所需要的经济性,使得经济、高效地实现1,3−丙二醇的分离提纯难度很大,迄今为止,还没有一条经济可行的提取工艺路线被报道,结合我们的研究工作和上述分析,提出图 2所示的后提取工艺路线,该工艺过程中无化学品加入,实现了发酵液中1,3-丙二醇、2,3-丁二醇、甘油和副产物丁二酸钠的分离和回收。相对于其他工艺路线,该路线考虑了副产物盐的回收,目前报道的盐去除方法大部分只考虑到将盐从发酵液中分离出来,没有考虑盐的回用,这部分分离出来的盐如果直接排放会造成环境污染,因此在 1,3-丙二醇真正工业化生产的时候必须考虑这部分盐的处理,所以从尽可能的实现零排放,更好的实现生产过程的绿色化角度来说,研究该部分盐的回收势在必行。这些盐中丁二酸钠是含量较高,价格也较高的一种 (每生产1 t 1,3-丙二醇会产生大约 0.1 t丁二酸钠,其市场价格为1.1万元/t左右),回收其有较大的经济和环境利益。在图 2所示的后提取工艺路线中丁二酸钠的回收采用浓缩结晶法,可以得到工业级丁二酸钠晶体,有一定经济价值,而且减少了盐污染[21]。但还存在回收过程能耗较高,经济性不明显的问题,需要尝试更佳的回收方法。综合考虑到经济和生态效益,图2所示的 1,3-丙二醇后提取工艺路线具有一定的可行性,但其在能耗和 1,3-丙二醇收率上还存在着局限性,需要进一步研究改进。

图2 具有工业应用前景的1,3-丙二醇后提取工艺路线图Fig. 2 Flow scheme of downstream processing of 1,3-propanediol with potential industrial application prospect.
4 展望
1,3-丙二醇作为一种重要的化学品和生物柴油副产物甘油的关联产物,其生物发酵法制备已成为国内外的研究热点。当前该方法迫切需要解决的问题是如何获得一条经济、高效的后提取工艺路线,以提高其对石化合成路线的竞争力。
根据目前有关 1,3-丙二醇后提取的研究现状来看,许多研究工作是对模拟发酵液进行的,而实际发酵液的成分更为复杂,这就使得工业化规模提取分离 1,3-丙二醇的难度很大。综合而言,采用超滤法去除生物高分子物质,电渗析法除盐和多效蒸发加精馏的工艺路线在经济性和环保性上都具有一定优势 (图2)。考虑到环境污染和增加产品的经济性,回收 1,3-丙二醇发酵液中高附加值的副产物如丁二酸钠等及减少目标产物 1,3-丙二醇在后提取过程中的损失已成为今后研究的方向。
为增加甘油发酵生产1,3-丙二醇的经济竞争力,除了采用更高效的纯化工艺外,通过基因工程和代谢工程等近代分子生物学技术来培育和构建新的生产菌株也至关重要,新菌株的构建不仅应考虑提高发酵时 1,3-丙二醇的浓度,增加底物的转化效率和生产强度,还应该考虑到后续提纯工艺的简化。
REFERENCES
[1] Witt U, Müller RJ, Widdecke H, et al. Synthesis, properties and biodegradability of polyesters based on 1,3-propanediol.Macromol Chem Phy, 1994, 195(2): 793−802.
[2] Smith JG, Kibler CJ, Sublett BJ. Preparation and properties of poly (methylene terephthalates). J Polym Sci,Part A, 1966, 14(7): 1851−1859.
[3] Feng JW, Zhang HL, Jiang LS, et al. The study on the synthesis of 1,3-propanediol. Sci Technol Chem, 2002,10(6): 43−47.
冯婧微, 张洪林, 蒋林时, 等. 1,3-丙二醇合成方法研究.化工科技, 2002, 10(6): 43−47.
[4] Liu YJ, Zhao QG, Jiang W, et al. The productive and technical analysis of 1,3-Propandiol. Chem Eng, 2002,88(1): 45−52.
刘艳杰, 赵庆国, 蒋巍, 等. 1,3-丙二醇的生产技术分析.化学工程师, 2002, 88(1): 45−52.
[5] Xu YZ, Ou XJ, Guo NN, et al. Utilization of high value-added products based on crude glycerol from biodiesel process. Process Eng, 2008, 8(4): 695−702.
许赟珍, 欧先金, 郭妮妮, 等. 生物柴油副产物甘油的高附加值利用. 过程工程学报, 2008, 8(4): 695−702.
[6] Summerfield FW, Tappel AL. Cross-linking of DNA in liver and testes of rats fed 1,3-propanediol. Chem Biol Inter, 1984, 50(1): 87−96.
[7] Kurian JV. A new polymer platform for the future-sorona®from corn derived 1,3-propanediol. J Polym Environ,2005, 13(2): 159−167.
[8] Huang H, Gong CS, Tsao GT. Production of 1,3-propanediol by Klebsiella pneumoniae. Appl Biochem Biotech, 2002, 98: 687−698.
[9] Hari Babu S, Robert John U, John RB. Proeess for the purification of l,3-propanediol: US, 6235948. 2001-05-22.
[10] Malinowski JJ. Reactive extraction for downstream separation of 1,3-propanediol. Biotechnol Progr, 2000,16(1): 76−79.
[11] Homann T, Tag C, Biebl H, et al. Fermentation of glycerol to 1,3-propanediol by Klebsiella and Citrobacter strains.Appl Microbiol Biotechnol, 1990, 33(2): 121−126.
[12] Li SG, Tuan VA, Falconer JL, et al. Separation of 1,3-propanediol from aqueous solutions using pervaporation through an X-type zeolite membrane. Ind Eng Chem Res, 2001, 40(8): 1952−1959.
[13] Hao J, Xu F, Liu DH, et al. Downstream processing of 1,3-propanediol fermentation broth. Chem Technol Biotechnol, 2006, 81(1): 102−108.http://dx.doi.org/10.10 02/jctb.1369.
[14] Li FF, Zhou YJ, Liu DH. Flocculation of fermented broth with 1,3−propanediol. Microbiol China, 2004, 31(3): 30−35.
李凡锋, 周玉杰, 刘德华. 1,3-丙二醇发酵液的絮凝预处理研究. 微生物学通报, 2004, 31(3): 30−35.
[15] Lu SF, Zhang DJ, Xiu ZL. Flocculation of 1,3-PD fermentation broth and reuse of cell in flocs. Food Fermentation Industries, 2006, 32(9): 10−13.
鲁诗锋, 张代佳, 修志龙. 1,3-丙二醇发酵液的絮凝处理及絮凝细胞的再利用. 食品与发酵工业, 2006, 32(9):10−13.
[16] Xiu ZL, Zhang DJ, Gao SJ, et al. Extraction and separation of downstream of 1,3-propanedid from fermentation broths: CN, 3133584. 2003-12-10.
修志龙, 张代佳, 高素军, 等. 微生物发酵液中提取分离1,3-丙二醇的方法: 中国专利, 03133584. 2003-12-10.
[17] Lu SF. Downstream processing of 1,3-propanediol from fermentation broths[D]. Dalian: Dalian University of Technology, 2006.
鲁诗锋. 发酵液中 1,3-丙二醇的分离提取工艺的研究[D]. 大连: 大连理工大学, 2006.
[18] Wang J, Xu HB, Zhang SP, et al. Experimental investigation on separation of potassium chromate from its aqueous solution by solventing-out crystallization. Process Eng, 2007, 7(2): 246−251.王烔, 徐红彬, 张颂培, 等. 溶析结晶法分离铬酸钾.过程工程学报, 2007, 7(2): 246−251.
[19] Gong Y, Tong Y, Wang XL, et al. The possibility of the desalination of actual 1,3-propanediol fermentation broth by electrodialysis. Desalination, 2004, 161(2): 169−178.
[20] Hao J, Liu DH. Desalination of fermented broth containing 1,3-propanediol by electrodialysis. J Process Eng, 2005, 5(1): 36−39.
郝健, 刘德华. 1,3-丙二醇发酵液电渗析法脱盐. 过程工程学报, 2005, 5(1): 36−39.
[21] Wu RC, Ren HJ, Xu YZ, et al. The final recover of salt from 1,3-propanadiol fermentation broth. Sep Purif Technol, 2010, 73(2): 122−125.
[22] Hermann BG, Patel M. Today’s and tomorrow’s bio-based bulk chemicals from white biotechnology: a techno-econ omic analysis. Appl Biochem Biotechnol, 2007, 136(3):361−388.http://dx.doi.org/10.1007/s120 10-007-9031-9.
[23] Zhou P, Fang YJ. Progress of purifying 1,3-propanediol from dilute fermentation broth. J Chem Bioeng, 2005, 22(2): 4−6.
周鹏, 方云进. 发酵液中低浓度 1,3-丙二醇浓缩提纯工艺研究进展. 化学与生物工程, 2005, 22(2): 4−6.
[24] Norbert B, Georg D, Hanswilhelm B. Process for purifying 1,3-propanediol: US, 5008473. 1991-04-16.
[25] Cho MH, Joen SI, Pyo SH, et al. A novel separation and purification process for 1,3-propanediol. Process Biochem, 2006, 41(3): 739−744.
[26] Malinowski JJ. Evaluation of liquid extraction potentials for downstream separation of 1,3-propanediol. Biotechnol Tech, 1999, 13(2): 127−130.
[27] Baniel AM, Jansen RP, Vitner A, et al. Process for producing 1, 3-propanediol: US, 0222153. 2004-11-11.
[28] Xiang BT, Chen SF, Liu DH. Extraction of 1,3-propanediol in dilute fermentation broth. J TsinghuaUniversity: Sci Technol, 2001, 41(12): 53−55.
向波涛, 陈书锋, 刘德华. 发酵液中 1,3-丙二醇的萃取分离. 清华大学学报: 自然科学版, 2001, 41(12): 53−55.
[29] Broekhuis RR, Lynn S, King CJ. Recovery of propylene glycol from dilute aqueous solutions via reversible reaction with aldehydes. Ind Eng Chem Res, 1994, 33(12):3230−3237.
[30] Broekhuis RR, Lynn S, King CJ. Recovery of propylene glycol from dilute aqueous solutions by complexation with organoboronates in ion-pair extractants. Ind Eng Chem Res, 1996, 35(4): 1206−1214.
[31] Malinowski JJ. Reactive extraction for downstream separation of 1,3-propanediol. Biotechol Prog, 2000, 16(1):76−79.
[32] Xu ZH, Xia RH, Cao Q, et al. A new method of eliminating trace aldehyde group in 1,3-propanediol: CN,1345710. 2003-10-22.
徐泽辉, 夏蓉晖, 曹强, 等. 一种去除 1,3-丙二醇中微量残余醛基物质的方法: 中国专利, 1345710. 2003-10-22.
[33] Li ZG, Jiang B, Zhang DJ, et al. Aqueous two-phase extraction of 1,3-propanediol from glycerol-based fermentation broths.Sep Purif Technol, 2009, 66(3): 472−478.
[34] Gunzel B, Berke CH, Ernst S. Adsorption von diolenaus fermentation smedien an hydrophobe zeolithe. Chem Ing Tech, 1990, 62(9): 748−750.
[35] Schlieker H, Gunzel B, Deckwer WD. Einsatz der adsorption zur produrt tabt rennung beider glycerinvergarung zu 1,3-propanediol. Chem Ing Tech,1992, 64(8): 727−728.
[36] Schoellner R, Elnicke WD, Unverricht S. Investigation of adsorptive separation of glycerol/1,3-propanediol in aqueous solution on zeolites by liquid phase adsorption. J Prakt Chem, 1994, 33(5): 404−407.
[37] Li SG, Tuan VA, Falconer JL, et al. Separation of 1,3-propanediol form glycerol and glucose using a ZSM-5 zeolite membrane. Membrane Sci, 2001, 191: 53−59.
[38] Li SG, Tuan VA, Falconer JL, et al. X-type zeolite membranes: preparation, characterization, pervaporation performance. Micropor Mesopor Mat, 2002, 53(1/3):59−70.
[39] Ahmad KH, Thomas PB. Method of recovering 1,3-propanediol from fermentation broth: US, 6479716.2002-11-12.
Progress in down-stream processing of biologically produced 1,3-propanediol
Ruchun Wu1,2, Yunzhen Xu1, and Dehua Liu1
1 Institute of Applied Chemistry, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China
2 Key Laboratory of Chemical and Biological Transforming Process, College of Chemistry and Ecological Engineering, Guangxi University for Nationalities, Nanning 530006, China
Received: November 21, 2010; Accepted: January 12, 2011
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2006AA020103).Corresponding author: Dehua Liu. Tel: +86-10-62782654; E-mail: dhliu@tsinghua.edu.cn
国家高技术研究发展计划 (863计划) (No. 2008AA05Z302) 资助。
