不同途径移植骨髓间充质干细胞对脊髓损伤修复效果研究
2011-08-11范东艳鲁质成
范东艳, 王 苹, 刘 然, 鲁质成
干细胞作为种子细胞是再生医学研究领域最重要和最基本的环节。理想的种子细胞应该具有取材方便、对机体损伤小、体外增殖传代能力强、易定向分化、生物毒性低、无致瘤性等特点。近年来研究发现[1~3],骨髓间充质干细胞(BMSCs)具有与胚胎干细胞相似特性,可塑性强,易被诱导分化;强化骨髓间充质干细胞机能可增强对实质细胞功能表达调控,保持其长期稳定性,还可以补充替代坏死的实质细胞甚至可使少数变异细胞正常化。BMSCs移植治疗脊髓损伤(SCI)已受到了广泛关注,BMSCs移植进入体内后,可通过血脑屏障到达损伤部位,通过替代损伤神经元、填充缺损部位、分泌营养因子、调节自身免疫等过程实现保护和促进神经元功能恢修[4,5]。目前研究显示[6],BMSCs 可以通过多种途径移植进入体内,无论通过哪种途径移植BMSCs到宿主体内均可不同程度发挥作用,但是通过哪条途径移植BMSCs对SCI修复效果更好尚未见报道。故本实验通过分别从损伤部位和腰骶鞘内两条途径移植BMSCs,探讨不同途径移植BMSCs治疗SCI的疗效。
1 材料与方法
1.1 主要试剂和仪器 实验动物:清洁级20g Wister大鼠、180gWister大鼠,购自吉林大学实验动物中心。细胞培养试剂:吉林大学医学院动物中心。细胞培养试剂:PMEM/F12和小牛血清购自Gibco公司;HE染液(I nvitrogen公司)、微型打磨机(Invitrogen公司)、CO2培养箱(日本SANYO)、切片机(SHANDONAS620)、倒置相差显微镜 (Olympus)、Fluview 1000激光扫描共聚焦显微镜(Olympus)。
1.2 BMSCs分离培养 无菌条件下取重20g Wister大鼠双侧股骨、胫骨、肱骨,两端剪开,用装有DMEM/F12的无菌注射器冲洗骨髓入30ml离心管;1000r/min离心5min;将细胞团轻柔打散并以1×106个/ml细胞接种于完全培养液内,完全培养液为DMEM/F12培养基+15%胎牛血清+100U/ml青霉素和100U/ml链霉素;将细胞培养于37℃ 5%CO2饱和湿度培养箱内。
培养72h更换培养液,以后每3d换液1次。细胞长到80%融合时用0.25%的胰酶消化传代,以1×106个/ml的密度接种于传代培养瓶中进行扩增培养。采用及时、反复传代对细胞进行纯化。
1.3 动物模型制备 本实验中采用了脊椎骨破坏技术的改进方法:将Wistar大鼠伏卧固定在手术台上;以大鼠第10胸椎为中心,无菌条件下暴露T10棘突并暴露出棘突及两侧椎板;暴露脊髓背侧硬膜,显微镜下切开硬脊膜,借助脑膜镊和虹膜刀等器械,以脊髓后动脉(半横断)及中央管(背侧半横断)为界,在脊髓正中向一侧横行切开,切断脊髓达中央导水管,即可切断半侧脊髓,局部脊髓表面呈暗红色,并适度捣毁局部脊髓组织。经制模效果评价后即可缝合硬脊膜、肌肉及皮肤。表面外敷青霉素20万U粉末。术后每天行人工挤压膀胱排尿2次,直至大鼠恢复自主排尿。
1.4 实验分组 实验分为4组,模型组,SCI模型大鼠6只;损伤局部移植BMSCs组,模型大鼠6只损伤局部微注射细胞5μl(5×107cells);腰骶鞘内移植BMSCs组,模型大鼠6只腰骶鞘内微注射5μl(5×107cells);阴性对照组正常大鼠5只。
1.5 行为学评分标准 分别于细胞移植后的1、2、3w对各组动物进行BBB评分。
1.6 HE染色 将组织取材后制成冰冻切片贴至玻片上,备用。苏木素染液5min;冲洗3min;分化液分化10s;自来水冲洗3mins;返蓝液返蓝5min;冲洗3min;伊红液5min;冲洗3min;梯度乙醇脱水,各1min;二甲苯透明3次,各1min;中性树胶封片,晾干后观察。
1.7 统计学处理 使用 Sigma Stat2.03软件进行统计学分析。所有数据来自5次独立的实验,以表示,统计学处理采用单因素方差分析,q检验,P<0.05认为差异有意义。
2 结果
2.1 行为学观察及运动评价 正常大鼠术前四肢活动自如,BBB评分均可达21分。脊髓横断后,双后肢立即完全瘫痪,术后BBB评分为0分。细胞移植术后1w,各组大鼠后肢功能恢复均不理想,组间的 BBB评分差异无统计学意义(P>0.05);术后2、3周w细胞移植组与其他两组比较均有明显的差异,有统计学意义(P<0.05)见表1。
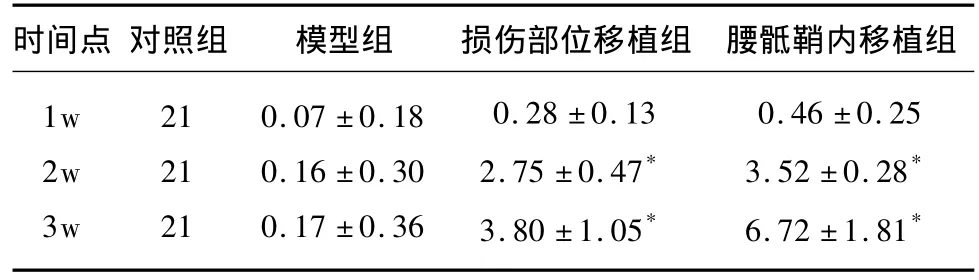
表1 各组不同时间点大鼠BBB后肢运动评分
2.2 形态学观察 损伤后14d大鼠脊髓标本切片苏木精-伊红染色均可见脊髓损伤区组织坏死,细胞肿胀,结构不清,7d以后伤处形成囊腔及胶质瘫痕。损伤区细胞内可见到细胞核固缩、碎裂、溶解,胞浆红染及空泡性(见图1)。
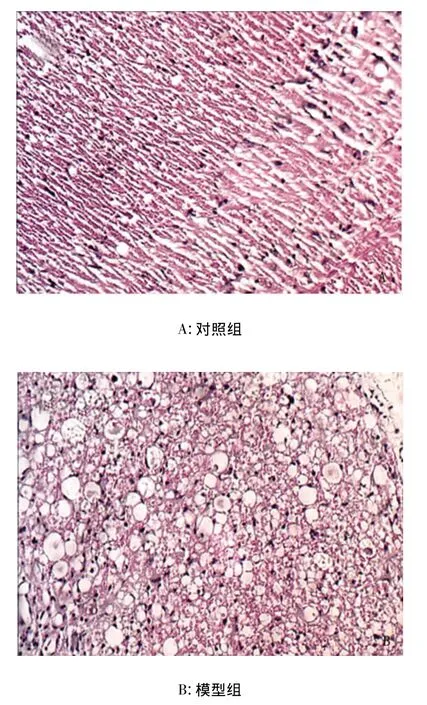
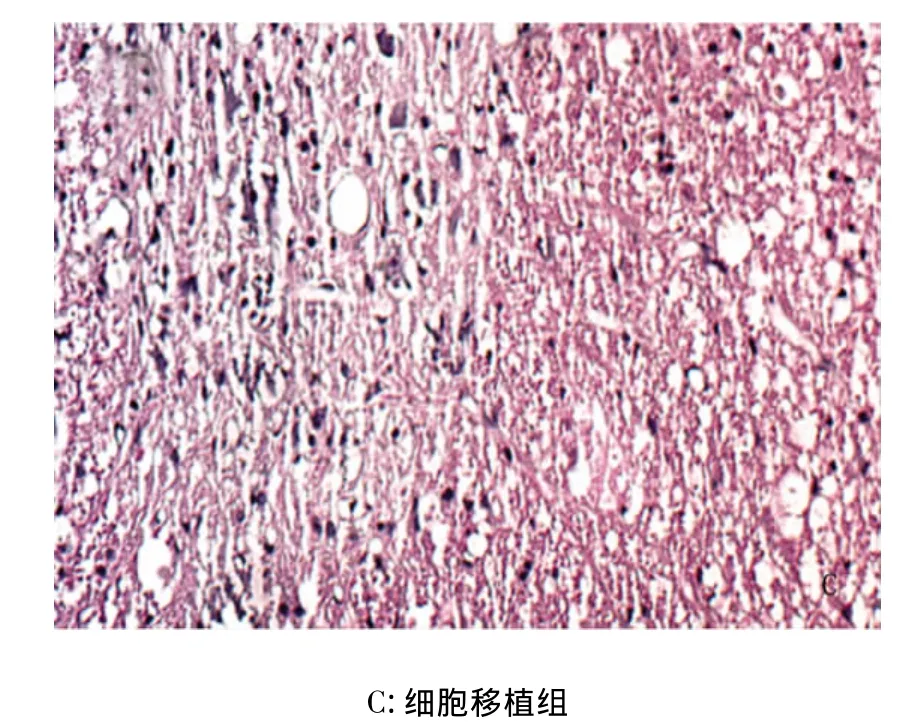
图1 HE染色(×200)
2.3 不同细胞移植途径对脊髓损伤修复的影响 局部细胞移植脊髓变性较重,轴突数目较少,微囊数目较多,而经腰骶鞘内移植组脊髓变性较模型组轻,轴突数目较多,微囊数目较少,远侧细胞移植组,脊髓损伤程度与局部移植组相比明显减轻。可见神经纤维和血管增生、修复更明显(见图2)。
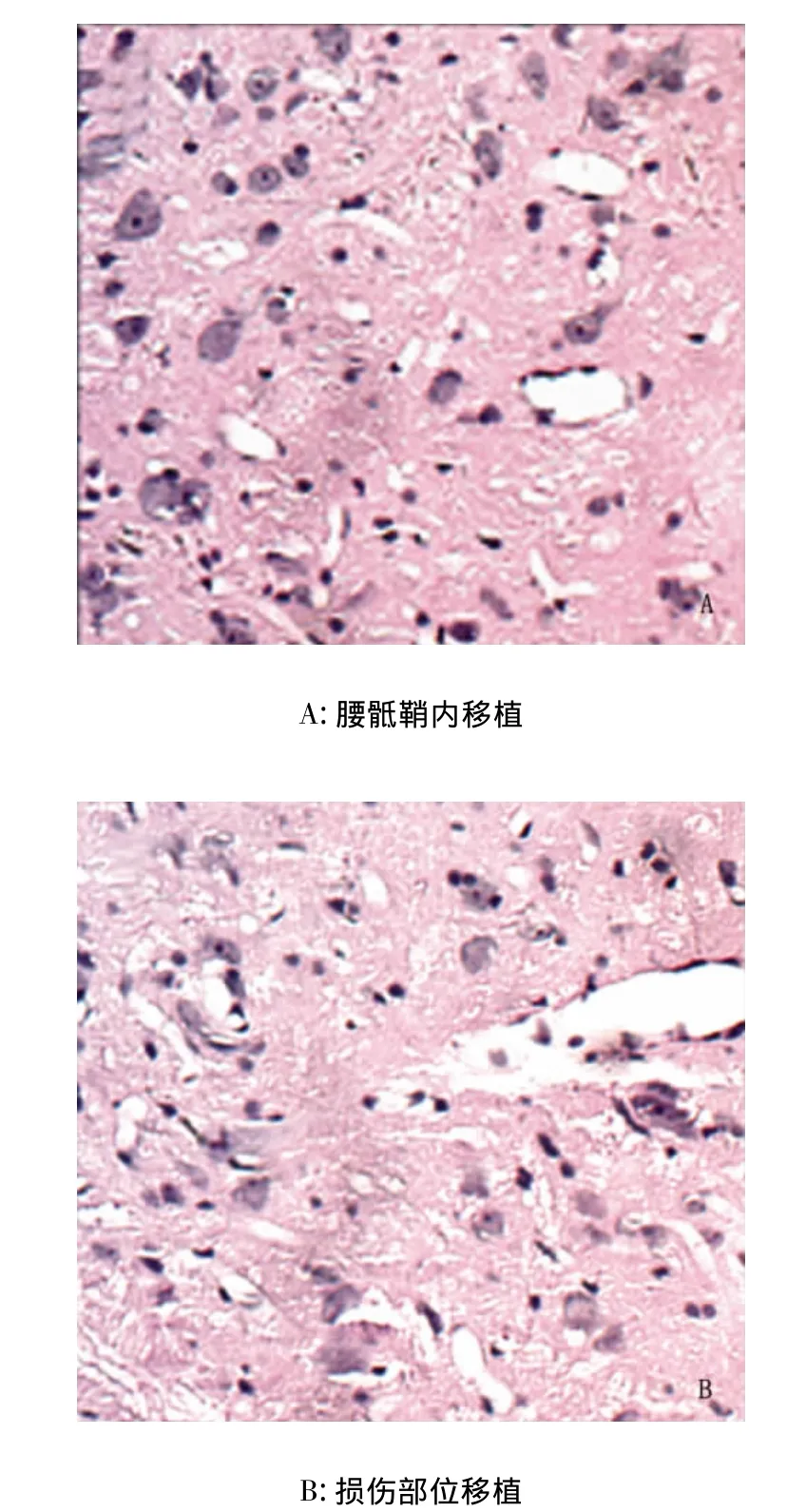
图2 HE染色结果(×200)
3 讨论
脊髓组织损伤后功能的恢复与重建极其困难,主要的原因归咎于不断加重的继发性损害及神经元受损后难以自我修复[7~10]。BMSCs具有多向分化潜能且有较强的可塑性,是当前研究神经损伤细胞移植治疗的主要种子细胞之一。BMSCs在体内的迁移、定居、分化受多种因素的影响,宿主体内特有的微环境及其分泌的某些因子可能是促使BMSCs定居、分化的重要因素[11,12]。BMSCs移植到宿主体内后,不但可以挽救残存的神经元,还可以替代神经元细胞发挥传导功能的作用。BMSCs还可分泌多种神经营养因子,促进神经元再生保护残存的神经元[13,14]。BMSCs治疗 SCI的机制尚不清楚,但疗效已得到了普遍的认同,目前BMSCs治疗SCI可通过多种途径移植进入宿主体内,究竟是哪种途径能取得最佳的治疗效果尚没有统一的认识,为了取得更好治疗效果,了解不同移植途径的治疗效果是非常必要的。
3.1 BMSCs移植治疗可早期出现运动功能恢复 迄今为止,脊髓中枢神经损伤导致功能障碍等治疗,最好的办法似乎是集中的物理疗法。运动训练的目的是尽量减少功能障碍,最大限度恢复运动功能。认为其机制是神经可塑性发生了变化。然而,得出的结果很有限,获得的功能往往很小,脊髓损伤的康复疗法仍不能令人满意。SCI的病理生理机制极其复杂,若要对其进行深入的研究就要建立一个标准化的、可重复的、与临床接近的、可调控的SCI动物模型。我们在研究中考虑到SCI后可塑性、神经再生、移植等基础研究,所以采用了脊髓半横断伤模型制作技术,成功造模标志为大鼠一侧躯体及下肢痉挛性抽搐后瘫痪。在造模的过程中对脊椎骨破坏的技术方法进行了适当的改进,结果显示,模型动物瘫痪率为100%。
运动功能的评价是衡量SCI治疗效果的最有力标准。运动功能的评价方法也有很多种,例如BBB评分法、斜板实验、联合评分法及Tarlov评分法等。我们在实验中采用了BBB评分法,该方法操作简单,无需特殊设备,可较好的反映SCI严重程度和恢复程度。实验结果显示,细胞移植术后1周,各组大鼠后肢功能恢复均不理想,组间的BBB评分差异无统计学意义(P>0.05);术后2,3w细胞移植组与其他各组比较均有明显的差异,有统计学意义(P<0.05),提示BMSCs移植治疗SCI后,运动功能的恢复随时间的延长而增强。组织结构的形态学评价结果显示,模型组的组织形态主要呈结缔组织样结构,且有大量的空泡;细胞移植组,可见散在的核蓝染细胞,组织内空泡数量明显少于模型组。提示BMSCs可以填充组织缺损并定居于损伤部位。
3.2 不同移植途径的效果分析 脊髓损伤处定位细胞移植可能会给局部带来再次损伤的危险,故目前应用BMSCs细胞移植修复脊髓损伤多采用远端移植法[15,16],因此远处 BMSCs 移植,细胞对损伤部位的修复效果就成为研究热点。许多研究已经表明[17~19],BMSCs具有定向迁移到某些特定组织的能力,特别是在这些组织发生损伤之后。2003年,有学者[20]将标记的BMSCs采用注射方法直接移植到小鼠心肌内,移植后1w发现供体BMSCs存在的新生血管出现在注射部位。
本实验采用损伤部位移植和腰骶鞘内移植两种方法移植BMSCs,探讨不同途径移植 BMSCs治疗SCI的疗效。结果显示,腰骶鞘内移植后,运动功能的恢复均较局部移植的效果好。考虑可能因为局部移植是在原有损伤区域内进行细移植,在某种程度上加重了原有的损伤,导致组织修复延缓;而腰骶鞘内移植是在损伤的区域外进行,所以不会加重原损伤或延缓组织的修复过程。
形态学研究结果显示,腰骶鞘内移植组较局部细胞移植组脊髓变性轻、轴突数目多、微囊数目少,可见神经纤维和血管增生、修复更明显。结合运动功能评价结果提示,通过腰骶鞘内移植BMSCs疗效好于经损伤部位直接移植细胞。虽然BMSCs治疗脊髓损伤还存在许多未解之谜,随着研究的逐步深入,BMSCs的特性将进一步阐明,BMSCs治疗神经系统疾病的前景将更加广阔。
[1]张增山,文益民,韩 夏,等.骨髓间充质干细胞移植治疗成鼠脊髓损伤的研究[J].西北国防医学杂志,2010,31(4):241-243.
[2]吴宗辉,贾功伟,虞乐华.骨髓间充质干细胞治疗脊髓损伤的研究进展[J].细胞与分子免疫学杂志,2010,26(10):1057.
[3]Park IH,Zhao R,West JA,et al.Reprogramming of human somatic cells to pluripotency with defined factors[J].Nature,2008,451(7175):141-146.
[4]Blits B,Bunge MB.Direct gene therapy for repair of the spinal cord[J].J Neurotrauma,2006,23(3-4):508-520.
[5]李志营,步星耀,张圣旭,等.自体骨髓干细胞动员移植与手术移植治疗脊髓损伤的实验研究[J].中华临床医师杂志,2010,4(9):1587-1594.
[6]Chamberlain G,Fox J,Ashton B,et al.Concise review:mesenchymal stem cells:their phenotype,differentiation capacity immunological features,and potential for homing[J].Stem Cells,2007,25(11):2739-2749.
[7]Meuleman N,Tondreau T,Deforge A,et al.Human marrowmesenchymal stem cell culture serum-free medium allows better expfansion than classical alpha-MEM medium[J].Eur J Haematol,2006,76(4):309-316.
[8]Bonner JF,Blesch A,Neuhuber B,et al,Promoting directional axon growth from neural progenitors grafted into the injured spinal cord[J].J Neurosci Res,2010,88(6):1182-92.
[9]Liu S,Xu GY,Johnson KM,et al.Regulation of interleukin-1 beta by the interleukin-1 receptor antagonist in the glutamate-injured spinal cord:endogenous neuroprotection[J].Brain Res,2008,22(1231):63-74.
[10]Ferguson AR,Christensen RN,Gensel JC,et al.Cell death after spinal cord injury is exacerbated by rapid TNF-α-induced trafficking of GluR2-lacking AMPARs to the plasma membrane[J].J Neurosci,2008,28(44):11391-400.
[11]Tsuchiyama T,Nakamoto Y,Sakai Y,et al.Optimal amount of MCP-1enhances antitumor effects of suicide gene therapy against hepatocellular carcinoma by M1 mcrophage activation[J].Cancer Sci,2008,99(10):2075-2082.
[12]Tsai MC,Shen LF,Kuo HS,et al.Involvement of acidic firbroblast growth factors in spinal cord injury repair processes revealed by a proteomics approath[J].Mol cell Proteomics,2008,7(9):1668-1687.
[13]Okutan O,Solaroglu I,Beskonakli E,et al.Recombinant human erythropoietin decrease MPO and caspase-3 activity and improves early functional results after spinal cord injury in rats[J].J Clin Neurosci,2007,14(4):364-368.
[14]Nakamura S,Yamada Y,Baba S,et al.Culture medium study of human mesenchymal stem cells for practical use of tissue engineering and regenerative medicine[J].Biomed Mater Eng,2008,18(3):129-136.
[15]Hematti P.Role of mesenchymal stromal cells in solid organ transplantation[J].Transplant Rev,2008,22(4):262-273.
[16]Bareeyre FM.Neuronal repair and replacement in spinal cord injury[J].Neuro Sci,2008,(265):63-72.
[17]Imai M,Watanabe IM,Suyama K,et al.Delayed accumulation of activated macrophages and inhibition of remyelination after spinal cord injury in an adult rodent model[J].Neurosurg spine,2008,8(1):58-66.
[18]Chen WF,Sung CS,Jean YH,et al.Suppressive effects of intrathecal granulocyte colony-stimulating factor on excessive release of excitatory amino acids in the spinal cerebrospinal fluid of rats with cord ischemia:role of glutamate transporters[J].Neuroscience,2009,162(3):101-110.
[19]Elizabete Sant Anna da Costa,Antonia Lima Carvalho,Ana Maria Blanco Martinez,et al.Strapping the spinal cord:An innovative experimental model of CNS injury in rats[J].Journal of Neuroscience Methods,2008,170(1):130-139.
[20]Li XH,Yu XY,Lin QX,et al.Bone marrow mesenchymal stem cellsdiferentiate into functional cardiac phenotypes by cardiac microenvironment[J].J Mol Cell Cardiol,2006,54(8):3254-3266.
