木质素次生代谢工程的研究概况和进展
2011-08-05胡永胜陈万生第二军医大学长征医院药学部上海0003第二军医大学生药学教研室上海00433第二军医大学现代中药研究中心上海00433解放军第118医院药械科浙江温州35000
胡永胜,肖 莹,邸 鹏,张 磊,陈万生(1.第二军医大学长征医院药学部,上海 0003;.第二军医大学生药学教研室,上海 00433;3.第二军医大学现代中药研究中心,上海 00433;4.解放军第118医院药械科,浙江 温州 35000)
木质素(lignin)是一种由肉桂醇等单体聚合而成的酚类多聚体,是维管植物细胞壁的重要组成成分[1,2]。木质素与半纤维素以共价键结合,具有加固细胞壁的机械强度,增强植物的抗倒伏性,提高植物细胞运输能力以及抵御病原菌微生物侵害的生物学功能[3]。木质素在造纸业制浆、饲料易消化性、植物燃料等方面有着广泛的研究需求,急需解决的难题是,如何减少植物中木质素的含量或者改变其种类使之容易降解。在过去的二十年间,越来越多的研究基于调控木质素单体次生代谢通路中某个基因的表达,来改变木质素的含量与组成,以及改良植物的应用特性。本文对近年来在木质素次生代谢工程方面的新概念、新趋势,以及木质素研究中的系统生物学做一简要综述。
1 木质素结构及生源合成途径
木质素是一类组成和结构十分复杂的高分子量肉桂醇脱氢聚合物,其单体主要有对-香豆醇(ρcoumaryl alcohol)、松柏醇(coniferyl alcohol)与芥子醇(sinapyl alcohol)[1]。裸子植物中木质素主要为愈创木基木质素(guaiacyl lignin,简称G型),由松柏醇聚合而成,而被子植物木质素主要为G型和紫丁香基木质素(syringyl lignin,简称S型),分别由对-香豆醇和芥子醇聚合而成。单子叶植物中木质素除了 G型和 S型外,还有对-羟基苯基木质素(hydroxyphenyl lignin,简称 H型),由对-香豆醇聚合而成。
植物中木质素单体的生源合成途径已经探明(图 1)[4,5],木质素合成以苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)催化苯丙氨酸脱氨形成肉桂酸起始,再经肉桂酸-4-羟基化酶(cinnamic acid 4-hydroxylase,C4H)催化生成对香豆酸,4-香豆酸:辅酶A连接酶(4-coumarate coenzyme A ligase,4CL)催化对香豆酸生成对香豆酰辅酶A,在莽草酸/奎宁酸羟基肉桂酰转移酶(ρ-hydroxycinnamoyl-CoA:quinate shikimate ρ-hydroxycinnamoyl-transferase,HCT)与香豆酸-3-羟基化酶(Coumarate 3-hydroxylase,C3H)的催化下生成咖啡酰辅酶A,在咖啡酰辅酶A氧甲基转移酶(Caffeoyl-CoA O-methyltransferase,CCoAOMT)咖啡酸氧甲基转移酶(Caffeic acid/5-hydroxyconiferaldehyde O-methyltransferase,COMT)催化下发生甲基化,及在阿魏酸-5-羟基化酶(Ferulate-5-hydroxylase,F5H)催化下羟基化,经肉桂酰辅酶A还原酶(Cinnamoyl-CoA reductase,CCR)催化还原成相应的肉桂醛,最终经肉桂醇脱氢酶(Cinnamyl alcohol dehydrogenase,CAD)还原为3种肉桂醇,它们分别是对-香豆醇(ρ-Coumaryl alcohol)、松柏醇(Coniferyl alcohol))和芥子醇(Sinapyl alcohol)。然后三种木质素单体在某种机制下转运至细胞壁,在过氧化酶(Peroxidase)和漆酶(Laccase)的作用下脱氢聚合成木质素。研究表明,H/G/S型木质素的含量可以被调控。HCT、C3H低表达会使在天然木质素占较小比例的H型木质素增多[6,7];F5H低表达则会使木质素主要为G型,高表达主要S型;COMT低表达会减少S型木质素的比例,同时使木质素中5-羟基松柏醇的含量增多;CAD的低表达会使天然木质素中肉桂醛的含量增多[1,8];这些都佐证了木质素单体的生源合成途径。
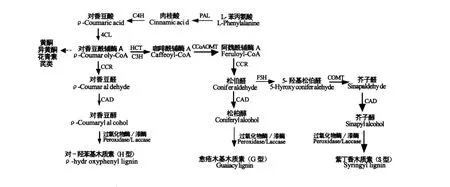
图1 木质素的生源合成途径
2 相关酶基因的研究进展
2.1 苯丙氨酸解氨酶(PAL)是木质素单体生源合成中的第一个关键酶,催化苯丙氨酸脱氨生成肉桂酸,是木质素单体化合物生源合成途径的起始,是整个苯丙烷类代谢途径中的关键酶和限速酶[9]。植物中PAL一般认为属于多基因家族,至少有3到4个亚型[10]。PAL参与植物应激与防御生理,是最早被鉴定的植物防御性基因之一,受病原和环境胁迫等因素诱导表达[11]。
2.2 肉桂酸-4-羟基化酶(C4H)属于细胞色素单加氧酶P450超家族,是公共苯丙烷途径中的第二个关键酶,催化反式肉桂酸转变为ρ-羟基肉桂酸。利用反义技术将C4H酶活性抑制后,转基因植物的木质素含量明显减少,调控该基因的表达还可以改变木质素的构成。通过上调C4H的表达,促进木质素、防卫性植保素的合成,可以增强植物的抗病性、抗逆性和抗倒伏性。C4H处于木质素整个代谢途径的较上游,与PAL、4CL 2个酶组成苯丙烷类代谢公共途径,是调控木质素生源合成的重要酶基因。
2.3 4-香豆酸 辅酶A连接酶(4CL)是苯丙烷代谢途径的最后一个酶,在苯丙烷代谢途径中处于终端位置,催化4-香豆酸生成4-香豆酰辅酶A,后者是多个代谢途径的重要前体,继而合成植物体内重要的多种天然产物,如黄酮、类黄酮、木质素、色素、芪类以及其它酚酸类化合物[12]。这些次生代谢产物在植物体内起着重要的作用,如黄酮是防止紫外对植物的损伤,或者作为花粉发育和植物与微生物相互作用的信号分子;芪类可以保护植物细胞抗病虫侵袭;木质素是具有多种药理活性的物质,具有重要的药用价值。已有开展4CL转基因的报道,如利用反义技术抑制了杨树中4CL酶的活性,使转基因杨树木质素含量降低50%,纤维素提高了15%,而木质素的成分和纤维素的形态没有变化[13]。
2.4 莽草酸/奎宁酸羟基肉桂酰转移酶(HCT)、香豆酸-3-羟基化酶(C3H)共同作用下将底物4-香豆酰辅酶A酯的3位羟基化。HCT与C3H的作用有协同效应,HCT属于转移酶系,催化莽草酸/奎宁酸与4-香豆酰辅酶A酯发生转移置换,其产物为香豆酰奎宁酸和香豆酰莽草酸。C3H属于P450氧化酶系,CYP98A3基因编码C3H,实验证明C3H对香豆酰奎宁酸和香豆酰莽草酸表现出很高的催化活性[14]。以后又从火炬松(AAV36 223.1)、落叶松(ACA35 323.1)中分离得到C3H。
2.5 肉桂酰辅酶A还原酶(CCR)是木质素特异合成途径的第一个关键酶,可催化3种羟基肉桂酸的辅酶A酯的还原成相应的肉桂醛。苯丙烷公共途径可以产生黄酮、类黄酮、原花青素、木质素等次生代谢产物,CCR催化生成木质素特异合成途径是一个分支途径,CCR可能对木质素合成途径的碳流具有潜在的调控作用,对木质素单体的生源合成起着重要作用。
2.6 肉桂醇脱氢酶(CAD)催化肉桂醛生成肉桂醇,处于对-香豆醇、松柏醇和芥子醇生源合成最终位置,是木质素单体生源合成途径的关键酶基因。已经从多种植物中分离得到肉桂醇脱氢酶基因,例如欧洲云杉(AJ868 574)、蓝桉(AF038 561)、黑麦草(AJ585 090)、柳叶桉(AF294 793)、草莓(U63 534)、美洲山杨(AF217 957)、甘蔗(AJ231 135)和紫花苜蓿(Z19 573)。
2.7 咖啡酸氧甲基转移酶(COMT)、咖啡酰辅酶A氧甲基转移酶(CCoAOMT)都是底物甲基化酶,木质素单体生源合成需经3'和5'位置的两步甲基化反应,COMT与CCoAOMT是两个不同底物水平上的甲基化酶,与木质素单体的特异合成有关。COMT催化S型木质素单体合成,是S型木质素单体合成的重要的调控基因[15]。CCoAOMT则是催化G型木质素单体合成,是G型木质素单体合成的重要调控基因[3]。COMT与CCoAOMT基因调控在S/G型木质素比例的基因调控中具有重要的意义。
2.8 阿魏酸-5-羟基化酶(F5H)隶属于细胞色素P450酶系,催化阿魏酸5位羟基化。研究表明,缺乏F5H活性的拟南芥fah1突变体重几乎全部为G型木质素;相应地,过量表达F5H的转基因拟南芥、烟草和杨树中S型木质素的含量显著增加,G型木质素相对减少[16,17]。可以推测,F5H 是 G 型与S型木质素的生源合成途径上重要的导向性调控基因。
2.9 过氧化酶、漆酶可以有效地催化木质素单体脱氢聚合形成木质素。最初证明漆酶在有氧条件下能够催化产生木质素,以后又发现过氧化酶也可有效催化木质素的聚合反应。
3 木质素系统生物学研究
对木质素突变体的转录水平及代谢特征的研究表明,木质素生源合成途径中任何一个基因的表达改变都会对植物的次生代谢产生深远的影响。
首先,木质素次生代谢通路中某个基因的表达下调,或多或少地会影响到该基因家族中的基因或是木质素代谢通路中的相关基因的表达[18,19]。整个代谢通路是一个网状结构,局部的改变会影响到整个代谢流的变化。
其次,越来越多的研究表明,木质素的次生代谢与参与植物细胞壁形成的其它多聚物具有重要的联系[20,21]。例如,CCR 低表达的转基因杨树中,与前期的木质素次生代谢研究结论相同,木质素含量减少了;然而通过转录组学及代谢组学分析表明,CCR的低表达也能导致植物细胞中木糖的合成量减少[22]。因此,探究木质素途径中基因的功能多样性与植物细胞壁的形成特性之间的关系,对阐述植物细胞壁的属性及如何改造植物便于农业、工业应用,具有重要的意义。
第三,采用系统生物学方法提示了木质素次生代谢与环境代谢之间的互动性,例如研究植物的正常代谢及在环境胁迫下应激代谢[23]。如CCR低表达的转基因烟草,淀粉代谢及光呼吸作用增强,释放的二氧化碳增多,体内的碳氢化合物消耗增多[24]。深入研究木质素次生代谢工作调控中的植物分子生理学响应,有利用采用基因工程策略(如基因叠加技术)来消除这些不良的应激反应[25]。
第四,对木质素突变体植株的转录水平分析发现了一些新基因,其功能与木质素的次生代谢有重要关联。各种各样的转录谱研究表明,有大量的调控基因参与木质素的次生代谢过程[22,26],但得到确证的基因数量还不多。然而可以确信的是MYB和LIM家族的转录因子对植物中木质素次生代谢途径中基因具有间接的调控作用,是一类重要的调控因子。
4 木质素调控新策略
植物木质素生源合成调控的研究热点在于如何使木质素更易于去除,从而利于造纸业制浆、饲料易消化性、植物燃料等方面的应用。参与木质素合成的酶有许多,常规的调控方法在于获得该途径上的酶基因,随后构建其表达载体,并利用农杆菌介导转入植物体内进行表达,最后采用分析技术监测木质素含量及组成的变化。此类方法的弊端在于植物体内的代谢是一个复杂的过程,单转高表达某个基因的作用可能并不明显。近年来,出现了以转录因子为研究对象的新的调控策略。
木质素生源合成途径中基因的AC因子发现有与玉米MYB相关P蛋白结合位点CCT/AACC。此外,金鱼草的MYB305可以与AC因子结合,因而能激活扁豆PAL2的启动子中AC因子序列,上调PAL2 的表达[27,28]。可以推论,木质素生源合成途径的基因调控中,与AC因子结合的转录因子也是MYB蛋白。对金鱼草中的MYB308蛋白和MYB330蛋白研究表明MYB蛋白参与调控木质素的生源合成[29]。在转基因烟草中过量表达金鱼草MYB蛋白,能够下调木质素途径中的基因的表达和减少木质素的含量,提示金鱼草MYB蛋白可以调控木质素生源合成。此后,从拟南芥[30]中获得许多的MYB蛋白,过量表达这些MYB蛋白也能改变苯丙素的次生代谢途径。Kawaoka等[31]报道转录因子LIM1对木质素的生物合成也具有重要的调控作用,利用反义技术构建的拟南芥植株NtLIM1突变体,发现木质素途径中相关合成酶的转录处于较低的水平,总木质素的含量下降了27%。以转录因子调控可以在代谢途径中的多个位点发挥调控作用,与传统单一位点调控措施相比,具有更好的调控效果。
5 植物木质素的研究展望
近年来伴随植物新能源的研究逐渐深入,木质素日益成为研究重点。木质素的代谢是一个复杂的过程,人们对其代谢通路确证经过多次修正,木质素单体的结构类型也远远不止3种类型。木质素作为植物对抗外界环境胁迫的重要的抗逆物质,在植物的正常发育中具有重要的作用,在对木质素次生代谢工程调控时需要考虑到对植物生理的影响。木质素系统生物学是一个新兴的研究领域,采用系统论的观点,综合考虑了木质素次生代谢各种影响因素,利用传统的基因过量或抑制表达具有一定的局限性,采用RNAi和转录因子调控手段来进行植物木质素次生代谢工程调控将是大势所趋。
[1]Boerjan W,Ralph J,Baucher M.Lignin biosynthesis[J].Annu Rev Plant Biol,2003,54:519.
[2]Ralph J,Lundquist K,Brunow G,et al.Lignins:natural polymers from oxidative coupling of 4-hydroxyphenyl-propanoids[J].Phytochemistry Reviews,2004,3(1):29.
[3]Guo D,Chen F,Inoue K,et al.Downregulation of caffeic acid 3-O-methyltransferase and caffeoyl CoA 3-O-methyltransferase in transgenic alfalfa:impacts on lignin structure and implications for the biosynthesis of G and S lignin[J].The Plant Cell Online,2001,13(1):73.
[4]Bayindir U,Alfermann AW,Fuss E.Hinokinin biosynthesis in Linum corymbulosum Reichenb[J].Plant J,2008,55(5):810.
[5]Vanholme R,Morreel K,Ralph J,et al.Lignin engineering[J].Curr Opin Plant Biol,2008,11(3):278.
[6]Ralph J,Akiyama T,Kim H,et al.Effects of coumarate 3-hydroxylase down-regulation on lignin structure[J].J Biol Chem,2006,281(13):8843.
[7]Wagner A,Ralph J,Akiyama T,et al.Exploring lignification in conifers by silencing hydroxycinnamoyl-CoA:shikimate hydroxycinnamoyltransferase in Pinus radiata[J].Proceedings of the National Academy of Sciences,2007,104(28):11856.
[8]Baucher M,Halpin C,Petit-Conil M,et al.Lignin:genetic engineering and impact on pulping[J].Critical Reviews in Biochemistry and Molecular Biology,2003,38(4):305.
[9]Butland SL,Chow ML,Ellis BE.A diverse family of phenylalanine ammonia-lyase genes expressed in pine trees and cell cultures[J].Plant Mol Biol,1998,37(1):15.
[10]Kumar A,Ellis BE.The phenylalanine ammonia-lyase gene family in raspberry.Structure,expression,and evolution[J].Plant Physiol,2001,127(1):230.
[11]Lee BK,Park MR,Srinivas B,et al.Induction of phenylalanine ammonia-lyase gene expression by paraquat and stress-related hormones in Rehmannia glutinosa[J].Mol Cells,2003,16(1):34.
[12]Ehlting J,Shin JJ,Douglas CJ.Identification of 4-coumarate:coenzyme A ligase(4CL)substrate recognition domains[J].Plant J,2001,27(5):455.
[13]Hu WJ,Harding SA,Lung J,et al.Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees[J].Nat Biotechnol,1999,17(8):808.
[14]Schoch G,Goepfert S,Morant M,et al.CYP98A3 from Arabidopsis thaliana is a 3'-hydroxylase of phenolic esters,a missing link in the phenylpropanoid pathway[J].J Biol Chem,2001,276(39):36566.
[15]Anterola A,Lewis N.Trends in lignin modification:a comprehensive analysis of the effects of genetic manipulations/mutations on lignification and vascular integrity[J].Phytochemistry,2002,61(3):221.
[16]Chen F,Yasuda S,Fukushima K.Evidence for a novel biosynthetic pathway that regulates the ratio of syringyl to guaiacyl residues in lignin in the differentiating xylem of Magnolia kobus DC[J].Planta,1999,207(4):597.
[17]Ruegger M,Meyer K,Cusumano J,et al.Regulation of ferulate-5-hydroxylase expression in Arabidopsis in the context of sinapate ester biosynthesis[J].Plant Physiology,1999,119(1):101.
[18]Dauwe R,Morreel K,Goeminne G,et al.Molecular phenotyping of lignin-modified tobacco reveals associated changes in cellwall metabolism,primary metabolism,stress metabolism and photorespiration[J].Plant Journal,2007,52(2):263.
[19]Wadenback J,von Arnold S,Egertsdotter U,et al.Lignin biosynthesis in transgenic Norway spruce plants harboring an antisense construct for cinnamoyl CoA reductase(CCR)[J].Transgenic Res,2008,17(3):379.
[20]Abdulrazzak N,Pollet B,Ehlting J,et al.A coumaroyl-ester-3-hydroxylase insertion mutant reveals the existence of nonredundant meta-hydroxylation pathways and essential roles for phenolic precursors in cell expansion and plant growth[J].Plant Physiol,2006,140(1):30.
[21]Sibout R,Eudes A,Mouille G,et al.Cinnamyl alcohol dehydrogenase-C and-D are the primary genes involved in lignin biosynthesis in the floral stem of Arabidopsis[J].The Plant Cell Online,2005,17(7):2059.
[22]Leple J,Dauwe R,Morreel K,et al.Downregulation of cinnamoyl-coenzyme A reductase in poplar:multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure[J].The Plant Cell Online,2007,19(11):3669.
[23]Leple JC,Dauwe R,Morreel K,et al.Downregulation of cinnamoyl-coenzyme A reductase in poplar:multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure[J].Plant Cell,2007,19(11):3669.
[24]Rohde A,Morreel K,Ralph J,et al.Molecular phenotyping of the pal1 and pal2 mutants of Arabidopsis thaliana reveals farreaching consequences on phenylpropanoid,amino acid,and carbohydrate metabolism[J].Plant Cell,2004,16(10):2749.
[25]Halpin C,Boerjan W.Stacking transgenes in forest trees[J].Trends Plant Sci,2003,8(8):363.
[26]Koutaniemi S,Warinowski T,K rk nen A,et al.Expression profiling of the lignin biosynthetic pathway in Norway spruce using EST sequencing and real-time RT-PCR[J].Plant Molecular Biology,2007,65(3):311.
[27]Sablowski R,Baulcombe D,Bevan M.Expression of a flowerspecific Myb protein in leaf cells using a viral vector causes ectopic activation of a target promoter[J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(15):6901.
[28]Sablowski R,Moyano E,Culianez-Macia F,et al.A flower-specific Myb protein activates transcription of phenylpropanoid biosynthetic genes[J].The EMBO Journal,1994,13(1):128.
[29]Tamagnone L,Merida A,Parr A,et al.The AmMYB308 and AmMYB330 transcription factors from Antirrhinum regulate phenylpropanoid and lignin biosynthesis in transgenic tobacco[J].The Plant Cell Online,1998,10(2):135.
[30]Borevitz JO,Xia Y,Blount J,et al.Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J].Plant Cell,2000,12(12):2383.
[31]Kawaoka,A,Kaothien P,Yoshida K,et al.Functional analysis of tobacco LIM protein Ntlim1 involved in lignin biosynthesis[J].Plant J,2000.22(4):289.
