拷贝数对毕赤酵母重组菌表达猪胰岛素前体的影响
2011-07-25郭美锦庄英萍张嗣良
陈 丽,郭美锦,储 炬,庄英萍,张嗣良
(华东理工大学 生物反应器工程国家重点实验室 国家生化工程技术研究中心,上海 200237)
胰岛素是体内调节能量代谢和糖代谢的重要激素,是治疗糖尿病的特效药物之一,重组胰岛素已占领了大部分市场份额[1]。甲醇营养型毕赤酵母(Pichiapastoris)是一种优秀的外源蛋白表达系统,具有乙醇氧化酶基因启动子(PAOX)强、外源蛋白表达量高、分离容易、外源基因稳定性高、培养基要求低等特点[2],其高密度发酵工艺日臻成熟。目前,大约有500多种外源蛋白成功地在该系统中得到表达[3]。鉴于酵母直接表达人胰岛素原比较困难,作者采用表达猪胰岛素前体(Porcine insulin precursor,PIP),再通过纯化和体外转肽反应,以转化为医用人胰岛素[4]。
基因剂量(Gene dosage)是重组毕赤酵母表达外源目的蛋白水平高低的重要影响因素之一。根据不同的外源蛋白特性,基因剂量对外源蛋白表达水平既有正的量效关系,也有负的量效关系,且各自影响机理不尽相同[5]。目前用毕赤酵母表达PIP的报道较多停留在菌株的构建和过程控制优化等方面[6,7],而基因剂量方面的研究至今缺乏系统性报道。为此,作者以PIP基因拷贝数分别为1、6、12和18的G1、G6、A2和A3毕赤酵母重组菌为研究对象,通过5 L发酵罐进行补料分批培养,考察PIP基因拷贝数对毕赤酵母重组菌PIP蛋白表达、生理代谢参数、细胞存活率和基因稳定性等的影响。
1 实验
1.1 菌株、培养基和种子制备
毕赤酵母(Pichiapastoris)GS115菌株,Mut+,载体pAO815、pPIC3.5K,蛋白引导序列来自酿酒酵母的α-杂交因子(α-Mating factor,α-MF),外源基因为根据毕赤酵母偏爱密码子人工合成的PIP基因,将含目的基因1、6、12和18拷贝的菌株,分别命名为G1、G6、A2和A3,自行构建[8]。
培养基和种子制备按文献[9]方法进行。
1.2 5 L发酵罐发酵方法
从YPD平板上挑单克隆接种至种子摇瓶培养基中,于30℃、220 r·min-1培养20~24 h,直至OD600达到20左右;按接种量10%接种到装有2 L分批培养基的5 L发酵罐(华东理工大学国家生化工程技术研究中心研制)中培养(用氨水调节pH值为5.0);分批培养至甘油耗尽(20 h左右),此时溶氧值与pH值上升,开始以限制性的速度补加含12 mL·L-1PTM1的50%(质量浓度,下同)甘油以提高菌浓,当OD600达到120左右,停止补加甘油,饥饿工程菌30 min左右,一次性加入2.5 g·L-1甲醇以使菌体适应甲醇环境,大约2 h左右溶氧值先下降后上升,正式进入诱导阶段,开始流加含12 mL·L-1PTM1的100%甲醇,诱导72 h。在诱导过程中通过测定甲醇浓度和溶氧值变化来控制补料速率。
1.3 外源基因拷贝数的测定
酵母总DNA制备采用Bustn′Grab法[10],外源基因定量参照文献[11]。
1.4 目的蛋白PIP浓度的测定
采用外标法进行PIP的定量分析。使用Agilent 1100 HPLC系统,色谱柱为ES industries 公司MacroSep C8,5 μm 300 Å(15 cm×4.60 mm);流动相:溶液A为20%乙腈-0.1%三氟乙酸;溶液B为90%乙腈-0.1%三氟乙酸;洗脱条件:溶液A 在14 min 内由100%降至70%,溶液B在14 min 内由0%升至30%;流速为1 mL·min-1;柱温为40℃;检测波长为214 nm。
1.5 甲醇浓度的测定
采用GC920型气相色谱仪(上海海欣色谱仪器有限公司)分析发酵液上清中甲醇浓度。填料为Chromosorb 101型,色谱柱长1 m、内径2 mm,载气为氮气,流量为15 mL·min-1,空气和H2的流量分别为300 mL·min-1和30 mL·min-1(10∶1),色谱柱温度为100℃,汽化室和氢火焰温度为200℃。
1.6 细胞活性分析
采用流式细胞仪[12,13]进行细胞活性分析。
1.7 尾气分析
采用Extrel过程质谱MAX300-LG(USA)对发酵过程中的进气和尾气进行实时在线采集分析,发酵液单位体积氧代谢速率(Oxygen uptake rate,OUR,mmol·L-1·h-1)和单位体积CO2释放速率(CO2Evolution rate,CER,mmol·L-1·h-1)参照文献[14]计算。
2 结果与讨论
2.1 不同拷贝数毕赤酵母重组菌生长比较(图1)
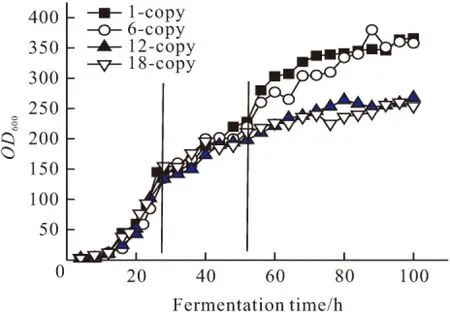
图1 不同拷贝数毕赤酵母流加培养的细胞光密度变化曲线
由图1可知,随着培养时间的延长,不同拷贝数菌株的细胞光密度(OD600)呈不同的变化特征,大致可分为三个阶段:在甘油阶段(0~28 h),不同拷贝数菌株细胞生长无明显差别,且生长均较快,OD600可同时达到140左右;在甲醇诱导初期(诱导0~24 h),不同拷贝数菌株细胞生长虽然比其在甘油阶段生长缓慢,但相互之间也没有明显的差异,在诱导24 h后OD600均可达到190左右,这主要是因为不同拷贝数的菌株诱导初期都需要经过一段时间的甲醇诱导PAOX1启动和醇氧化酶(AOX1)的表达,从而使细胞利用甲醇生长[15];在甲醇诱导24~72 h时,低拷贝数外源基因重组菌(1拷贝和6拷贝)的生长趋势基本相似,最大OD600能达到360,但是高拷贝数外源基因重组菌(12拷贝和18拷贝)生长缓慢,最大OD600仅为270,明显低于低拷贝数菌株。由此可见,拷贝数对甘油阶段和甲醇诱导初期菌株生长无明显影响,但甲醇诱导24 h后高拷贝数菌株(12拷贝和18拷贝)生长受到抑制,菌浓明显低于低拷贝数菌株(1拷贝和6拷贝),存在高拷贝数菌株在甲醇诱导后期生长缓慢现象。
2.2 不同拷贝数毕赤酵母重组菌PIP蛋白表达比较(图2)

图2 不同拷贝数毕赤酵母细胞PIP表达变化曲线
由图2可见,经过72 h甲醇诱导培养,12拷贝毕赤酵母重组菌株PIP蛋白表达水平明显高于其它拷贝数菌株的表达水平,各拷贝数菌株PIP最大表达量呈现“钟罩型”变化趋势:从1拷贝的110.105 mg·L-1增加到6拷贝的631.263 mg·L-1再增加到12拷贝的702.000 mg·L-1,随后18拷贝菌株表达水平下降到514.526 mg·L-1。因此,12拷贝毕赤酵母菌株PIP蛋白表达量分别是1拷贝、6拷贝和18拷贝毕赤酵母菌株的6.376倍、1.112倍和1.360倍。
单位细胞光密度的PIP表达量(PIP/OD600)见图3。

图3 不同拷贝数毕赤酵母细胞PIP/OD600变化曲线
由图3可知,PIP/OD600与PIP蛋白表达具有相同的趋势,即随着拷贝数的增加,PIP/OD600先增加后减小,12拷贝菌株的PIP/OD600最大,但不同的是18拷贝菌株的PIP/OD600要大于6拷贝菌株的PIP/OD600。这可能是由于两者的细胞生物量不同引起的。
2.3 不同拷贝数重组毕赤酵母单位体积氧代谢速率与单位体积CO2释放速率比较(图4)
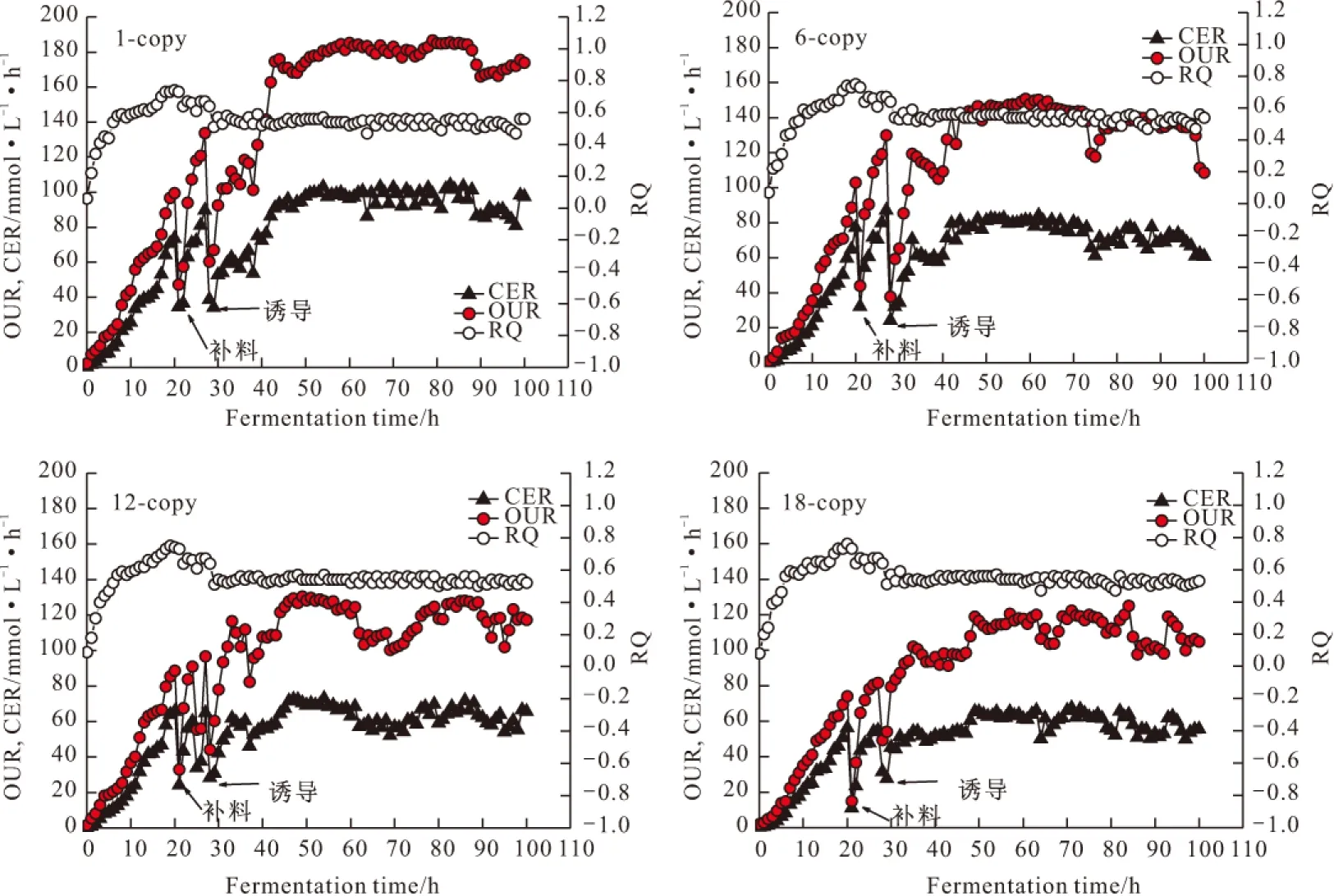
图4 不同拷贝数毕赤酵母细胞OUR、CER和RQ的变化曲线
由图4可知,不同拷贝数的毕赤酵母细胞接种经过短暂的延迟期后进入对数生长期。(1)在批培养阶段,发酵过程在线参数单位体积氧代谢速率(OUR)和单位体积CO2释放速率(CER)呈指数同步增长;而由于初始细胞光密度基数低,其代谢以细胞维持为主,随着细胞光密度的增加,维持能增大,不同拷贝数毕赤酵母细胞呼吸商(Respiratory quotient,RQ=CER/OUR)的值均达到最大值0.75左右,直到22 h,OUR和CER陡降,表明甘油已经耗尽;(2)在甘油补料阶段(22~28 h),不同拷贝数毕赤酵母细胞的OUR、CER同时开始上升,RQ值虽然比批培养阶段低,但是在此阶段却基本保持不变,均维持在0.64左右。由于RQ是表征细胞代谢的生理状态参数,RQ值恒定说明在补甘油阶段采用限制性流加策略,能较好地维持细胞的生理状态、控制菌体的生长状态,可提高底物甘油的细胞转化率,从而有利于减少副产物的形成。发酵28 h后细胞达到一定密度(OD600约为150),停止补加甘油,此时OUR、CER均急剧下降,说明甘油已不足或代谢完全。(3)在甲醇诱导阶段,OUR和CER又同时开始上升,但是出现了增长的“分叉”现象,即上升幅度的非同步性,OUR的上升幅度较CER更大,具体体现在此时RQ出现了明显的下降趋势,但是整个蛋白表达阶段RQ一直维持在0.54左右的水平,比细胞甘油生长阶段的RQ明显要小,这是因为毕赤酵母代谢甲醇有5条途径,比甘油代谢增加了甲醇完全氧化(RQMax=0.68)和二羟丙酮合成(RQMax=0.67)2条途径。
不同拷贝数重组毕赤酵母菌株的OUR和CER具有相同的变化趋势,但是不同拷贝数重组菌的OUR和CER等生理代谢仍有差异,在此仅以不同拷贝数重组菌的OUR为例进行比较,见图5。

图5 不同拷贝数毕赤酵母重组菌在补料分批培养中OUR的变化曲线
由图5可知,不同拷贝数毕赤酵母菌株批培养阶段的OUR均不断增加,1拷贝和6拷贝菌株约达到100.00 mmol·L-1·h-1左右,12拷贝和18拷贝菌株OUR稍低些,仅为88.65 mmol·L-1·h-1和73.99 mmol·L-1·h-1。22 h 时不同拷贝数菌株OUR均下降表明初始甘油已经耗尽,这时以限制性速度补加甘油以继续增加菌体浓度,在此阶段,不同拷贝数菌株的OUR又开始上升。不同拷贝数毕赤酵母菌株诱导之前OUR再次处于一个低峰;补加甲醇适应2 h后,OUR持续上升,约在60 h达到峰值,1拷贝菌株最大达到185.74 mmol·L-1·h-1,分别是6拷贝、12拷贝和18拷贝菌株的1.32倍、1.45倍和1.55倍,并且不同拷贝数菌株诱导后最大OUR都比其甘油阶段高,这可能是由于细胞适应甲醇后,菌浓增加,需要更多的氧来维持细胞代谢和蛋白生产,而高拷贝数菌株比低拷贝数菌株OUR低的主要原因可能是高拷贝数菌株细胞生长较慢。
2.4 不同拷贝数重组毕赤酵母细胞存活率比较
在整个发酵过程中以发酵初始细胞的存活率为100%,每24 h取样1次,共取样4次,不同拷贝数细胞存活率变化曲线见图6。
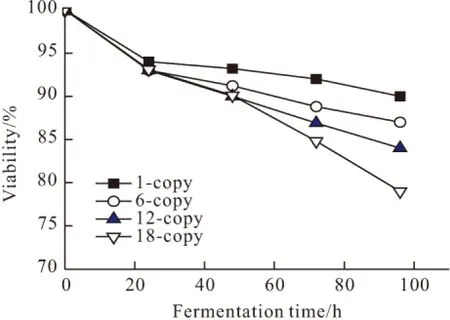
图6 不同拷贝数毕赤酵母菌细胞存活率变化曲线
由图6可知,在细胞生长阶段和诱导初期,不同拷贝数菌株存活率差异不显著,均维持在90%以上,这可能是由于在初始阶段细胞光密度不高,产生有毒副产物少;但在诱导48 h以后不同拷贝数菌株之间的存活率出现了较大差异,除了1拷贝菌株细胞存活率在90%外,其它拷贝数菌株的存活率均急剧下降,18拷贝菌株细胞存活率下降到78%,而且拷贝数越高存活率下降越明显。由此表明,基因拷贝数的增加容易引起细胞存活率的下降。
2.5 不同拷贝数毕赤酵母重组菌外源基因稳定性比较
发酵过程中分别在48 h和96 h取样2次,提取酵母的总DNA,稀释500倍后分别对GAP基因和PIP基因做定量PCR反应,测定其Ct值。均进行2次平行实验。由建立的GAP基因和PIP基因标准曲线(图7)算出PIP与GAP的拷贝数,二者的比值即为该样品的拷贝数。
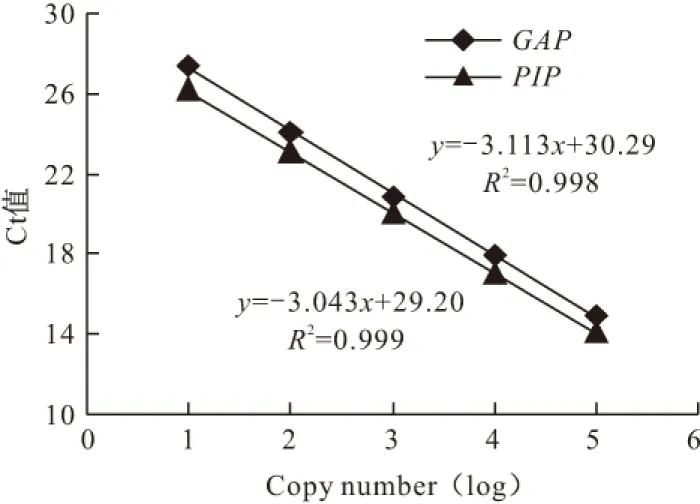
图7 PIP和GAP基因的标准曲线
由图8可知,在 5 L发酵罐发酵48 h 后,不管是低拷贝数还是高拷贝数菌株的遗传稳定性均没有发生显著变化;发酵96 h后,1拷贝菌株PIP基因拷贝数稳定,6拷贝菌株拷贝数仅发生微小变化,但12拷贝和18拷贝菌株PIP基因的丢失率增加,分别丢失了16.1%和19.4%。这说明在甘油阶段和甲醇诱导初期并不影响基因的稳定性,但随着诱导时间的延长,拷贝数越高基因的不稳定性就越大。
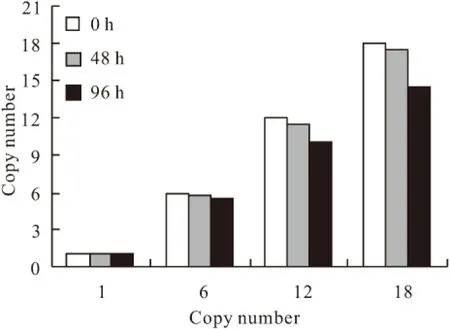
图8 不同拷贝数毕赤酵母菌的基因稳定性
3 结论
在5 L发酵罐补料分批发酵发现,在甘油阶段和甲醇诱导初期,拷贝数对毕赤酵母的生长无显著影响;在甲醇诱导24 h后低拷贝数菌株(1拷贝和6拷贝)生长不受影响,但高拷贝数菌株(12拷贝和18拷贝)存在生长缓慢、细胞存活率急剧下降的现象;随着拷贝数的增加,蛋白表达存在先增加后减小的趋势,12拷贝时达到最大值702 mg·L-1;在甘油阶段和甲醇诱导初期不同拷贝数毕赤酵母菌外源基因均表现出很高的稳定性,在诱导后期低拷贝数外源基因稳定性所受影响不大,但高拷贝数菌株外源基因丢失明显。因此,在利用高拷贝数的重组毕赤酵母菌株进行生产时,应多方考虑寻找到最优表达的拷贝菌株。
[1] 董鹏,陈劲春,冷雪.表达胰岛素的毕赤酵母生长动力学及诱导策略[J].北京化工大学学报(自然科学版),2006,33(3):37-41.
[2] Cregg J M.PichiaProtocols[M]. Totowa N J:Humana Press,2007:1-10.
[3] Li P Z,Anumanthan A,Gao X G,et al. Expression of recombinant proteins inPichiapastoris[J]. Applied Biochemistry and Biotechnology,2007,142(2):105-124.
[4] 陈文,郭美锦,储炬,等.重组毕赤酵母表达猪胰岛素前体代谢参数分析和动力学模型[J].华东理工大学学报(自然科学版),2005,31(3):300-304.
[5] Macauley-Patrick S,Fazenda M L,McNeil B,et al. Heterologous protein production using thePichiapastorisexpression system[J]. Yeast,2005,22(4):249-270.
[6] 王燕,梁镇和,张友尚,等.人胰岛素在甲醇酵母Pichiapastoris中的分泌表达[J].生物化学与生物物理学报,1999,31(5):587-589.
[7] 姚钰舜,储炬,杭海峰,等. 培养条件对重组毕赤酵母高密度表达猪胰岛素前体的影响[J]. 华东理工大学学报(自然科学版),2006,32(4):397-401.
[8] Zhu T C,Guo M J,Tang Z Y,et al. Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeastPichiapastoris[J]. Journal of Applied Microbiology,2009,107(3):954-963.
[9] 郭美锦,吴康华,杭海峰,等.基因工程菌Pichiapastoris高密度培养条件研究[J].微生物学通报,2001,28(3):6-11.
[10] Harju S,Fedosyuk H,Peterson K R. Rapid isolation of yeast genomic DNA:Bustn′Grab[J]. BMC Biotechnology,2004,4:8.
[11] Zhu T C,Guo M J,Sun C,et al. A systematical investigation on the genetic stability of multi-copyPichiapastorisstrains[J]. Biotechnology Letters,2009,31(5):679-684.
[12] Hohenblum H,Borth N,Mattanovich D. Assessing viability and cell-associated product of recombinant protein producingPichiapastoriswith flow cytometry[J]. Journal of Biotechnology,2003,102(3):281-290.
[13] Khatri N K,Hoffmann F. Impact of methanol concentration on secreted protein production in oxygen-limited cultures of recombinantPichiapastoris[J]. Biotechnology and Bioengineering,2006,93(5):871-879.
[14] 张嗣良,储炬.多尺度微生物过程优化[M].北京:化学工业出版社,2003:45-47.
[15] Cregg J M,Tolstorukov I,Kusari A,et al. Expression in the yeastPichiapastoris[J].Methods in Enzymology,2009,463:169-189.
