黄姑鱼幼鱼继饥饿后补偿生长的研究
2011-07-12史会来毛国民薛宝贵徐冬冬
史会来,耿 智,楼 宝,毛国民,薛宝贵,詹 炜,徐冬冬
(1.浙江海洋学院海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316100;2.浙江海洋学院,浙江舟山 316004)
近年来,国内外许多学者对饥饿条件下鱼类生理生态学变化和能量代谢及其恢复进食后的生长现象进行了深入研究[1-8]。鱼类继饥饿后的补偿生长现象已在石首鱼科、鲑科、鲤科、鳕科、鲽科、丽鱼科、鲴科、鳎科、鲆科、刺鱼科中的近30种鱼中被发现,其中绝大多数研究表明经过环境(食物和温度等)胁迫的鱼可表现出不同程度的补偿生长。但有关黄姑鱼饥饿后的补偿生长研究还未见公开报道。
黄姑鱼Nibea albiflora,俗称黄婆鸡,属鲈形目、石首鱼科、黄姑鱼属,体形与黄花鱼有相似处,黄姑鱼为近海中下水层鱼类,主要栖息于砂泥底质较浅沿岸海域,以小型甲壳类及小鱼等底栖动物为食。分布于西北太平洋区,包括中国南海、东海及黄海南部,是我国东南沿海养殖的理想品种[9-10]。目前,有关黄姑鱼的研究已有一些报道,主要集中在胚胎、仔稚鱼发育、人工繁育和养殖等方面[10-16],本文报道了黄姑鱼幼鱼在不同的饥饿时间后恢复投喂过程中摄食、生长、体组成变化,以期为黄姑鱼养殖中饵料投喂提供科学依据。
1 材料与方法
1.1 材料
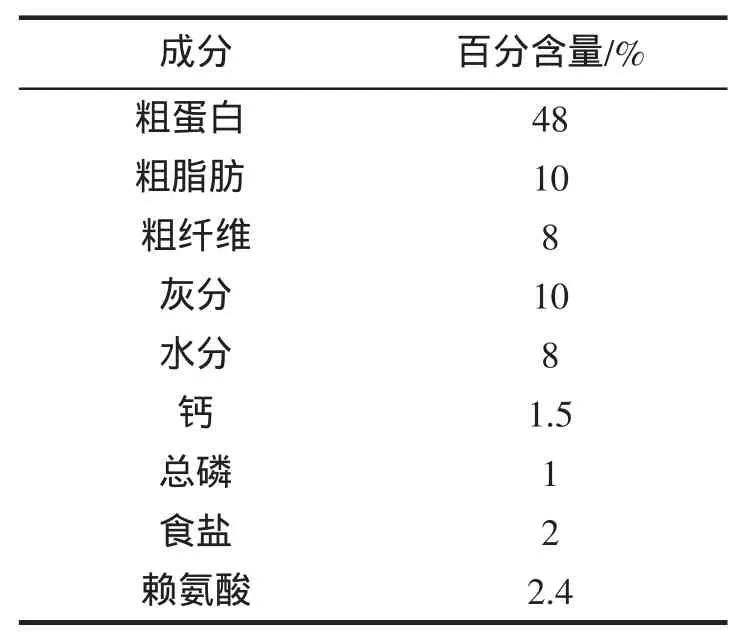
表1 实验饲料营养组成Tab.1 The nutrution composition of feed in the present experiment
室内养殖实验在浙江省海洋水产研究所西闪实验场进行,所用的黄姑鱼为该场自行繁殖的幼鱼。实验前先选取健康鱼种600尾,暂养于室内10 t水泥池中,每天早、晚2次投喂配合饲料,饲料为宁波天邦股份有限公司生产的海水鱼类全价配合饲料(表1)。待摄食和生长正常后,选取大小相近的鱼480尾,按30尾/缸的密度在16个实验玻璃钢水槽(有效水体0.8 m3)内继续驯养2周。实验过程中使用经沉淀和沙滤后的自然海水,盐度为26.0~27.5,温度为 26~28 ℃,日换水量为 200%。
1.2 方法
实验中设5个食物处理组,其中4组鱼分别饥饿4 d(S4组)、8 d(S8组)、12 d(S12组)和16 d(S16组)后再恢复正常投喂;另外1组鱼在实验期间始终正常投喂作为对照(S0组)。另设一持续饥饿取样组,实验周期为40 d。
实验开始时将驯养的鱼停喂24 h,然后每次随机取25尾鱼,称重,随机放入16个实验桶中,每组处理设3个重复。实验鱼初始体重为(7.18±0.49)g/尾(平均值±标准差)。放养结束后从剩余的驯养鱼中随机取3组鱼(3尾/组),称重去内脏后在-20℃下保存以待分析其化学组成。S4~S16组在饥饿处理结束时,分别从取样组中随机取鱼3尾;实验结束后,从每个处理组中随机取3尾。称重去内脏后在-20℃下保存以待分析其化学组成。
在实验开始、饥饿处理结束以及实验过程中每8 d分别测定各组鱼体重、摄食量和残饵量。
1.3 样品分析
将实验过程中所取的鱼体样品在70℃下烘干至恒重,根据烘干前后的重量差异计算水分含量;粗蛋白含量用半微量凯氏定氮法测定;粗脂肪含量用Soxtec抽提法(以乙醚为抽提溶剂)测定;将样品在550℃下灼烧至恒重,根据灼烧前后重量损失计算灰分含量。
1.4 数据计算与统计分析
鱼体饥饿过程中体重损失率、恢复生长后每尾鱼的特定生长率(SGR)、摄食率(FR)和食物转化效率(FCE)分别用以下公式计算:
体重损失率(%)=100×(W0-W1)/W0
SGR(%/d)=100×(LnW2-LnW1)/t
FR(%/d)=100×C/[t×(W1+W2)/2]
FCE(%)=100×(W2-W1)/C
其中:W0、W1和W2分别为饥饿处理开始、恢复生长开始和恢复生长结束时实验鱼的体重(g),C为总摄食饵料量(g),t为恢复生长时间(d)。
同一水槽实验数据(平均值)作为一个样本值,实验数据用SPSS13.0软件进行方差分析,以邓肯多重比较方法检验组间差异,P<0.01为差异极显著,P<0.05为差异显著。
2 结果
2.1 饥饿和恢复投喂过程中体重变化
实验期间 S0、S4、S8、S12和 S16组成活率分别为(87.7±5.1)%、(86.7±3.1)%、(84.4±4.5)%、(82.2±5.1)%和(81.1±5.1)%,各组间鱼成活率无显著差异(P>0.05)。体重变化见表2,实验开始时(饥饿处理前),实验鱼平均体重为 7.18±0.49 g,各实验组鱼体重间无显著性差异(P>0.05)。饥饿结束时 S4组体重为 6.86 g,体重损失率达 2.83%;S8组体重为 6.76 g,体重损失率达 4.65%;S12组体重为 6.54 g,体重损失率达 6.33%;S16组体重为6.78 g,体重损失率达6.98%。饥饿后各处理组体重均降低,并且随着饥饿时间的延长体重损失率逐渐增大,除 S12和 S16组间无显著性差异外(P>0.05),其他各组间均出现了极显著差异(P<0.01)。实验第8 d 结束时 S0、S4和 S8组体重分别为 11.24 g、8.96 g 和 6.76 g,S0组显著高于 S4和 S8组,各组间存在极显著性差异(P<0.01);实验第 16 d 结束时 S0、S4、S8、S12和 S16组分别为 12.16 g、10.73 g、7.06 g、6.67 g 和 6.78 g,S0组显著高于其他组(P<0.01),S8、S12和 S16组间无显著差异(P>0.05);实验第 24 d 结束时 S0、S4、S8、S12和 S16组分别为 16.51 g、15.78 g、12.30 g、9.83 g 和 8.43 g,S0和 S4组显著高于其他组(P<0.01),两组间无显著性差异(P>0.05),其他各组间差异显著(P<0.01);实验第 32 d 结束时 S0、S4、S8、S12和 S16组分别为 21.76 g、20.13 g、16.56 g、12.87g 和 12.22 g,S0和 S4组显著高于其他组(P<0.01),两组间无显著性差异(P>0.05),S12和 S16组显著低于其他各组(P<0.01),两组间无差异(P>0.05);实验结束时 S0、S4、S8、S12和 S16组分别为24.81 g、23.53 g、19.58 g、15.40 g和 15.23 g,S0和 S4组显著高于其他组(P<0.01),两组间无显著性差异(P>0.05),S12和 S16组显著低于其他各组(P<0.01),两组间无差异(P>0.05)。

表2 黄姑鱼饥饿及恢复生长过程中的体重变化(平均值±标准差)Tab.2 The weight changes of Nibea albiflora during starvation and after recovery growth(mean±S.D.n=3)
2.2 饥饿和恢复投喂过程中鱼体生化组成变化
饥饿过程中鱼体生化组成发生改变,鱼体的水分含量随饥饿时间延长而增加,从73.4%升至75.9%,S12和 S16处理组显著高于其他组(P<0.05),实验结束时各实验组鱼体水分含量无显著差异(P>0.05)(图1-A);蛋白质含量随饥饿时间延长而下降,从 19.5%降至 17.8%,S12和 S16组显著低于对照组(P<0.05),实验结束时各实验组鱼体蛋白质含量无显著差异(P>0.05)(图1-B);脂肪随饥饿时间延长而迅速下降,从1.60%降至 0.31%,各组间均存在显著差异(P<0.05),实验结束时各实验组鱼体脂肪含量无显著差异(P>0.05)(图1-C);灰分含量饥饿时间延长略有增加,从5.40%升至6.07%,各实验组间无显著性差异,实验结束时各实验组鱼体灰分含量无显著性差异(P>0.05)(图-D)。
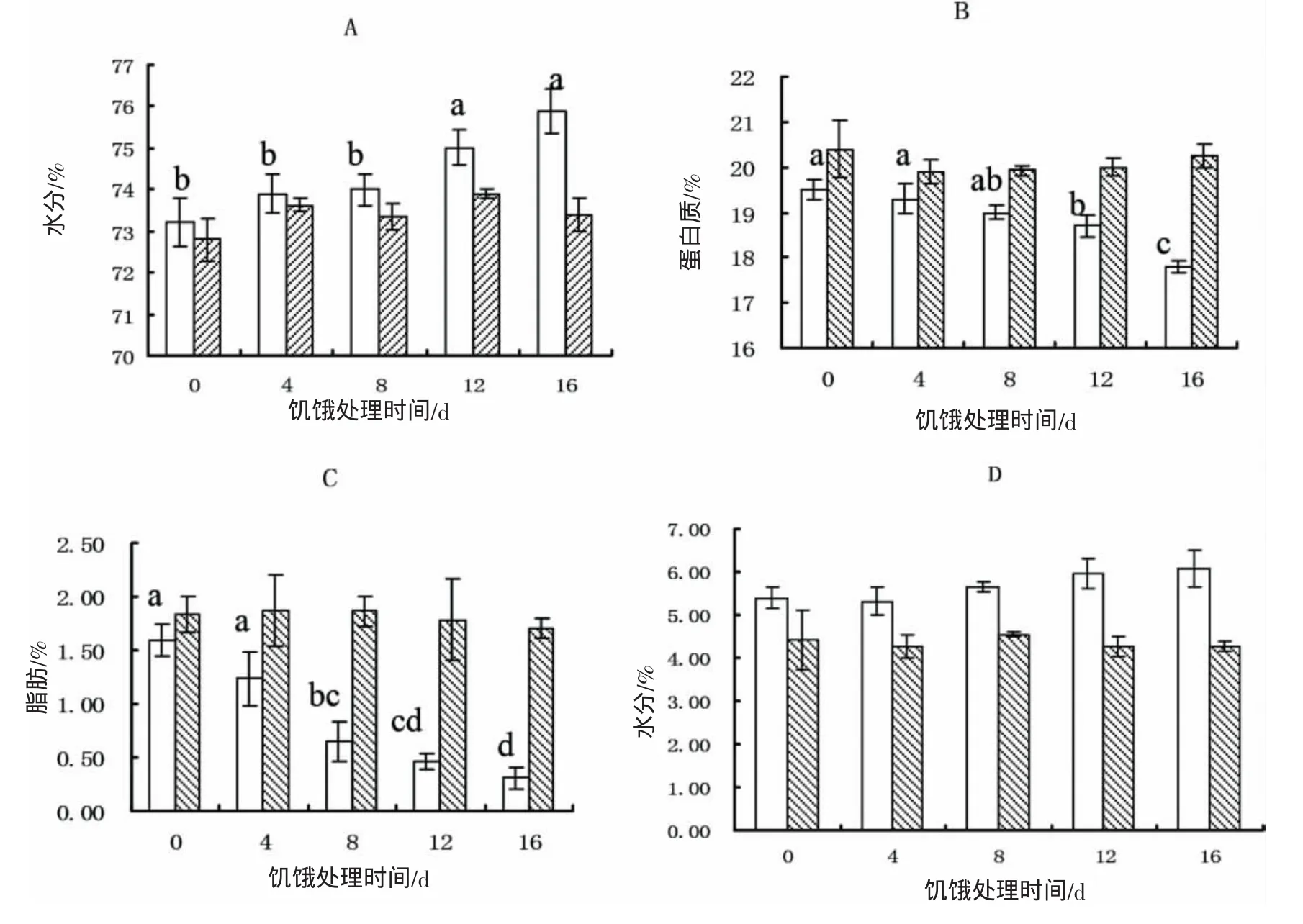
图1 黄姑鱼幼鱼在饥饿后(白色)及恢复投喂后(黑色)身体组成的变化Fig.1 The changes of biochemical compositions in Nibea albiflora after starvation(white)and recovery growth(black)
2.3 饥饿和恢复投喂过程中特定生长率、摄食率和食物转化率的变化
SGRW变化:实验期间,S0组的SGRW变化较小,饥饿组的变化较大(表3)。S4组的SGRW随着恢复投喂时间的延长逐渐降低,1~24 d 的 SGRW显著高于 S0组(P<0.05),之后与 S0组无显著性差异(P>0.05);S8组SGRW随着恢复投喂先增高后降低,1~16 d的SGRW显著低于S0组,1~24 d的SGRW显著高于S0组(P<0.05),之后与 S0组无显著性差异(P>0.05);S12和 S16组的 SGRW变化趋势相似,随着恢复投喂时间的延长逐渐增加,S12组1~16 d和S16组1~24 d的SGRW均显著低于S0组(P<0.05),之后与S0组无显著性差异(P>0.05)。
FR变化:实验期间,S0组的FR变化较小,饥饿组的变化较大(表2)。S4组的FR随着恢复投喂时间的延长逐渐降低,1~24 d 的 FR 显著高于 S0组(P<0.05),之后与 S0组无显著性差异(P>0.05);S8和 S12组 1~16 d 的 FR 与 S0组无显著性差异(P>0.05),S8组 1~32 d 的 FR 显著高于 S0组(P<0.05),之后与 S0组无显著差异(P>0.05),S12组 1~40 d 的 FR 与 S0组仍有显著差异(P<0.05);S16组 1~32 d 的 FR 与 S0组无显著性差异(P>0.05),之后与 S0组差异显著性(P<0.05)。
FCE变化:实验期间,FCE的变化趋势与FR相似。S4、S8和S12组在恢复喂食后的开始阶段FCE均显著的高于S0组(P<0.05),随着恢复投喂时间的延长,FCE开始下降,在实验结束时与S0组无显著性差异(P>0.05)。S16组 1~24 d 的 FCE 显著的低于 S0组 (P<0.05),随着恢复投喂时间的延长,FCE 开始升高,结束时与对照间无显著性差异(P>0.05)。
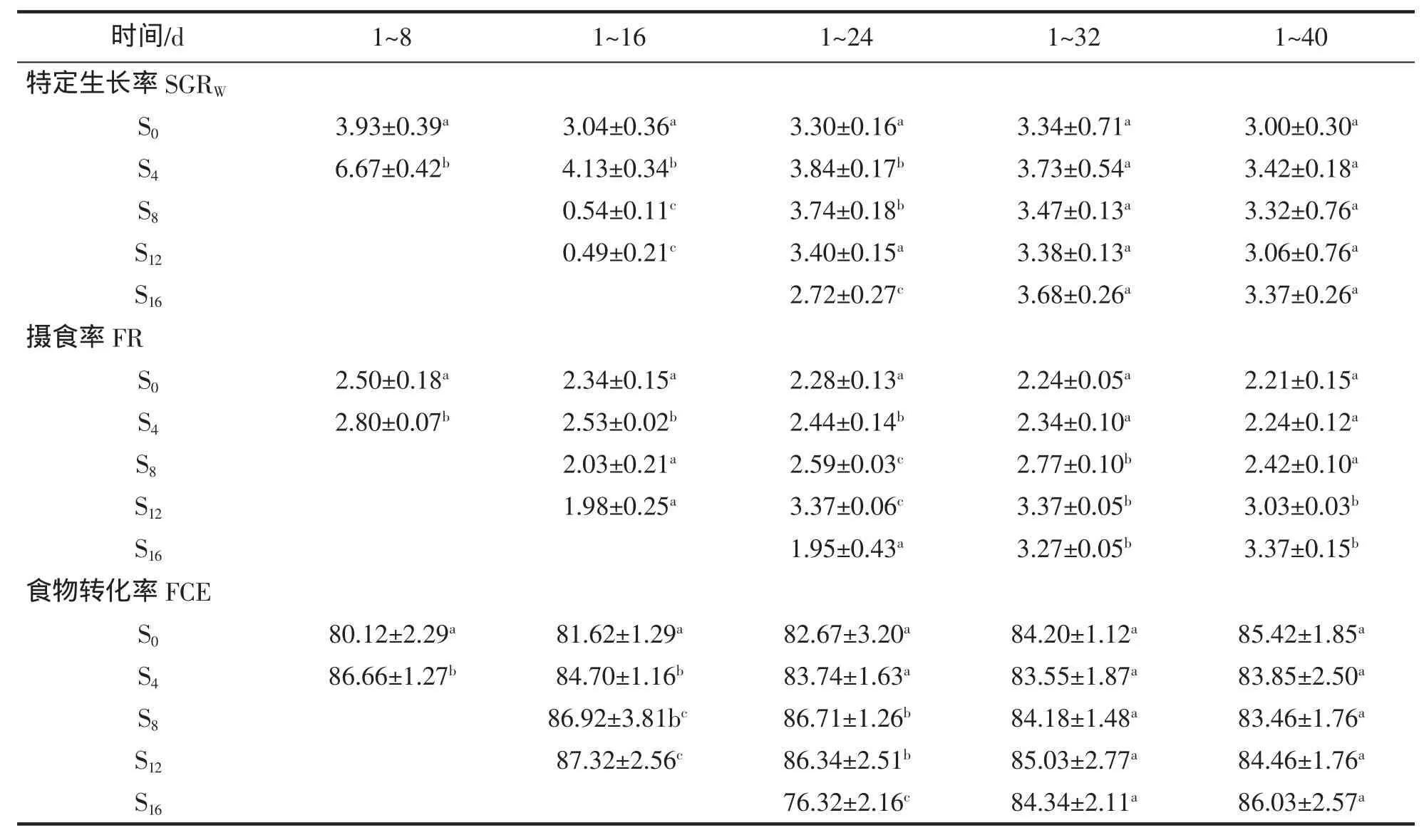
表3 实验过程中黄姑鱼SGR(%/d)、FR(%/d)和FCE(%)(平均值±标准差)的变化Tab.3 Changes of SGR(%/d)、FR and FCE in Nibea albiflor during experiment(mean±SD)
3 讨论
本实验中,虽然S4和S8组的SGRW1~24 d显著高于S0组,但实验结束时S4组体重与S0组无显著差异,S8组显著低于S0组,S12和S16组的SGRW和实验结束时体重显著低于S0组,S4组出现了完全补偿生长的效应,S8组出现了部分补偿生长效应,S12和S16组,未出现补偿生长效应。
通常情况下鱼类补偿生长强度随饥饿时间延长而增加[8],但本实验研究结果显示,S4组饥饿处理后恢复投喂的前20天SGRW显著高于S0组,之后与S0组无显著差异;S8组饥饿处理后恢复投喂的前8天SGRW显著低于S0组,随后显著高于S0组,16天之后与S0组无显著差异;S12和S16组饥饿后恢复投喂的SGRW一直显著低于S0组,补偿生长强度并未随着饥饿处理时间的延长而增强,与王岩等的报道不同,这可能与本实验鱼的体重较小(仅为7.18±0.49 g)有关,12 d和16 d的饥饿处理强度已超过鱼体的承受范围。另有研究表明,经过食物限制后鱼类补偿生长可持续约1~3周[17-19],在本实验中,S4组恢复投喂后的前20 d SGRW显著高于S0组,S8组恢复投喂后的前16 d SGRW显著高于S0组,黄姑鱼幼鱼的补偿生长效应产生在恢复投喂后的2~3周,与WIESER等的研究结果一致[17-19]。
鱼类在补偿生长阶段是否会改善对食物利用效率至今存在不同的结论。经过饥饿的杂交斑点叉尾鮰Ictalurus punctatus[3]、南方鲇 Silurus meridionalis[5]和罗非鱼 Oreochromis mossambicus×O.niloticus[8]等在恢复喂食期间摄食量明显增加,但对食物的利用效率未出现明显变化;经过饥饿的大西洋鳕Gadus morhua[20]、黑鲷Sparus macrocephalus[21]和虹鳟Salmo gairdneri[1]等在恢复喂食期间除增加摄食量外,食物利用率也得到明显的改善。本实验中,出现补偿生长效应的S4和S8组恢复投喂后的FR和FCE均大于S0组。黄姑鱼的补偿生长效应主要是通过提高摄食水平和提高食物转化率来共同实现的,与楼宝等研究结果一致[1,20-21]。
楼宝和姜志强等对黑鲷[21]、日本黄姑鱼[22]和美国红鱼[23]的研究表明:饥饿后鱼体内的粗蛋白和粗脂肪含量会下降,水分和灰分含量会升高,恢复投喂后鱼体的生化成分无显著变化。本实验中鱼体粗蛋白质和粗脂肪含量随饥饿时间延长显著下降,水分和灰分含量升高,恢复投喂后与对照组无显著差异,饥饿后再恢复投喂不会影响黄姑鱼幼鱼的营养质量,这与姜志强和楼宝等的研究结果一致。
本实验结果显示:对于体重7~10 g的黄姑鱼幼鱼,采用饥饿4 d后恢复投喂20 d的投喂方法可提高饲料利用率而不会明显影响鱼的生长,同时降低养殖管理成本,适度饥饿后再恢复投喂会增强鱼的食欲。因此,按一定规律采用饥饿后恢复投喂的策略应为黄姑鱼养殖有益的饲养管理措施。
[1]DOBSON S H,HOLMES R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].J Fish Biol,1984,25:649-656.
[2]MIGLOVS I,JOBHNG M.Effects of feeding regime on food consumption,growth rates and tissue nucleic acids injuvenile Arctic char,Salvelinus alpinus[J].Fish Biol,1989,34:947-957.
[3]KIM M K,LOVELL R T.Effect of restricted feeding regimes on compensatory weight gain and body tissue changes in channel catfish Ictaluruspunctatus in pond[J].Aquaculture,1995,135:285-293.
[4]孔令军,王 岩,李 翠,等.网箱养殖鮸状黄姑鱼停喂不同时间后的补偿生长[J].中国水产科学,2006,13(4):591-596.
[5]邓 利,张 波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-173.
[6]张 波,孙 耀,唐启升.饥饿对真鲷生长及生化组成的影响[J].水产学报,2000,24(3):206-210.
[7]谢小军,邓 利,张 波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-189.
[8]王 岩,崔正贺.鱼类补偿生长研究中的几个问题[J].上海水产大学学报,2003,12(3):260-264.
[9]朱元鼎,张春霖,成庆泰.东海鱼类志[M].北京:科学出版社,2005:277-278.
[10]楼 宝,史会来,毛国民,等.黄姑鱼全人工繁育及大规格苗种培育技术研究[J].现代渔业信息,2011,26(3):20-23.
[11]蔡厚才,林归璇,陈传再.南极海区黄姑鱼网箱养殖技术研究[J].浙江海洋学院学报:自然科学版,2001,20(1):66-70.
[12]雷霁霖,樊宁臣,郑澄伟.黄姑鱼(Nibea albiflora Richardson)胚胎及仔、稚鱼形态特征的初步研究[J].海洋水产研究,1981,4(2):77-88.
[13]余方平,孙 忠,程国宝.舟山近海黄姑鱼胚胎发育及前期仔鱼形态的观察[J].浙江海洋学院学报:自然科学版,2005,27(4):265-271.
[14]陈 超,徐延康,雷霁霖.黄姑鱼人工育苗初步研究[J].水产科学,1989,8(1):7-11.
[15]雷霁霖,陈 超,徐延康,等.黄姑鱼工厂化育苗技术研究[J].海洋科学,1992,11(6):5-10.
[16]孙 忠,余方平,程国宝.舟山近海黄姑鱼室内全人工育苗技术研究[J].浙江海洋学院学报:自然科学版,2005,24(1):27-47.
[17]WANG Y,CUI Y,YANG Y,et al.Compensatory growth in hybird tilapia,Oreochromis mossambicus×O.niloticus,reared in seawater[J].Aquaculture,2000,189:101-108.
[18]WIESER W,KRUMSCHNALBEL G,OJWANG-OKWOR J P.The energetics of starvation and growth after refeeding in juveniles of three cy pinid species[J].Environ Biol Fish,1992,33:63-71.
[19]RUSSELL N R,WOOTTON R J.Appetite and growth compensation in the European minnow,Phoxinus phoxinus(Cyprinidae)following short periods of food restriction[J].Environ Biol Fish,1992,34:277-285.
[20]JOBLING M,MELY O H,DOS SANTOS J,et al.The compensatory gorowth response of the Atlantic cod:Effects of nutritional history[J].Aquac Intern,1994,2:75-90.
[21]楼 宝,史会来,骆季安,等.黑鲷幼鱼继饥饿补偿生长的研究[C]//2008年全国海水养殖学术研讨会论文集.北京:海洋出版社,2009:381-389.
[22]楼 宝,史会来,胡则辉,等.饥饿和再投喂对日本黄姑鱼生长及其体生化组成的影响[J].水生生物学报,2008,32(2):280-285.
[23]姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):66-72.
