新型磷结合剂在慢性肾脏病中的应用
2011-07-01史明君综述谢红浪审校
史明君 综述 谢红浪 审校
·肾脏病临床·
新型磷结合剂在慢性肾脏病中的应用
史明君 综述 谢红浪 审校
慢性肾脏病(CKD)患者肾功能恶化,引起继发性甲状旁腺功能亢进以及钙磷代谢紊乱,进一步导致血管钙化等心血管疾病,增加CKD患者发病率及死亡率。传统磷结合剂常含钙、铝成分,降低血磷但不良反应较多。司维拉姆、碳酸镧、SBR759、PA21-1、考来替兰和碱式碳酸镁铁等新型磷结合剂不含钙、铝,具有与传统磷结合剂类似的降低血磷作用,却不升高血钙,为控制高磷血症且减少血管钙化风险提供了治疗前景。
慢性肾脏病 磷结合剂
慢性肾脏病(CKD)发病率逐年增加,用于终末期肾病(ESRD)的医疗费用不断增加[1]。心血管疾病是CKD患者的主要死亡原因,其发病率是同龄人的20~30倍,青年尿毒症患者尤为显著。半数以上透析患者死于心血管疾病[1],动脉壁中层钙化是其进展的主要因素之一[2]。
肾功能恶化导致血磷清除障碍[3],直接或间接使甲状旁腺激素(PTH)分泌增加[3-5],从而引起继发性甲状旁腺功能亢进、高转化性骨病、囊性纤维化及其他骨骼肌肉疾病。此外还可引起血管和软组织钙化,影响心血管疾病的发生率和死亡率。目前对CKD患者血磷代谢紊乱的认识已超出肾性骨病范畴,即认为高磷血症是增加CKD患者发病率、死亡率和住院率,是降低生活质量及增加治疗费用的独立危险因素[6,7],因此形成了“CKD相关矿物质和骨病(CKD-MBD)”的概念。
CKD患者均需口服磷结合剂以减少肠道磷吸收,但传统磷结合剂为含钙、铝的复合物,不良反应多。近来,不含钙和铝的新型磷结合剂越来越多地应用于临床,本文将对其利弊作一综述。
血磷调节机制
血磷受饮食摄入、肾脏排泄及细胞内储存量的影响。骨骼是磷的储存池,不断与血清磷交换并保持平衡。仅有少部分无机磷(<1%)分布于血清中,大部分位于细胞内(70%)与骨骼中(29%)。肾功能正常时,肾小球每天滤出大量有机磷酸盐,其中90%被肾小管上皮细胞重吸收。肾功能轻度受损时,肾脏滤出磷酸盐减少,血磷升高,但PTH和成纤维细胞生长因子23(FGF-23)等因素使肾小管对磷的重吸收减少,使尿磷排泄量与胃肠道磷吸收量保持平衡,维持血磷稳定。随着肾功能恶化,平衡调节机制受损,导致高磷血症。
FGF-23由成骨细胞分泌,对维持血磷平衡起重要作用。CKD患者血磷浓度及PTH仍在正常范围时,FGF-23就已异常升高,且随着肾小球滤过率估计值(eGFR)进一步下降[8],提示FGF-23是反映早期血磷代谢紊乱的敏感生物标志;但随着CKD进展,FGF-23水平仍不断升高,但此时FGF-23的作用为介导左心室肥大、加速CKD进展并增加死亡率。通过口服磷结合剂和/或抗PTH药物可以在早期降低FGF-23水平,从而限制其在晚期出现的不良反应,改善CKD患者预后。
CKD患者一旦发生磷调节失衡,只能通过细胞内蓄积或与骨骼、软组织交换等途径寻求新平衡。CKD时骨骼是调节血磷的重要环节,但骨骼异常重建,也可加重高磷血症。无动力性骨病(ABD)时骨转化能力低下,骨骼对矿物质摄取能力降低,对高磷血症调节力亦降低。相反,继发性甲状旁腺功能亢进可导致骨骼过度溶解吸收,矿物质外流,参与高磷血症的发生。上述两种情况均可引起高磷血症,使骨骼丧失血磷调节功能(图1)。
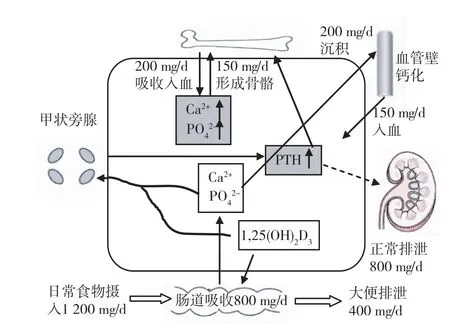
图1 高磷血症病理生理[9]
控制高磷血症的主要措施包括限制饮食中磷摄入、充分透析、使用磷结合剂及切除甲状旁腺等。大多数患者仅靠控制饮食中磷的摄入难以达到治疗目的,而且,过度控制饮食会造成蛋白质摄入不足。
常规血液透析(HD,2次/周、4 h/次)约每周清除磷1 000 mg,远远低于饮食摄入的磷;腹膜透析每周磷的清除量高于HD,也不足以维持血磷平衡。虽然日间短时加夜间缓慢腹膜透析能够增加磷清除,但价格昂贵难以广泛应用。因此,90%以上透析患者需口服磷结合剂来控制血磷。
钙、磷代谢异常与心血管并发症
骨骼代偿机制受损时,软组织(包括血管壁)成为矿物质沉积的主要部位(图1)。磷在软组织异常沉积可增加心血管疾病发病率及死亡率。
血管钙化机制复杂。既往认为血管钙化是与年龄相关,由钙磷代谢失衡导致钙沉积于细胞和组织间的被动过程。近年来认为钙化是一种类似于骨和软骨形成的主动过程,表现为血管平滑肌细胞发生骨样变化,可能分为三步:(1)血管平滑肌细胞分化为成骨样细胞;(2)产生胶原和非胶原的基质蛋白;(3)当促进钙化的动力(如钙磷乘积增加,高磷血症等)超过抑制钙化因素(如肽球蛋白、基质Gla蛋白)的作用,便产生钙化。
血管钙化与钙磷代谢异常有关。Hruska等[3]通过实验证实血磷在血管钙化中起关键作用,不仅介导异位钙盐沉积,而且是刺激CKD血管钙化的信号分子。Mathew等[10]的动物实验证实,高磷血症可促进血管内膜表达具有锌指结构的成骨细胞特异性转录因子osterix,生成骨形成蛋白2(BMP-2)等,形成类成骨细胞,引起血管壁钙化。Davies等[11]在小鼠血管钙化模型中发现磷结合剂能显著抑制血管钙化。体外研究还显示,高钙条件下,即使血磷正常也可诱发人血管平滑肌细胞发生钙化[12]。
除增加血管钙化外,高磷血症还可通过其他机制参与心血管疾病[13]:(1)直接增加活性氧引起血管损伤,导致氧化应激及血管内皮功能损伤;(2)增加PTH以及FGF23,两者均可直接导致心血管疾病;(3)血磷升高可抑制 1,25二羟维生素 D3[1,25(OH)2D3]的合成,引起血管钙化及心肌疾病(图2)。
因此,充分降低血磷而又不导致高钙血症是预防CKD患者血管钙化、心血管疾病的重要因素。
新型磷结合剂
司维拉姆 司维拉姆是首个人工合成的非铝非钙型磷结合剂,属阴离子结合树脂,主要成分为盐酸多聚丙烯胺,高度亲水性,口服后在胃肠道内膨胀成数倍于原体积的凝胶。生理pH下其所含胺基几乎全部质子化,通过离子氢键与磷酸盐结合,在胃肠道不被吸收而随粪便排出。司维拉姆主要在近端小肠与磷结合,胃酸抑制剂不降低结合效率[14]。司维拉姆与钙盐降磷作用相似,但不升高血钙,从而有益于减少血管钙化。
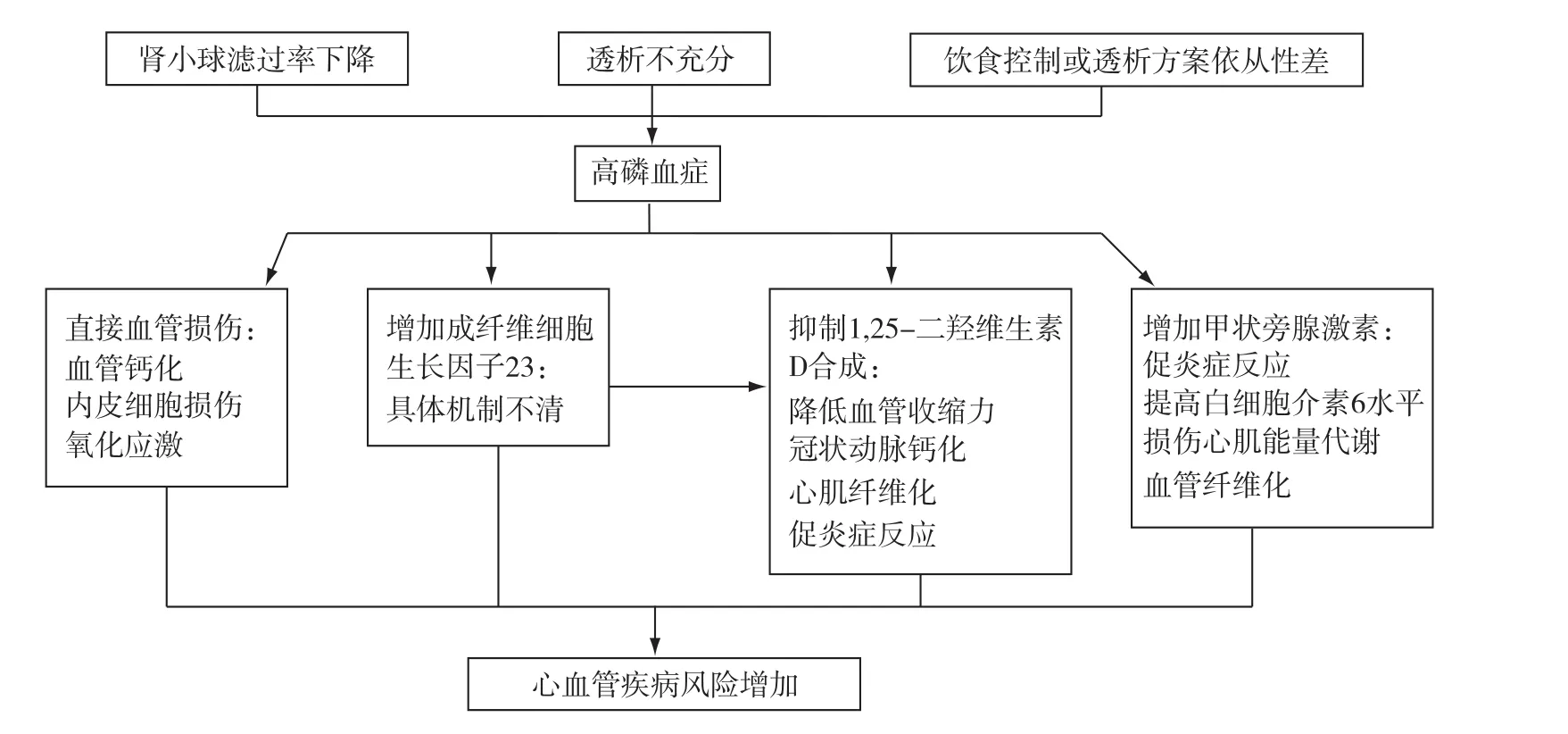
图2 高磷血症导致心血管疾病风险增加可能机制[13]
Meta分析发现,治疗终点时司维拉姆组血磷高于钙盐组,但显著低于安慰剂组[15]。与钙盐相比,司维拉姆显著降低血钙、升高PTH水平,同时显著降低碳酸氢根和总胆固醇,但对钙磷乘积无影响。大样本透析患者临床终点研究(DCOR)也显示司维拉姆与钙盐相比对血磷的影响作用相似。有五项临床研究观察了司维拉姆对HD患者血管钙化的影响,其结果差异较大[16-20]。有研究发现与钙盐相比,司维拉姆能延缓冠状动脉、主动脉及心脏瓣膜的钙化过程[17,19],另有作者发现司维拉姆或醋酸钙分别与阿托伐他汀联用时延缓冠状动脉钙化的作用相似[18]。HD患者分别应用司维拉姆和钙盐,两组冠状动脉钙化评分(改良的Agatston评分)无显著差异(P=0.59),Meta分析也显示司维拉姆不能显著改善血管钙化[15]。
DCOR研究共有1 068例维持性血液透析(MHD)患者完成,初步结果显示两组全因死亡率无显著差异[21]。但在65岁以上患者中,司维拉姆组死亡率和全因住院率低于钙盐组,但不能明显降低心血管疾病相关住院率。另一项共涉及148例HD患者的研究提示碳酸钙或醋酸钙与司维拉姆相比,其校正死亡率较高,但非校正死亡率无差异[22]。对5项随机研究的Meta分析(共2 429例患者)发现,司维拉姆与钙盐对患者的死亡率无显著影响,近期两项Meta分析结果也支持这一结论[15]。
Meta分析显示,司维拉姆组胃肠道不良事件发生率明显高于钙盐,包括腹胀、腹泻和便秘等。司维拉姆组和钙盐组因严重不良反应而退出研究的比例分别为7.7%和4.8%[21]。
总之,与传统的钙盐磷结合剂相比,司维拉姆降磷作用类似,却未减少全因或心血管死亡率风险,对血管钙化及骨骼的作用也尚不明确。但在同等降磷作用下,司维拉姆较钙盐能显著降低血钙水平,因其不良反应较多导致患者依从性较差,间接影响了其降磷效果。
碳酸镧 三价镧阳离子与磷有很高的结合力,碳酸镧在肠道通过离子键与磷结合形成不溶于水的化合物,其胃肠道吸收少,故不良反应少。碳酸镧主要通过胆汁排泄,少量经过肠壁进入肠道排泄,经肾脏排泄量极少,因此在肾功能不全患者的排泄与健康人群无明显差异,不会引起镧蓄积,其对磷的结合能力与铝相似,但安全性较高。
大量研究显示碳酸镧与碳酸钙降血磷作用相似,前者显著降低血钙及钙磷乘积,其降低PTH的作用与碳酸钙无明显差异。Gonzalez-Parra等[23]对18例CKD 3期且血磷水平正常的患者进行了碳酸镧的前瞻性开放研究,研究对象开始均接受4周的严格限磷饮食,然后加用碳酸镧治疗4周发现,患者血磷水平无显著改变,但碳酸镧显著减少尿磷排泄,降低血FGF-23水平,提示碳酸镧具有控制FGF-23的作用,也有益于减少FGF-23相关心血管并发症。
目前尚无研究评估碳酸镧对血管钙化的影响。3项小型研究比较了碳酸镧与碳酸钙对骨骼组织的作用[24-26]。治疗1年后骨活检显示,碳酸镧组总体骨骼转化情况要优于碳酸钙组,后组无动力型骨病发生率更高。近期Shigematsu等[27]对高磷血症的血透患者进行了为期3年的前瞻性临床研究,治疗期间维持血磷水平在3.5~5.5 mg/dl(1.10~1.78 mmol/L),治疗前后行骨活检、骨组织形态分析发现,碳酸镧治疗1年后,2例原有纤维性骨病的患者骨转化恢复正常,原来正常的患者在3年随访中仍持续正常,2例低转化性骨病的患者病情也得到改善。该研究提示碳酸镧不仅可以治疗高磷血症,还可改善透析患者肾性骨病。
目前尚未证实碳酸镧对患者临床终点事件的影响,未发现碳酸镧与钙盐在改善骨折、生活质量及心血管并发症方面有显著性差异。
碳酸镧治疗组因不良反应而退出研究的患者比例高于其他治疗组(钙盐组)[28,29],碳酸镧组高达14%,而其他药物组仅4%。虽然碳酸镧极少被吸收,但随着时间推移,治疗4.5年后骨活检显示镧沉积逐渐增加。随机研究显示碳酸镧的不良反应与时间相关,但目前治疗随访超过2年的患者数量极少。因此,有待长期随访观察对碳酸镧的安全性做出评价。
总之,碳酸镧的降磷作用与钙盐相似,能显著降低治疗末血钙水平,改善肾性骨病,但对患者临床终点事件、血管钙化、骨骼的影响及其安全性有待深入研究。
SBR759 SBR759是由三价铁离子和淀粉组成的中性、无味无嗅多聚体粉剂,可溶于果汁或饮用水,服用方便,在体内能迅速、选择性与磷紧密结合。
SBR759的疗效已得到肯定。I期临床试验[30]对44例HD患者进行了不同剂量的队列研究(最大剂量22.5 g/d)发现,各组血磷水平均有下降,治疗1周后所有患者均达到K/DOQI的血磷目标值(≤1.7 mmol/L),11.25 g/d和15.0 g/d组血磷较基线平均降低了2.1 mg/dl,对铁蛋白、铁结合力无明显影响。治疗组与对照组血糖、PTH、1,25(OH)2D3及低密度脂蛋白(LDL)水平无显著差异。各组患者均耐受好,主要不良反应为大便颜色改变、腹泻及低钙血症。Chen等[31]对SBR759与司维拉姆的安全性和有效性进行了随机、开放研究,根据血磷水平分别接受不同剂量SBR759或司维拉姆治疗,随后每2周根据K/DOQI指南推荐的目标血磷水平调整药物剂量,发现SBR759组血磷反应优于司维拉姆组(83%vs54%,P<0.0001),两组血钙浓度均无改变,不良反应及严重不良事件发生率类似,但SBR759组总体停药率低于司维拉姆组,胃肠道不良反应发生率较低。
因此,SBR759有望作为优于司维拉姆的非钙非铝型磷结合剂广泛应用,但仍有待更多临床研究证实。
PA21-1 PA21-1也是一种基于三价铁离子的磷结合剂,具有较强的磷结合能力。开放性研究显示[32],CKD 3~4期的非透析患者、MHD患者及健康受试者口服PA21-1(剂量10 g/d,共服用7d)后,前两组血磷水平均较服药前明显降低,未增加机体铁负荷。患者对PA21-1耐受良好,最常见不良反应是轻度腹泻。
考来替兰(MCI-196) MCI-196也是一种阴离子交换树脂,与司维拉姆类似,口服后不被吸收,不含钙盐,可以吸附肠道胆汁酸,既往用于治疗高脂血症,近来发现其为一种新型磷结合剂。
来自意大利的一项共120例HD患者为期3周的研究发现[33],与安慰剂组相比,MCI-196治疗组血磷显著降低;各组血钙变化小且无显著差异,MCI-196治疗组钙磷乘积显著降低,并能显著降低血清全段甲状旁腺素(iPTH)、总胆固醇及LDL水平。日本一项为期2周的双盲、安慰剂对照研究中[34],MCI-196治疗组血磷水平较对照组明显降低,但不影响血钙水平,血钙磷乘积、iPTH及LDL均显著降低。与安慰剂对比,MCI-196不良反应发生率为51.7%(安慰剂组为29.4%),以便秘等消化道反应最常见。
故MCI-196有望成为一种新型的磷结合剂,降低血磷同时不升高血钙并兼具降低LDL的作用,有助降低CKD患者心血管疾病死亡率。但目前尚有待长期、大样本的研究证实其安全性及有效性。
碱式碳酸镁铁(Fermagate) Fermagate是由英国学者研制的一种不含钙盐的碱式碳酸镁铁磷结合剂,其中的镁和铁组成不溶于水的水滑石结构,并呈水晶层状排列,层与层之间由碳酸盐联合,进入体内后,碳酸盐与磷交换,从而降低血磷。体外试验已证实Fermagate对磷具有高亲和力。临床Ⅱ期随机、双盲研究发现,与安慰剂相比,Fermagate能显著降低血磷,但随着剂量增加,不良反应也增多[35]。因此,需要进一步研究来证实该药的有效性及安全性。
小结:司维拉姆、碳酸镧等新型磷结合剂均有良好的降磷作用,并能显著降低血钙水平,但其安全性、对患者临床终点事件以及血管钙化的影响尚不明确,有待大样本研究证实,并因其价格昂贵而使用受限。I期临床试验显示,含铁的磷结合剂SBR759降磷的疗效及耐受性好,价格低廉,有望在临床广泛使用,但仍有待进一步研究证实。PA21-1、MCI-196和Fermagate等药物的疗效也有待大样本及长期随访证实。
1 USRenal Data System:USRDS 2008 Annual Data Report.Chapter 11:Costs of End-Stage Renal Disease.(Accessed April,16,2009,at http://www.usrds.org/2008/pdf N2-11-2008.pdf.)
2 Guerin AP,Blacher J,Pannier B,et al.Impact of aortic stiffness attenuation on survival of patients in end-stage renal failure. Circulation,2001,103(7):987-992.
3 Hruska KA,Mathew S,Lund R,et al.Hyperphosphatemia of chronic kidney disease.Kidney Int,2008,74(2):148-157.
4 Cozzolino M,Brancaccio D,Gallieni M,et al.Pathogenesis of parathyroid hyper-plasia in renal failure.JNephrol,2005,18(1):5-8.
5 Silver J,Levi R.Cellular and molecular mechanisms of secondary hyperparathyroidism.Clin Nephrol,2005,63(2):119-126.
6 Tentori F,Blayney MJ,Albert JM,et al.Mortality risk for dialysis patientswith different levels of serum calcium,phosphorus,and PTH:The Dialysis Outcomes and Practice Patterns Study(DOPPS).Am J Kidney Dis,2008,52(3):519-530.
7 Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis.J Am Soc Nephrol,2004,15(8):2208-2218.
8 Isakova T,Wahl P,Vargas GS,et al.Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease.Kidney Int,2011,79(12):1370-1378.
9 Spasovski G,Massy Z,Vanholder R.Phosphatemetabolism in chronic kidney disease:from pathophysiology to clinicalmanagement.Semin Dial,2009,22(4):357-362.
10 Mathew S,Tustison KS,Sugatani T,et al.The Mechanism of Phosphorus as a Cardiovascular Risk Factor in CKD.J Am Soc Nephrol,2008,19(6):1092-1105.
11 Davies MR,Lund RJ,Mathew S,et al.Low turnover osteodystrophy and vascular calcification are amenable to skeletal anabolism in an animalmodel of chronic kidney disease and themetabolic syndrome.J Am Soc Nephrol,2005,16(4):917-928.
12 Yang H,Curinga G,Giachelli CM.Elevated extracellular calcium levels induce smoothmuscle cellmatrixmineralization in vitro.Kidney Int,2004,66(6):2293-2299.
13 Tonelli M,Pannu N,Manns B.Oral Phosphate Binders in Patients with Kidney Failure.N Engl JMed,2010,362(14):1312-1324.
14 De Broe ME,D'Haese PC.Lanthanum Study Group.Improving outcomes in hyperphosphataemia.Nephrol Dial Transp lant,2004,19(suppl1):i14-18.
15 Navaneethan SD,Palmer SC,Craig JC,et al.Benefits and harms of phosphate binders in CKD:a systematic review of randomized controlled trials.Am JKidney Dis,2009,54(4):619-637.
16 Barreto DV,Barreto F de C,de Carvalho AB,et al.Phosphate binder impact on bone remodeling and coronary calcification-results from the BRiC study.Nephron Clin Pract,2008,110(4):c273-c283.
17 Block GA,Spiegel DM,Ehrlich J,et al.Effects of sevelamer and calcium on coronary artery calcification in patients new to hemodialysis.Kidney Int,2005,68(4):1815-1824.
18 QunibiW,Moustafa M,Muenz LR,et al.A 1-year randomized trial of calcium acetate versus sevelamer on progression of coronary artery calcification in hemodialysis patients with comparable lipid control:The Calcium Acetate Renagel Evaluation-2(CARE-2)study.Am J Kidney Dis,2008,51(6):952-965.
19 Chertow GM,Burke SK,Raggi P.Treat to Goal Working Group. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients.Kidney Int,2002,62(1):245-252.
20 Ferreira A,FrazÃo JM,Monier-Faugere MC,etal.Effects of sevelamer hydrochloride and calcium carbonate on renal osteodystrophy in hemodialysis patients.JAm Soc Nephrol,2008,19(2):405-412.
21 SukiWN,Zabaneh R,Cangiano JL,et al.Effects of sevelamer and calcium-based phosphate binders on mortality in hemodialysis patients.Kidney Int,2007,72(9):1130-1137.
22 Block GA,Raggi P,Bellasi A,et al.Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients.Kidney Int,2007,71(5):438-441.
23 Gonzalez-Parra E,Gonzalez-Casaus ML,Galán A,et al.Lanthanum carbonate reduces FGF23 in chronic kidney disease Stage 3 patients. Nephrol Dial Transplant,2011,26(8):2567-2571.
24 Spasovski GB,Sikole A,Gelev S,et al.Evolution of bone and plasma concentration of lanthanum in dialysis patients before,during1 year of treatmentwith lanthanum carbonate and after 2 years of follow up. Nephrol Dial Transplant,2006,21(8):2217-2224.
25 Malluche HH,Siami GA,Swanepoel C,et al.Improvements in renal osteodystrophy in patients treated with lanthanum carbonate for two years.Clin Nephrol,2008,70(4):284-295.
26 Freemont AJ,Hoyland JA,Denton J.Lanthanum Carbonate SPD405-303 Study Group.The effects of lanthanum carbonate and calcium carbonate on bone abnormalities in patients with end-stage renal disease.Clin Nephrol,2005,64(6):428-437.
27 Shigematsu T,Tokumoto A,Nakaoka A,et al.Effect of lanthanum carbonate treatment on bone in Japanese dialysis patients withhyperphosphatemia.Ther Apher Dial,2011,15(2):176-184.
28 Canadian Agency for Drugs and Technologies in Health.CEDAC final recom-mendation on reconsideration and reasons for recommendation:lanthanum carbonate hydrate,2008.(Accessed March 15,2010,at http://www.cadth.ca/media/cdr/complete/cdr-complete-Fosrenol-February-29-2008.pdf.)
29 Finn WF,Joy MS,Hladik G.Lanthanum Study Group.Efficacy and safety of lanthanum carbonate for reduction of serum phosphorus in patients with chronic renal failure receiving hemodialysis.Clin Nephrol,2004,62(3):193-201.
30 Block GA,Brillhart SL,Persky MS,et al.Efficacy and safety of SBR759,a new iron-based phosphate binder.Kidney Int,2010,77(10),897-903.
31 Chen JB,Chiang SS,Chen HC,etal.Efficacy and safety of SBR759,a novel calcium-free,iron(Ⅲ)-based phosphate binder,in Asian patients undergoing hemodialysis a 12-week,randomized,open-label,dose-titration study versus sevelamer hydrochloride.Nephrology(Carlton),2011,16(8):743-750.
32 Geisser P,Philipp E.PA21:a novel phosphate binder for the treatment of hyperphosphatemia in chronic kidney disease.Clin Nephrol,2010,74(1):4-11.
33 Locatelli F,Dimkovic N,Pontoriero G,et al.Effect of MCI-196 on serum phosphate and cholesterol levels in haemodialysis patients with hyperphosphataemia:a double-blind,randomized,placebo-controlled study.Nephrol Dial Transplant,2010,25(2):574-581.
34 Kurihara S,Tsuruta Y,Akizawa T.Effect of MCI-196(colestilan)as a phosphate binder on hyperphosphataemia in aemodialysis patients:a double-blind,placebo-controlled,short-term trial.Nephrol Dial Transplant,2005,20(2):424-430.
35 McIntyre CW,Pai P,Warwick G,et al.Iron-magnesium hydroxycarbonate(fermagate):a novel non-calcium-containing phosphate binder for the treatment of hyperphosphatemia in chronic hemodialysis patients.Clin J Am Soc Nephrol,2009,4(2):401 -409.
Novel phosphate binders in chronic kidney disease
SHIMing-jun,XIE Hong-lang
Research Institute of Nephrology,Jinling Hospital,Nanjing University of Medicine,Nanjing 210002,China
Chronic kidney disease(CKD)can make kidney function worsening,which in turn leads to the loss of phosphate balance and secondary hyperparathyroidism.The loss of phosphate homeostasis can contribute to cardiovascular diseases caused by vascular calcification,and increase the morbidity and mortality in CKD.The traditional phosphate binders almost contain calcium and aluminum,which have many side effects when the hyperphosphatemia is controlled Sevelamer and lanthanum carbonate are non-calcium-or aluminum-based phosphate binders.They have the same effect in controlling the hyperphosphatemia as traditional agents,and what'smore,they do not result in hypercalcemia,which provide a new future in controlling hyperphosphatemia and at the same time not increasing the risk of vascular calcification.
chronic kidney disease phosphate binders
2011-08-19
(本文编辑 书 实)
南京军区南京总医院全军肾脏病研究所(南京,210002)