乏力,低钾,贫血伴肾功能不全
2011-07-01全军肾脏病研究所学术委员会
全军肾脏病研究所学术委员会
·临床集锦·
乏力,低钾,贫血伴肾功能不全
全军肾脏病研究所学术委员会
49岁女性,以乏力、低钾起病,近半年出现贫血,肾功能不全,无血尿,蛋白尿,无咯血等肺部表现,肾小管间质损害明显,血清核周型抗中性粒细胞胞质抗体(pANCA)阳性,弹性蛋白酶ANCA阳性。肾活检组织学表现为间质性肾炎,可见大量管周毛细血管炎,肾小管炎,伴肾小球废弃,非废弃肾小球病变轻微,免疫病理示寡免疫复合物沉积。甲泼尼龙和环磷酰胺冲击治疗后,血清ANCA转阴,随之肾功能改善,重复肾活检肾小管间质急性病变也明显减轻。结合临床、实验室检查,对免疫抑制治疗反应及两次肾活检组织学特点,最终诊断为ANCA相关性间质肾炎。
间质性肾炎 抗中性粒细胞胞质抗体 免疫抑制治疗
病史摘要
现病史 女性,49岁,因“乏力2年,发现血清肌酐(SCr)升高7月”于2011-01-05入院。
2009年初因乏力发现低血钾(具体不详),予间断补钾治疗。2010年6月因“上呼吸道感染”外院检查发现肝酶及SCr升高(具体不详),予中药汤剂20余付治疗后肝酶下降,但肾功能无改善。7月查血压90/40 mmHg,尿蛋白(±),隐血(-),血红蛋白(Hb)75 g/L,SCr 344.7μmol/L,尿素氮(BUN)23.51 mmol/L,丙氨酸转氨酶(ALT)175 U/L,天冬氨酸转氨酶(AST)330 U/L,球蛋白偏高34.0~45.0 g/L,血钾3.3 mmol/L,IgM 3.82 g/L,IgG 20.1g/L,ANA、抗ds-DNA、血抗体谱阴性,补体正常。予以护肝、间断输血等治疗,仍反复乏力、夜尿频多,肝酶降至正常,肾功能改善,SCr波动于150μmol/L左右。病程中无高血压、水肿、无不规则发热、皮疹、关节痛,无口干、眼干。发病以来,精神、睡眠差,食欲一般,2010年6月起病来体重减轻3~4kg,夜尿4~5次/晚。
既往史 平素体质差。1991年因反酸检查发现“胆汁反流性胃炎”,服用消炎利胆片及中药汤剂治疗;2005年开始自觉频繁“感冒”,每年4~5次,表现为乏力、流涕、打喷嚏,偶有发热、咳嗽、咳痰,自服中成药(具体不详)治疗;否认肝炎、结核等传染病史;2010年7月外院住院期间曾输入2个单位红细胞悬液。
月经史 2001年始出现月经周期紊乱,服用中药调经治疗,2003年完全绝经。
家族史 父母有“高血压”史,父亲有“中风”史,母亲及妹妹均于40岁左右绝经。
体格检查 血压100/70 mmHg,慢性病容,贫血貌,需搀扶行走,步态拖曳,全身皮肤、黏膜无皮疹及黄染,未触及浅表淋巴结,心、肺、腹无异常,双下肢无水肿,四肢肌力5-级,生理反射存在,病理征阴性。
实验室检查
尿液 尿蛋白定量0.18 g/d,尿红细胞计数1.0万/ml,尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)33 U/(g·cr),视黄醇结合蛋白(RBP)0.23 mg/L,溶菌酶0.97 mg/L,中性粒细胞明胶酶相关脂质运载蛋白(NAGL)23.56μg/L,肾损伤分子1(KIM-1)0.53μg/L,IL-18 32.27 ng/L,尿渗量 536 mOsm/(kg·H2O),24h尿葡萄糖0.19 mmol/L,尿氨基酸59.5 mg/24h,钠滤过分数1.89%,肾衰指数2.61。尿液理化性质六项分析:pH值6.60,HCO3-18.0 mmol/L,TA 13.0 mmol/L,NH4+37.0 mmol/L,NAC 32.0 mmol/L,NH4+/TA 2.85。
血常规 Hb 106 g/L,红细胞比容0.345,MCH 30.1 pg,MCHC 307 g/L,白细胞计数4.44×109/L,血小板145×109/L,网织红细胞0.010。
血生化 白蛋白40.7 g/L,球蛋白35.8 g/L,BUN 5.9 mmol/L,SCr 132.6μmol/L,尿酸557 μmol/L,ALT 81 U/L,AST 66 U/L,乳酸脱氢酶(LDH)139 U/L,总胆固醇(TC)14.26 mmol/L,三酰甘油(TG)1.27mmol/L,钠138.6mmol/L,钾3.3 mmol/L,氯103.2 mmol/L,TCO224.4 mmol/L,C反应蛋白0.1 mg/L,空腹血糖4.69 mmol/L。
免疫学 pANCA 1∶320阳性,ANA、A-dsDNA、血抗体谱、cANCA、MPO-ANCA,PR3-ANCA、自身免疫性肝病抗体、抗组织细胞抗体肝病组合均阴性。抗心磷脂抗体谱:IgM 82.83 MPL-U/ml,IgA、IgG(-)。补体C3 0.782 g/L,C4 0.162 g/L,IgG 22.6 g/L,IgA 2.39 g/L,IgM 3.17 g/L,IgE<20 IU/ml,ASO<25 IU/ml,RF<20 IU/ml,狼疮样抗凝因子阴性。自身免疫性肝炎相关抗体阴性。甲状腺自身抗体:抗甲状腺球蛋白抗体11.2(正常值阴性),甲状腺微粒体抗体10.5(正常值阴性),甲状腺过氧化物酶抗体125.9 IU/ml(正常值<100 IU/ml),促甲状腺激素受体抗体3.0 IU/ml(正常值0~14.0 IU/ml)。免疫固定电泳未见单克隆免疫球蛋白条带。
内皮损伤指标:循环内皮细胞27个/ml,黏附分子VCAM 1 606.02 ng/ml,血栓调节蛋白9.62 ng/ml,血管性假血友病因子(vWF)207.6%,E选择素:80.7 ng/ml。
外周血淋巴细胞亚群:CD4+556个/ul,CD8+827个/ul,CD3+1 500个/ul,CD20+108个/ul。
溶血检查 直接抗人球蛋白试验阴性,血清结合珠蛋白65 mgHb%,游离血红蛋白1.9 mg%。
其他 传染病:HbsAb(+),HbeAb(+),HbcAb(+),余(-)。甲状腺功能:正常。骨髓穿刺:骨髓象大致正常。骨髓活检病理:骨髓增生活跃,伴局灶纤维组织(网状纤维)轻度增生。
辅助检查
肾脏超声:左肾96 mm×36 mm×48 mm,右肾99 mm×27 mm×49 mm,双肾轮廓规则,包膜连续完整,皮质回声正常,肾皮质厚度不清,皮髓界限清楚,双肾内未见肾盂肾盏扩张。
心电图大致正常。CT:(1)两侧上颌窦及筛窦炎;(2)两侧下鼻甲肥大;(3)胸部CT正常。甲状腺超声:双侧甲状腺多发性包块,腺瘤可能。消化系统超声:肝囊肿,胆囊息肉,胰脾、门静脉彩色多普勒检查未见异常。心脏超声:左室舒张功能降低。眼底:结膜、巩膜等均未见明显异常,泪膜破裂时间、滤纸条试验阴性。肌电图:未见明显异常
肾活检
免疫荧光及免疫组化 免疫荧光IgA++、C3 +,弥漫分布,呈节段散在分布于系膜区。C1q+ +,弥漫分布,呈颗粒状沉积于系膜区和血管袢,IgG、IgM阴性。C4d阴性;CD138皮质间质404/mm2,肾小球阴性;HLA-DR皮质肾小管0。CD31管周毛细血管阳性。未见明显中性粒细胞浸润,抗中性粒细胞弹性蛋白酶抗体阴性。
光镜 皮质肾组织2条。肾小管间质病变重,间质大量浆细胞、单个核细胞弥漫浸润,偶见多核巨细胞,大量管周毛细血管炎及肾小管炎,多处灶性肾小管上皮细胞扁平、刷状缘脱落,管腔内少量蛋白管型。数处灶性肾小管萎缩、基膜增厚;间质纤维化+ +。34个肾小球中18个球性废弃,未废弃肾小球病变轻微,仅见节段系膜区轻度增宽,系膜细胞和基质增多,多处袢开放尚好,少数节段袢皱缩明显,包囊腔内见渗出,囊壁节段增厚、分层。小叶间动脉弹力层增厚、分层(图1)。
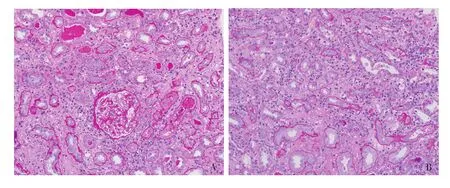
图1 第1次肾活检肾小球病变轻,肾间质大量单个核及浆细胞浸润,较多肾小管炎及管周毛细血管炎,管腔内见蛋白管型及细胞管型(PAS,×200)
电镜 电镜观察1个肾小球,袢开放欠佳,多数基膜扭曲、皱缩,开放的毛细血管袢基膜无分层,基膜厚度280~580 nm,内皮下、上皮侧无电子致密物沉积;系膜区略增宽,无电子致密物分布。少数足细胞胞浆微绒毛化,足突节段融合30%~40%。近端肾小管和远端肾小管见淋巴细胞性肾小管炎,数处毁损的肾小管仅残留的基膜,并见基膜断裂,肾小管基膜未见电子致密物沉积。间质区域显著增宽,大量淋巴细胞浸润,亦见浆细胞。管周毛细血管基膜未见断裂,亦无电子致密物沉积。
诊断分析 该患者病史特点如下:(1)中年女性,起病隐匿,病程迁延;(2)近20年长期服中药(包括汤剂及中成药)治疗“胆汁反流性胃炎”及“月经紊乱”;(3)肾脏损害以夜尿增多,低钾起病,7月前因“上感”服中药后发现肾功能不全,SCr最高达344μmol/L,伴低钾,贫血,肝酶升高,无高血压、水肿,无蛋白尿,镜下血尿,停服中药后未予特殊治疗,SCr降至150μmol/L;(4)尿检以肾小管间质损害为主,低渗尿,尿酸化功能障碍,尿NAG升高,无蛋白尿,血尿;(5)血清学检查多种自身抗体阳性(pANCA,ACL-IgM和甲状腺抗过氧化物酶抗体),高球蛋白血症;(6)肾活检病理:肾小管间质慢性病变基础上伴有急性间质性肾炎,肾小球病变较轻。
从上述病史特点可见该患者肾脏病变突出表现为肾小管间质损害,结合临床表现、实验室检查及肾组织病理改变,可以排除感染、血液系统肿瘤、浆细胞病等原因。其肾小管间质损害原发病考虑两种可能性大:(1)长期服药史(包括中药汤剂及中成药),临床高度考虑药物相关;(2)血清学检查示高球蛋白血症,pANCA高滴度阳性,ACL-IgM阳性,甲状腺抗过氧化物酶抗体阳性,提示可能与自身免疫性疾病相关。
药物相关肾小管间质损害 该患者近20年长期服用中药(包括汤剂及中成药)治疗“胆汁反流性胃炎”及“月经紊乱”史,临床高度考虑肾小管间质损害与相关药物,该情形有以下三种可能:(1)药物的直接损伤:很多药物可直接损伤肾小管上皮细胞,尤其是近端小管上皮细胞。该患者所服用药物中未问及有明确肾毒性成分,肾活检病理表现为急性间质性肾炎,不符合药物直接肾小管毒性的表现。(2)过敏性间质性肾炎:该患者无发热,皮疹和关节痛,无血、尿嗜酸性细胞增多等过敏表现,入院时已停用所有药物7月,肾活检病理仍有急性间质性肾炎表现,此外以上两种可能均无法解释患者同时存在的ANCA及其它自身抗体阳性等现象,因此临床上不考虑药物所致的直接毒性作用及过敏所致的急性间质性肾炎。(3)药物所致ANCA相关性间质性肾炎:最常见于丙基硫氧嘧啶(PTU)[1-3],主要诱发MPO-ANCA,也可产生针对PR3、乳铁蛋白、弹性蛋白酶等的抗体,临床上多表现为坏死性肾小球肾炎及新月体肾炎,但药物导致ANCA阳性和间质性肾炎也屡有报道,如质子泵抑制剂,非甾体类抗炎药,少数抗菌素及别嘌呤醇,西米替丁,苯妥因钠等[4-7],但临床上也大多有皮疹,关节痛,发热等全身过敏症状,并以MPO-ANCA多见,一般在停药后ANCA滴度下降。而本例患者临床上无全身过敏表现,近7月无特殊用药史,ANCA仍高滴度阳性,肾活检病理仍为急性间质性肾炎病变,并且难以解释同时存在其他自身抗体阳性,因此临床上也不支持药物导致ANCA相关性急性间质性肾炎。综上所述,该患者由药物导致以上三种肾小管间质急性损害可能性不大,但患者用药史复杂且时间长达近20年,不能排除药物因素同时参与肾小管间质慢性损害。
自身免疫性间质性肾炎 该患者有高球蛋白血症,pANCA高滴度阳性,ACL-IgM和甲状腺抗过氧化物酶抗体阳性等多种免疫学异常,提示可能存在自身免疫性疾病。导致自身免疫性间质性肾炎常见疾病有系统性红斑狼疮,干燥综合征,类风湿性关节炎等,但该患者无这些疾病的临床表现及特征性血清学改变。pANCA高滴度阳性应考虑ANCA相关性血管炎的可能,但通常临床表现为急进性肾炎综合征,肾脏病理表现为节段坏死性肾小球肾炎或新月体肾炎。而本例以肾小管间质损害为主,临床上无血尿和蛋白尿,肾小球病变轻。复习相关文献发现,部分ANCA阳性患者可单纯表现为间质性肾炎[8,9],该患者的临床和病理特点与之相符,故诊断为ANCA相关间质性肾炎。
治疗及随访 入院后予促红细胞生成素,铁剂治疗贫血,虫草制剂,大黄,复方α酮酸保肾,多烯磷酯酰胆碱保肝,补钾等治疗,明确诊断后给予甲泼尼龙(MP)24 mg/d治疗。1月后第一次随访,复查pANCA 1∶160,SCr 113.15μmol/L,Hb 91 g/L,WBC 2.8×109/L,PLT 99×109/L。因患者病情仍未缓解再次收入院,予MP 1.5g及环磷酰胺(CTX)0.6g静脉冲击治疗后,乏力症状明显改善,血小板、白细胞恢复正常,SCr降至93.70μmol/L,出院后继予MP 24 mg/d及纠正贫血等治疗。1月后MP减量,并再次予CTX 1g静滴。5月初因并发右下肢“带状疱疹”未予CTX冲击治疗,MP减量至12mg/d,6月10日第三次入院复查Hb 106 g/L,WBC 3.8×109/L,PLT 147×109/L,SCr88.4μmol/L,cANCA、pANCA、ANCA谱阴性,重复肾活检肾脏病理提示与2011年1月切片相比:肾间质炎性细胞浸润及肾小管急性损伤减轻;仍见灶性管周毛细血管炎(图2),肾小球轻度系膜增生性病变,球性废弃(1/20)。入院后MP片减至8 mg/d,并于6月17日行第3次CTX冲击治疗,剂量为0.8g,累积总量为2.4g。患者经MP及CTX冲击治疗后,ANCA滴度下降至最后转阴,随之一般状况及肾功能明显改善,进一步证实ANCA相关性间质性肾炎的诊断(图3)。
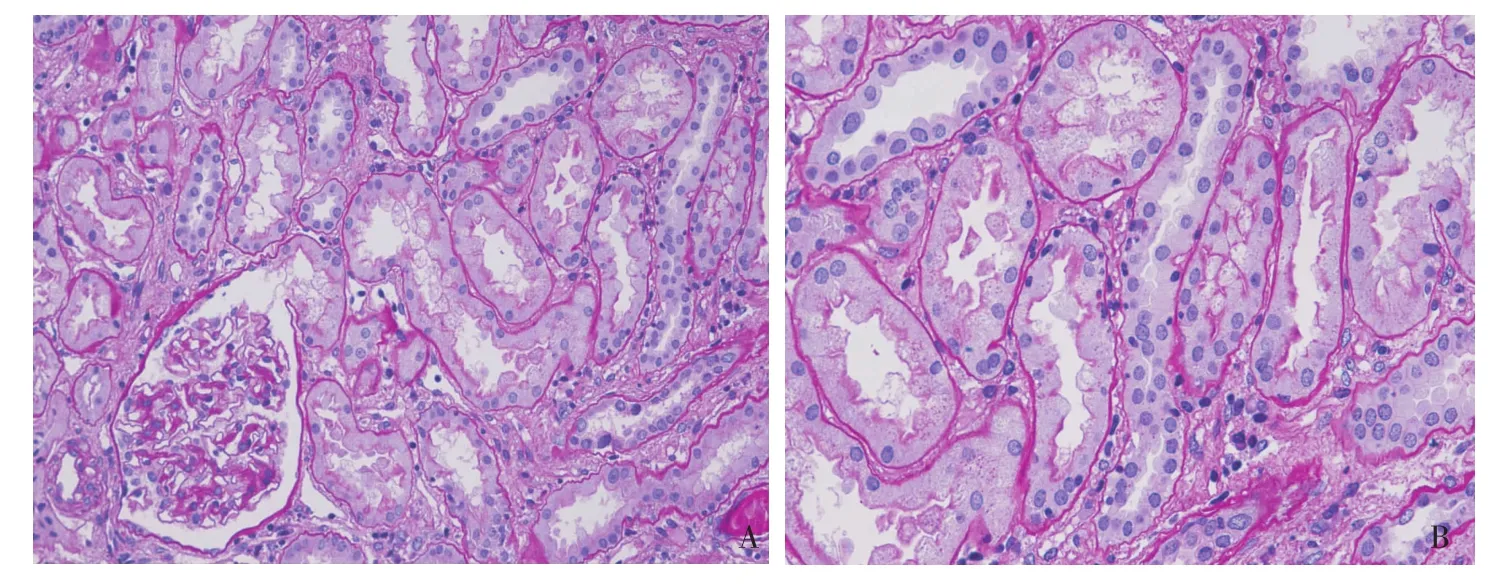
图2 第2次肾活检肾间质浸润细胞明显减少,仍见灶性管周毛细血管炎(PAS,×200)
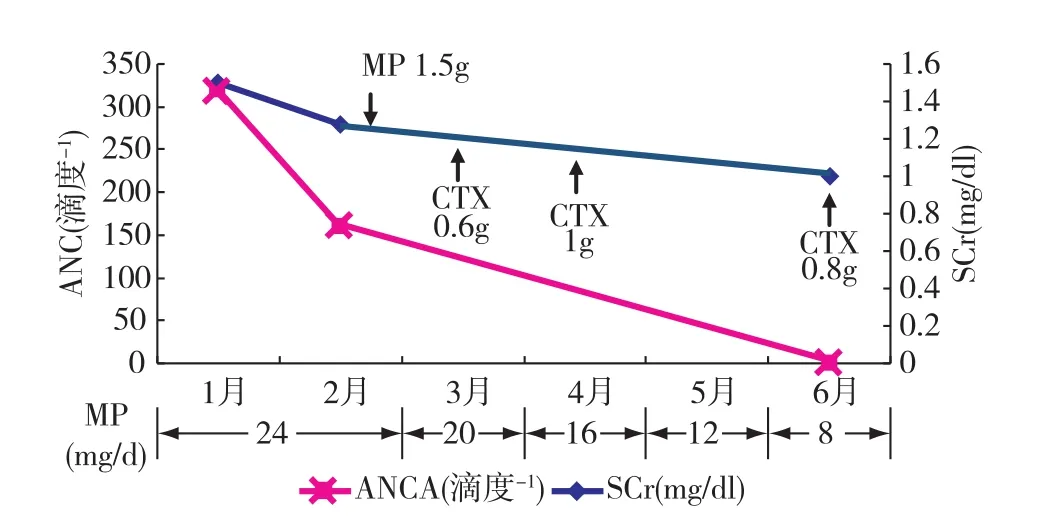
图3 患者住院期间及随访过程中免疫抑制治疗与SCr及ANCA滴度变化
讨 论
ANCA相关性间质性肾炎的诊断 ANCA是针对中性粒细胞及单核细胞胞质成分的一种自身抗体,最早由Davies等[10]于1982年采用间接免疫荧光法在坏死性肾小球肾炎患者的血清中首次发现。1985年,Van der Woude等[11]首次证明Wegener肉芽肿与ANCA相关。随后研究进一步发现ANCA类型为胞质型(cANCA),其针对的靶抗原为蛋白酶3(PR3)。1989年,Jennette等[12]发现了核周型ANCA(pANCA),ANCA的其他靶抗原如髓过氧化物酶(MPO)、细菌渗透/增强蛋白(BPI)等相继被发现。
本例患者临床表现为肾小管间质损害,肾活检病理提示为急性间质性肾炎,血清检查示pANCA高滴度阳性,同时存在高球蛋白血症,ACL-IgM阳性,甲状腺抗过氧化物酶抗体阳性,因此高度提示为自身免疫性相关性肾损害。予MP及CTX冲击治疗后,ANCA滴度下降至最后转阴,随之一般状况及肾功能明显改善,重复肾活检病理示肾小管间质急性病变较前明显减轻,进一步提示该患者肾脏损害与ANCA相关。一般来说,ANCA相关性血管炎患者大都临床表现为急进性肾炎综合征,肾组织形态学以节段坏死性肾小球肾炎和新月体肾炎常见,可同时伴有肾小管炎和间质大量炎细胞浸润[13,14]。而本例患者单纯以肾小管间质损害为主,临床上无血尿,蛋白尿,肾活检病理肾小球病变轻,是否为一特殊类型的ANCA相关性血管炎呢?Banerjee等[15]曾报道了1例Wegener肉芽肿患者,以急性肾功能衰竭起病,尿检仅为少量镜下血尿伴白细胞尿,肾脏表现为急性间质性肾炎,2个月后重复肾活检方见到肾小球节段坏死性病变。而该患者临床上无多器官等受累表现,肾间质未见肉芽肿样病变,重复肾活检仍未见肾小球袢坏死和新月体形成,因而不支持Wegener肉芽肿或其他常见累及肾小球的ANCA相关性血管炎。那么是否存在单纯表现为间质性肾炎的ANCA相关性血管炎呢?
2005年Schonermarck等[8]报道1例75岁女性,临床表现为体重下降,贫血,轻度肾功能不全,无其他系统损害表现,尿检示少量蛋白尿及镜下血尿,血清PR3-ANCA高滴度阳性,肾活检病理示间质性肾炎,肾小球基本正常伴少数球性硬化,该作者认为此例间质性肾炎患者可能是ANCA相关性疾病的一种少见形式,同时也指出球性硬化病变不排除疾病早期可能存在肾小球受累。2009年Nakabayashi等[9]报道3例ANCA相关性间质性肾炎,所有患者均为MPO-ANCA阳性,肾小球病变轻微,无新月体及袢坏死,肾组织主要表现间质性肾炎,可见间质、管周毛细血管和小管的单个核细胞浸润,偶见小管基膜断裂,电镜下见管周毛细血管壁断裂,该作者同时还对单纯表现为间质性肾炎的ANCA相关性血管炎的发病机制进行了初步探讨。
本例患者肾活检病理提示为急性间质性肾炎,血清检查示ANCA高滴度阳性,经免疫抑制治疗后,ANCA滴度下降至最后转阴,一般状况及肾功能随之明显改善,重复肾活检病理示肾小管间质急性病变较前明显减轻,不支持药物导致的肾小管间质损害。因此,结合患者临床病理特点以及对免疫抑制治疗的反应,最终诊断考虑为ANCA相关性间质性肾炎。此外本例患者为pANCA阳性,而ELISA法检测MPO-ANCA和PR3-ANCA均阴性,但ANCA针对的抗原还包括杀菌渗透增强蛋白、弹性蛋白酶、溶菌酶、组织蛋白酶、乳铁蛋白等,因此我们进一步进行ANCA酶谱的检测,发现弹性蛋白酶ANCA阳性,弹性蛋白酶ANCA导致小管间质损害目前尚无文献报道。
ANCA相关性间质性肾炎发病机制 ANCA不仅是诊断小血管炎的血清标记物,临床、动物实验和体外研究均证明ANCA具有直接致病性。ANCA通过与中性粒细胞、内皮细胞及靶抗原的相互作用,导致血管损伤[16,17]。
ANCA相关性血管炎一般主要影响小血管及毛细血管,通常在肾脏和肺诱发坏死性血管炎。肾脏典型病理改变为坏死性肾小球肾炎和新月体肾炎,同时大多合并不同程度的肾小管间质病变,这些病变认为与新月体形成致鲍曼氏囊断裂,间质小动脉炎/动脉炎,静脉炎,肾小管炎或间质浸润炎症细胞分泌的细胞因子相关[18,19],然而肾小管管周毛细血管炎在ANCA相关性血管炎肾小管间质病变中所起的作用并未引起关注。Nakabayashi等[9]报道3例ANCA相关性间质性肾炎肾活检病理见肾小球无病变,未见小动脉炎,动脉炎及静脉炎,但可见明显肾小管炎,作者认为这3例患者肾小管间质病变与肾小管炎及管周毛细血管炎有关。通过对这3例患者肾组织MPO,内皮细胞标记CD34及Ⅳ型胶原(毛细血管基膜)染色以及超微结构研究发现,肾小管和管周毛细血管内的中性粒细胞MPO阳性,部分间质管周毛细血管CD34染色缺失,Ⅳ型胶原染色示皱缩或缺失,管周毛细血管基膜断裂及管周毛细血管腔及周围间质中性粒细胞和单核细胞浸润,从而证实这3例患者存在管周毛细血管炎,且CD34染色缺失可出现在间质仅有少量炎细胞浸润且尚未出现Ⅳ胶原破坏的血管炎早期阶段。推测由于活化和浸润的中性粒细胞释放大量MPO,蛋白水解酶和氧自由基,导致内皮细胞损伤,失去CD34表面标记,进而使管周毛细血管基膜断裂。但有趣的是作者同时发现在这3例患者肾小球毛细血管CD34及Ⅳ型胶原染色未见异常,为何MPO只对管周毛细血管具有破坏作用而对肾小球毛细血管无影响,目前认为可能与MPO的不同表型和不同的组织亲合性有关[20]。
本例患者第一次肾活检病理可见间质单个核及浆细胞浸润,大量小管炎及管周毛细血管炎,经免疫抑制治疗后,ANCA滴度下降,肾功能改善,第二次肾活检病理见以上病变明显减轻,从而进一步证实肾小管炎,管周毛细血管炎在ANCA相关性间质性肾小管间质病变中所起的重要作用。但本例患者肾活检病理除可见间质单个核及浆细胞浸润,肾小管炎和管周毛细血管炎,我们并未发现管周毛细血管壁的断裂,肾组织CD31(另一种内皮细胞标志物)的染色未见管周毛血管内皮细胞表达缺失,仅在超微结构下观察到1处肾小管基膜出现断裂。为何本例患者间质管周毛细血管病变与原先报道存在差别,是否不同ANCA谱所致小管间质损伤存在不同的发病机制有待于进一步研究。
小结:ANCA相关性血管炎患者大都临床表现为急进性肾炎综合征,肾组织形态学以节段坏死性肾小球肾炎和新月体肾炎常见,可同时伴有肾小管炎和间质大量炎细胞浸润。而本例ANCA相关性血管炎患者单纯以肾小管间质损害为主,临床上无血尿,蛋白尿,肾活检病理肾小球病变轻,而表现为肾小管间质慢性病变基础上伴有急性间质性肾炎,诊断为ANCA相关性间质肾炎,其发病机制可能与肾小管炎及管周毛细血管炎有关。
(吴 燕 侯金花 整理)
1 Gao Y,Chen M,Ye H,et al.The target antigens of antineutrophil cytoplasmic antibodies(ANCA)induce by propylthiouracil.Int Immunopharmacol,2007,7(1):55-60.
2 Zhang AH,Chen M,Gao Y,et al.Inhibition of oxidation activity of myeloperoxidase(MPO)by propylthiouracil(PTU)and anti-MPO antibodies from patients with PTU-induced vasculitis.Clin Immunol,2007,122(2):187-193.
3 Zhao MH,Chen M,Gao Y,et al.Propylthiouracil-induced antineutrophil cytoplasmic antibody-associated vasculitis.Kidney Int,2006,69(8):1477-1481.
4 Singer S,Parry RG,Deodhar HA,et al.Acute interstitialnephritis,omeprazole and antineutrophil cytoplasmic antibodies.Clin Nephrol. 1994,42(4):280.
5 Sakai N,Wada T,Shimizu M,et al.Tubulointerstitial nephritis with anti-neutrophil cytoplasmic antibody following indomethacin treatment.Nephrol Dial Transplant,1999,14(11):2774.
6 Shih DJ,Korbet SM,Rydel JJ,et al.Renal vasculitis asociated with ciprofloxacin.Am JKidney Dis,1995,26(3):516-519.
7 Kitahara T,Hiromura K,Sugawara M,et al.A case of cinetidineinduced acute tubulointerstitial nephritisassociated with antineutrophil cytoplasmic antibody.Am JKidney Dis,1999,33(2):E7.
8 Schönermarck U,Schirren CA,Mistry-Burchardi N,et al.Interstitial nephritis and high titers of PR3-ANCA:an unusual manifestation of ANCA-associated disease.Clin Nephrol,2005,64(5):383-386.
9 Nakabayashi K,Sumiishi A,Sano K,et al.Tubulointerstitial nephritis without glomerular lesions in three patients with myeloperoxidase-ANCA-associated vasculitis.Clin Exp Nephrol,2009,13(6):605 -613.
10 Davies DJ,Moran JE,Niall JF,et al.Necrotizing glomerulonephritis with antineutrphil antibody:possible arbovirus aetiology.BMJ,1982,285(6342):606.
11 van der Woude FJ,Rasmussen N,Lobatto S,et al.Autoantibodies against neutrophils and monocytes:tool for diagnosis and marker of disease activity in Wegener's granulomatosis.Lancet,1985,1(8426):425-429.
12 Jennette JC,Wilkman AS,Falk RJ.Anti-neutrophil cytoplasmic autoantibody-associated glomerulonephritis and vasculitis.Am J Pathol,1989,135(5):921-930.
13胡伟新,黎磊石.统性血管炎肾脏损害.黎磊石,刘志红.//中国肾脏病学.北京:人民军医出版社.2008,523-548.
14 Savige J,Davies D,Falk RJ,et al.Antineutrophil cytoplasmic antibodies and associated diseases:a review of the clinical and laboratory features.Kidney Int,2000,57(3):846-862.
15 Banerjee A,McKane W,Thiru S,et al.Wegener's granulomatosis presenting as acute suppurative interstitial nephritis.J Clin Pathol,2001,54(10):787-789.
16 Jennette JC,Falk RJ.New insight into the pathogenesis of vasculitis associated with antineutrophil cytoplasmic autoantibodies.Curr Opin Rheumatol,2008,20(1):55-60.
17 Morgan MD,Harper L,William J,et al.Anti-neutrophil cytoplasmassociated glomerulonephritis.J Am Nephrom,2006,17(5):1224 -1234.
18 Jennette JC,Thomas DB.Pauci-immune and antineutrophilcytoplasmic autoantibody-mediated crescentic glomerulonephritis and vasculitis// Jennette JC,Olson JL,Schwartz MM,Silvia FG,editors.The Heptinstall's pathology of the kidney.Philadelphia:Lippincott Williams&Wilkins,2007:643-673.
19 Seshan SV,D'Agati VD,Appel GA,et al.Renal vasculitis:classification and atlas of tubulointerstitial and vascular diseases// Seshan SV,D'Agati VD,Appel GA,Churg J,editors.Renal disease. Baltimore:Williams&Wilkins,1999:373-386.
20 Fujii A,Tomizawa K,Arimura Y,et al.Epitope analysis of myeloperoxidase(MPO)specific anti-neutrophil cytoplasmic autoantibodies(ANCA)in MPO-ANCA-associated glomerulonephritis. Clin Nephrol,2000,53(4):242-252.
Fatigue,hypopotassem ia,anem ia and renal function
Academic Committee of Research Institute of Nephrology
Research Institute of Nephrology,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210002,China
A 49-year female was presented with fatigue,hypopotassemia,anemia,and renal dysfunction for half a year.The laboratary investigation showed tubulointerstitial injury without proteinuria and hemoturia.Serum pANCA and Elastase ANCA were positive.The renal histological examination demonstrated tubulointerstitial nephritis with peritubular capillaritis,tubulitis and some obsolescent,but otherwise near normal glomeruli.Immunoflurescence study indicated pauciimmune deposits.After immunosuppressive treatment,serum ANCA turned negative and renal function was remarkably improved.Repeat biopsy showed that the interstitial inflammation was significantly ameliorated.Finally,ANCA associated tubulointerstitial nephritis was diagnosed.
anti-neutrophil cytoplasmic antibodies tubulointerstitial nephritis immunosuppressive treatment
2011-10-15
(本文编辑 凡 心 律 舟)
南京军区南京总医院全军肾脏病研究所(南京,210002)