心脏瓣膜钙化对维持性血液透析患者远期预后的影响
2011-07-01钟波那宇
钟 波 那 宇
心脏瓣膜钙化对维持性血液透析患者远期预后的影响
钟 波 那 宇
目的:评估终末期肾病维持性血液透析(MHD)患者心脏瓣膜钙化对死亡率和死亡原因的影响。
方法:96例MHD患者中男性55例,女性41例,平均年龄55±12岁,平均透析时间57±30周。全部患者行超声心动图检查,根据有无心脏主动脉瓣和二尖瓣钙化将其分为瓣膜钙化组(31例)和无瓣膜钙化组(65例)。
结果:瓣膜钙化组和无瓣膜钙化组1年存活率分别为75%和95%(P<0.01)。瓣膜钙化组患者年龄大,糖尿病比例高,粥样硬化性血管疾病发生率高;实验室检查证实C反应蛋白、血清钙、血清磷和甲状旁腺激素水平均高于无瓣膜钙化组患者,而血清白蛋白低于后组;两组左室射血分数无差异。全部患者平均随访75周(12~40周),随访期间死亡25例,两组心血管疾病死亡率分别为25.8%和6.1%(P<0.01),多变量COX回归分析发现:心脏瓣膜钙化是预测非心血管源性死亡(HR 2.23,95%CI 1.02~4.25,P<0.01)及心血管源性死亡(HR 3.50,95%CI2.23~5.52,P<0.01)的独立危险因素,且与年龄、性别、透析时间、C反应蛋白水平及是否合并粥样硬化性血管疾病或糖尿病存在相关性。 结论:MHD患者有无心脏瓣膜钙化对心血管源性及非心血管源性死亡预测具有意义。
血液透析 心脏瓣膜钙化 死亡率 预后
慢性肾脏病患者血管及瓣膜钙化发生率很高。CT扫描证实约2/3维持性血液透析(MHD)患者存在不同程度的冠状动脉钙化,50%以上患者存在心脏瓣膜钙化[1,2]。心脏瓣膜钙化与年龄无关,青年MHD患者即可出现严重血管钙化,尤其冠状动脉钙化,并在透析治疗后继续进展。因此,对MHD患者钙化评分较年龄和性别因素预测心血管事件的发生更有价值。心血管系统钙化是动脉粥样硬化的标志,也是诱发心肌缺血、充血性心力衰竭、心脏瓣膜损伤、心律失常等系列心血管病危险因素的主要指标。本研究应用超声心动图评估心脏瓣膜钙化的性状和程度,分析心脏瓣膜钙化对MHD患者心血管及其他原因死亡率的影响。
对象和方法
研究对象 选择2005年~2010年解放军306医院肾内科透析时间>4月的MHD患者96例,其中男性55例,女性41例,平均年龄55±12岁。终末期肾病的原发病包括:慢性肾小球肾炎28例,糖尿病肾病26例,高血压肾硬化14例,梗阻性肾病4例,多囊肾2例,另22例原发病不明。进入本研究患者均除外合并以下疾病:陈旧心肌梗塞;先天性心脏病;心房纤颤或心房扑动;高度心脏传导阻滞或起搏器置入;慢性阻塞性肺病;严重肝脏疾病及恶性肿瘤。入选患者均被告知并完全同意参与本次观察。
研究方法
透析方法 所有患者均采用高通量透析,每周透析3次,每次4h。F60聚砜膜透析器(Fresenius),面积1.3m2、超滤系数40 ml/(mmHg·h),碳酸氢钠透析液,透析液流量500 mL/min,普通肝素抗凝,血流量200~300 ml/min。透析前记录患者体重、血压、心率及体温;透析中每小时测血压、脉搏、动脉和静脉管路压力、血流量、跨膜压和超滤率,透析后记录体重、血压、心率和体温。
心脏超声检查 纳入病例均行心脏彩色多普勒超声检查评估心脏瓣膜钙化的性状和程度、观察血流动力学参数;监测心脏各项功能;分别测量主动脉宽度、各房室内径及室间隔厚度。多普勒血流:收缩、舒张期二、三尖瓣口血流频谱E、A峰值;左室射血分数主动脉瓣及肺动脉瓣,各瓣膜口是否探及返流和其他异常信号。心脏瓣膜钙化定义为:主动脉瓣或二尖瓣出现一个或多个环面亮回声超过1 mm[3]。动脉瓣钙化严重程度定义:主动脉瓣瓣叶增厚,心脏收缩时瓣膜开放程度下降以及通过瓣膜时血流速率增快(2.5 m/s),当血流喷射速率在3~4 m/s时,为中度主动脉瓣硬化;若血流喷射速率>4 m/s,则为重度主动脉瓣钙化。二尖瓣钙化定义:二尖瓣瓣叶增厚,心脏收缩时瓣膜开放减弱。二尖瓣钙化严重性评估:心脏收缩半程,瓣膜接受压力的情况下,二尖瓣瓣膜区1~1.5 cm2,为中度二尖瓣钙化,二尖瓣瓣膜区小于1 cm2,为重度二尖瓣钙化。
疾病诊断标准 糖尿病采用1999年WHO诊断标准[4];高血压按2010年《中国高血压防治指南》修订版标准诊断[5],非同日测量三次血压,收缩压≥140 mmHg和(或)舒张压≥90 mmHg;动脉粥样硬化性血管疾病定义:存在缺血性心脏病或心绞痛发作史、既往心肌梗塞病史、冠状动脉旁路成形术后、冠状动脉支架植入术后、脑血管事件、一过性脑缺血发作以及外周血管疾病伴或不伴截肢术。心血管源性死亡定义:与明确的心肌缺血事件直接相关的死亡、心衰、恶性心律失常、脑血管意外和外周血管疾病等,均严格参照相应的临床诊断标准诊断[6]。其他如出血、感染、营养不良、肿瘤、肝功能衰竭、慢性阻塞性肺病及终止治疗等原因导致的死亡定义为非心血管源性死亡。心脏性猝死定义为由心脏原因引起的突然死亡,从先兆症状发生1h内,意识丧失。
实验室检查 观察期内每月一次于透析前留取血液标本,常规方法检测血红蛋白含量、血尿素氮、血清肌酐,总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇,C反应蛋白(CRP),甲状旁腺激素等。
随访分析 随访期间所有死亡病例均由经治主治医师提供详细的死亡原因及相关医学资料,同时要求该医师回避心脏彩超的结果。院外死亡病例,须详细咨询患者死亡时具体情况,客观获取患者死亡资料。临床结果评估分为心血管源性死亡和非心血管源性死亡。
统计方法 采用SPSS 13.0评估版统计学软件进行数据分析,连续性变量采用均数±标准差描述,组间比较采用非配对T检验分析。使用Kaplan-Meier生存分析法拟和生存曲线,多变量COX比例危险率回归模型分析相关变量远期预后(死亡)的相对危险程度。死亡危险性用相对危险系数(HR)和95%可信区间(95%CI)表示,P<0.05为统计学显著性差异。
结 果
临床基本资料 96例患者中31例(32.3%)经超声检查发现心脏瓣膜钙化(瓣膜钙化组):有二尖瓣钙化者30例,有主动脉瓣钙化者9例,其中8例同时存在二尖瓣和主动脉瓣钙化;65(67.7%)例患者未发现心脏瓣膜钙化(无瓣膜钙化组)。两组性别构成、体质量指数、透析时间等均无差异,但瓣膜钙化组年龄明显高于无瓣膜钙化组(<0.001),糖尿病比例更高,粥样硬化性血管疾病的发生率亦高。两组患者的血压和血脂水平无差异,瓣膜钙化组CRP、血清钙、血清磷和甲状旁腺激素均显著高于无瓣膜钙化组,血清白蛋白更低(表1)。所有病例均无二尖瓣狭窄和重度主动脉瓣狭窄。瓣膜钙化组与无瓣膜钙化组左室射血分数无明显差异[(62± 12)%vs(64±12)%,P>0.05]。
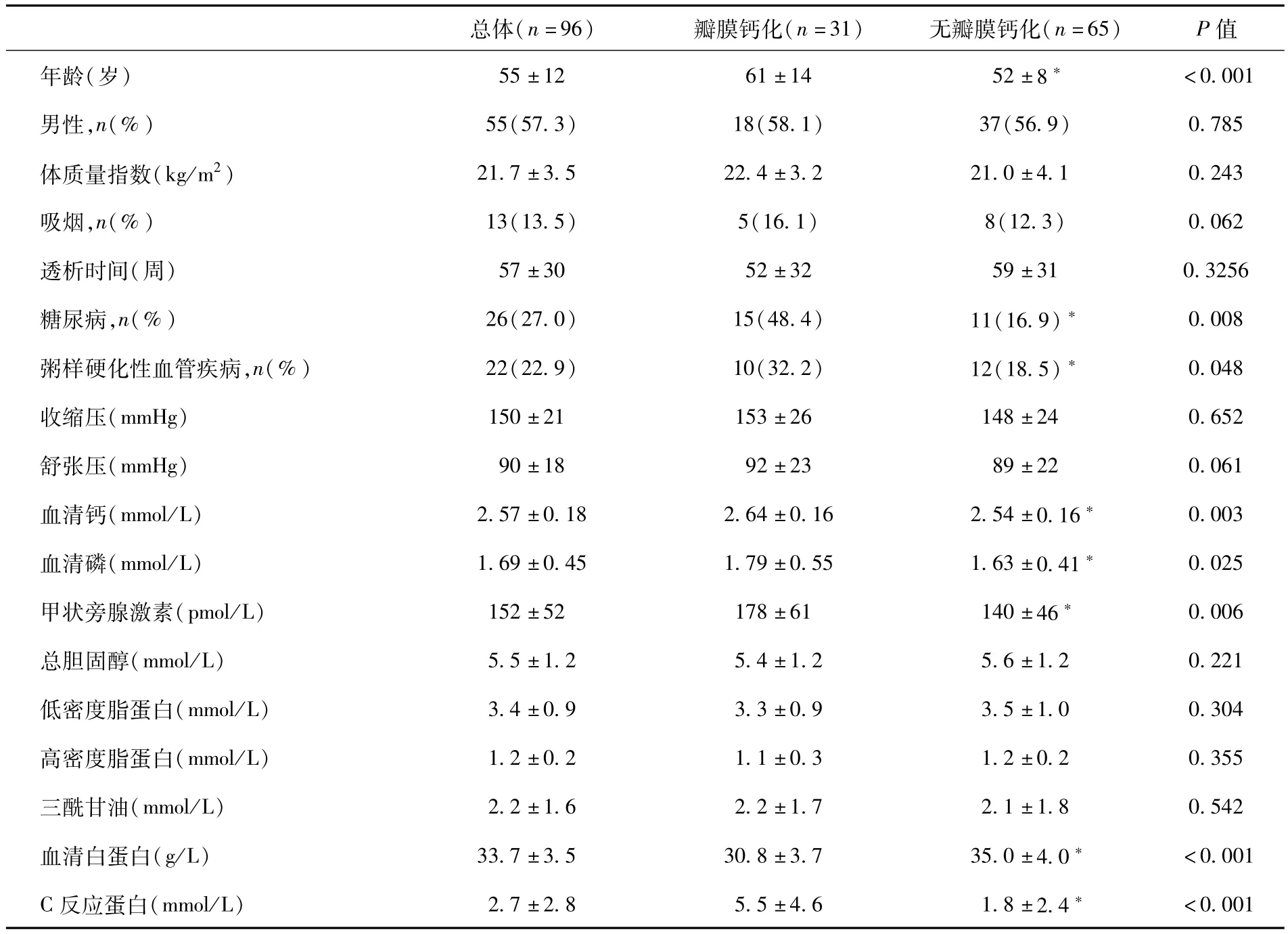
表1 两组患者的临床基本资料
临床转归 本组患者随访12~140周,平均随访时间为75周,共有25例死亡,12例为心血管源性死亡,其中心脏瓣膜钙化组8例,无心脏瓣膜钙化组4例(表2),两组心血管源性死亡率分别为25.8%vs6.2%(P<0.05)。心脏瓣膜钙化组与无心脏瓣膜钙化组1年心血管源死亡率分别为18%和4%(P<0.01)(图1),1年存活率分别为75%和95%(P<0.05)(图2)。
心脏瓣膜钙化与死亡原因分析 心脏瓣膜钙化的量与非心血管源性死亡率和心血管源性死亡率均存在显著正相关。非心血管源性1年死亡率:同时存在二尖瓣和主动脉瓣钙化者为50%,只有二尖瓣或主动脉瓣钙化者为17.4%,无瓣膜钙化者组为7.7%;心血管源性1年死亡率:同时存在二尖瓣和主动脉瓣钙化者为50%,二尖瓣或主动脉瓣单瓣膜钙化者为17.4%,无瓣膜钙化组为6.2%。
多变量COX回归分析发现:瓣膜钙化对于心血管源性死亡(HR 3.50,95%CI 2.23~5.52,P<0.01)及非心血管源性死亡(HR 2.23,95%CI 1.02~4.25,P<0.01)均有显著性预测意义,与年龄、性别、透析间期、糖尿病、粥样硬化性血管疾病和CRP一样,均是预测MHD患者死亡的独立危险因素(表3)。
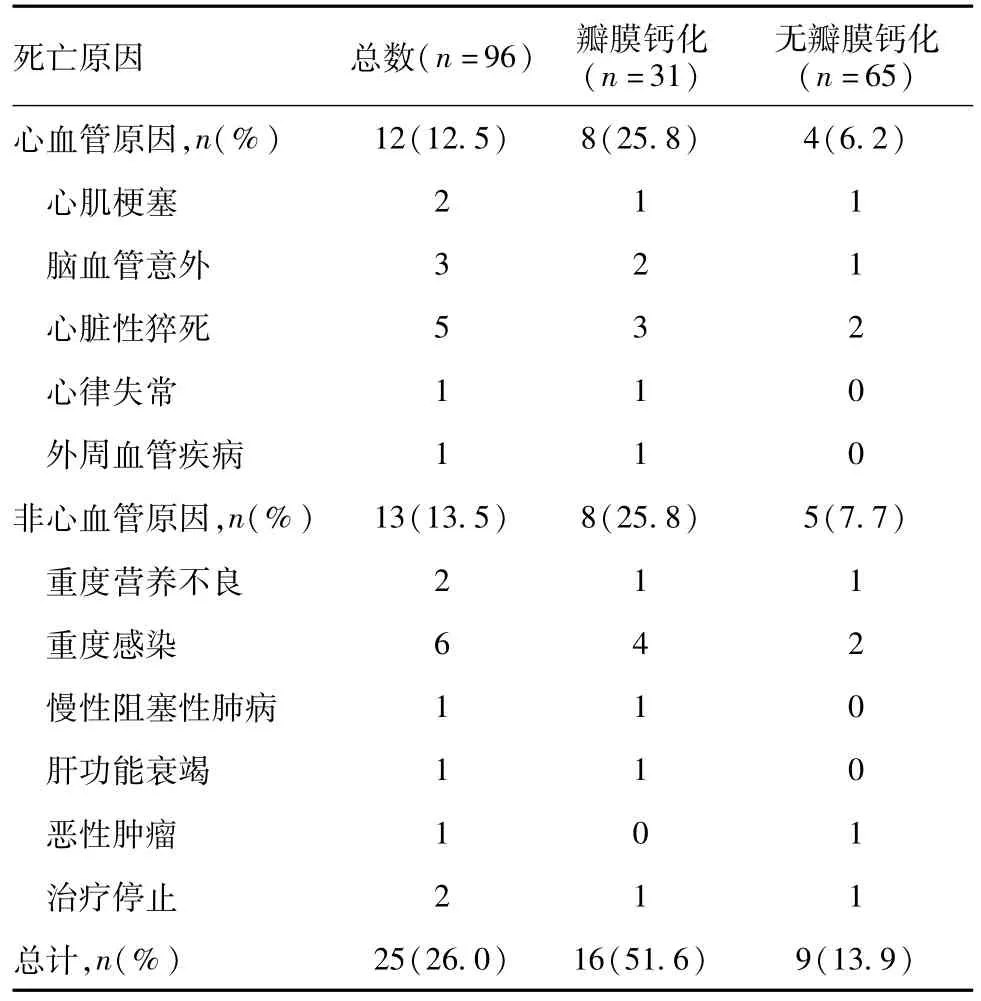
表2 心血管事件致死原因
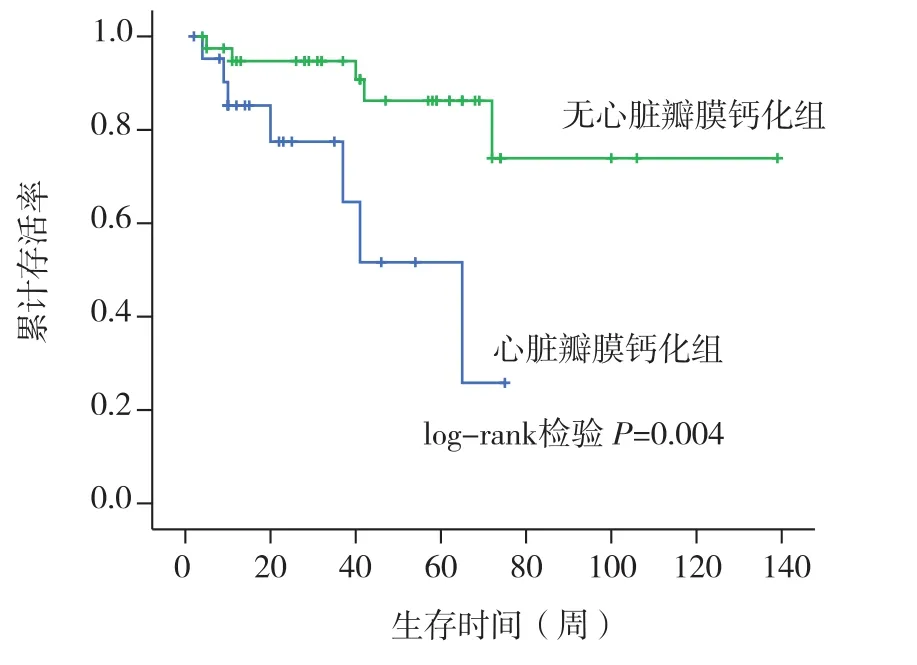
图1 两组患者心血管源性死亡率
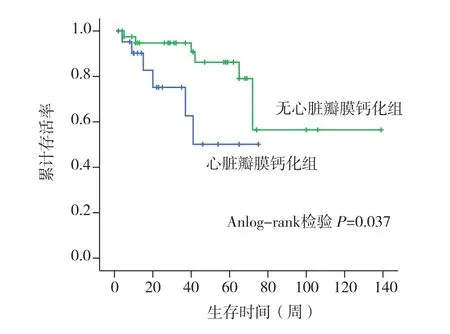
图2 两组患者非心血管源性死亡率比较
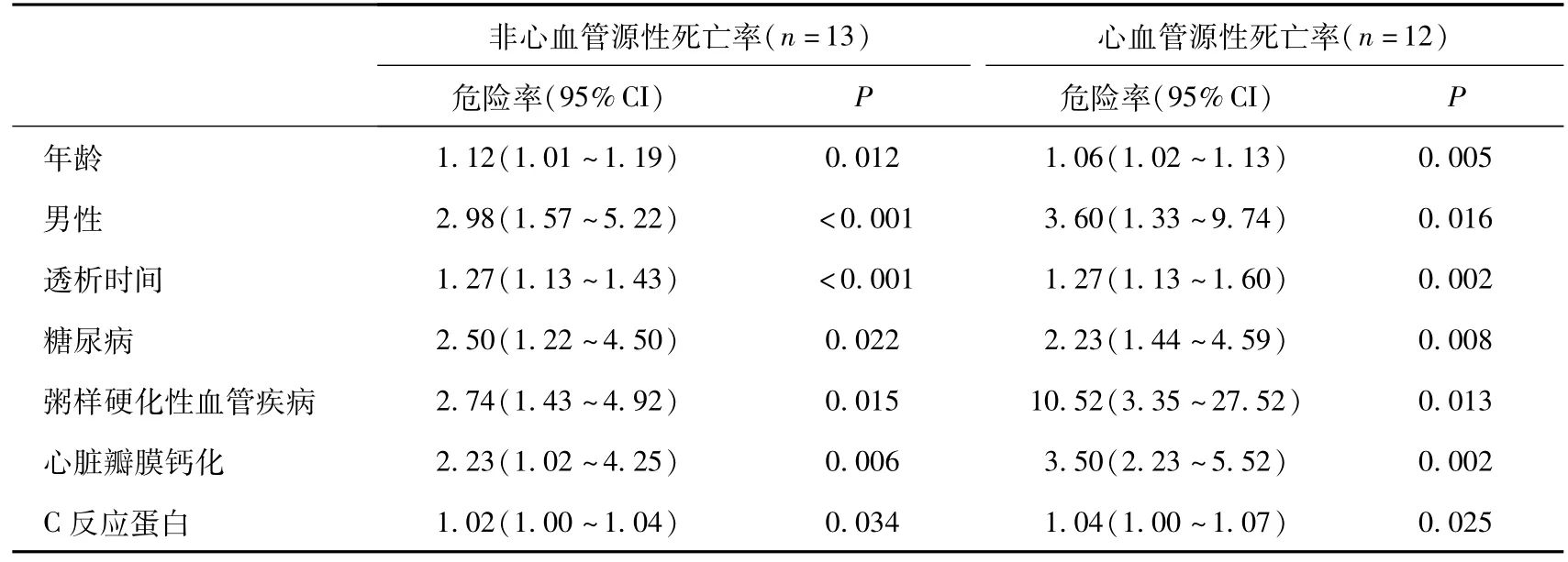
表3 心血管源性和非心血管源性死亡率相关因素分析
讨 论
MHD患者的心脏瓣膜疾病多继发于瓣膜钙化。钙磷代谢紊乱,高动力循环导致的主动脉剪应力增加均诱发瓣膜钙化,透析时间、炎症状态、高龄和低蛋白血症等因素亦可能与瓣膜病变的发生密切相关。文献报告主动脉瓣最常受累,其次为二尖瓣,临床表现为瓣膜反流和狭窄,引起血流动力学改变,并诱发或加重心力衰竭;另外,合并心脏瓣膜钙化者感染性心内膜炎的发生率也较高[7]。本研究发现,心脏瓣膜钙化对MHD患者的心血管源性和非心血管源性死亡率均有影响。通过长期随访观察,心脏瓣膜钙化者死亡率显著增加。心脏瓣膜钙化的MHD患者,不管是否合并粥样硬化性血管疾病,其心血管源性和非心血管源性死亡率有显著差异,提示心脏瓣膜钙化可能是动脉粥样硬化一种特殊类型,与其他动脉粥样硬化性病变具有相似病理意义和诊断价值。另外,心脏瓣膜钙化的部位和死亡率存在相关性,瓣膜钙化的数量实际上反映了钙化的程度,即随着发生钙化的瓣膜数量的增多(≥2个),患者死亡率显著增加。
心脏瓣膜钙化和动脉粥样硬化性具备一些共同因素,包括均存在炎性细胞、脂蛋白浸润和钙沉积,间充质细胞有成骨细胞特性,同时表达骨基质蛋白,说明瓣膜钙化过程促进了骨组织重构[8,9]。有资料表明终末期肾病患者血管钙化组织中存在骨基质蛋白沉积,提示血管和瓣膜钙化均表现为活性细胞激活过程,而非简单被动的矿物质沉积过程[10]。但在慢性肾脏病进展过程中,瓣膜或血管钙化的发病机制不同于粥样硬化。研究发现,终末期肾病钙化矿物质主要存在血管中膜,而非终末期肾病患者,粥样硬化斑块多出现于血管内膜表面呈斑片状沉积[11,12],因此,还需要进一步研究证实二尖瓣钙化和多数大动脉、周围血管疾病或冠状动脉疾病之间的相关性,并探讨存在上述病变者是否适合MHD治疗。
本研究发现,有或无瓣膜钙化的MHD患者其血清钙、磷浓度、甲状旁腺激素水平均有显著性差异,合并瓣膜钙化者年龄较大且糖尿病发病率较高。同时发现高龄、糖尿病、维持透析时间、高钙血症和心脏瓣膜钙化显著相关(表3)。
随着透析时间延长,MHD患者死亡率增加,其中瓣膜钙化程度增加是重要因素之一。有研究表明,对于青年MHD患者,每2年冠脉钙化评分增加1倍,钙化进程显著快于肾功能正常的老年人[13],这也进一步表明持续进展的钙负荷和钙磷代谢失衡加速患者组织钙化过程,从而影响预后。本研究结果表明,合并心脏瓣膜钙化病例,发生猝死的危险性较高,其发生机制尚不清楚,可能与同时存在冠状动脉钙化或硬化有关。
由于客观条件限制,本研究采用心脏彩超替代心脏CT检测钙化。虽然,心脏超声应用广泛,可动态观察,易于实施,无放射污染,能够较好的定性心脏血管及瓣膜钙化,但其缺点为不能严格量化定义心脏瓣膜钙化的严重程度,且采用心脏超声评价心脏瓣膜钙化和严重程度含有一定的主观性。
小结:心脏瓣膜钙化是终末期肾病MHD患者心血管源性及非心血管源性死亡的独立危险因素,与预后密切相关,通过综合治疗阻止或延缓瓣膜及血管钙化进展,可能对其的远期预后具有重要临床意义。
1 Wang AY,Lam CW,Chan IH,et al.Long-term mortality and cardiovascular risk stratification of peritoneal dialysis patients using a combination of inflammation and calcification markers.Nephrol Dial Transplant,2009,24(12):3826-3833.
2 MizobuchiM,Towler D,Slatopolsky E,et al.Vascular Calcification:The Killer of Patients with Chronic Kidney Disease.J Am Soc Nephrol,2009,20(7):1453-1464.
3 Wong M,Tei C,Shah PM.Sensitivity and specificity of twodimensional echocardiography in the detection of valvular calcification.Chest,1983,84(4):423-427.
4 钱荣立.关于糖尿病的新诊断标准与分型.中国糖尿病杂志,2000,8(1):5-6.
5 中国高血压防治指南修订委员会.中国高血压防治指南2010.中华心血管病杂志,2011,39(7):579-616.
6 European Heart Rhythm Association,Heart Rhythm Society.ACC/ AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death:a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines(Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death).J Am Coll Cardiol,2006,48(5):e247-346.
7 付 平,陈肖蕾.维持性血液透析患者心脏并发症//王质刚.血液净化学.第三版.北京:北京科学技术出版社,2010,809-810.
8 Moe SM,Chen NX.Mechanisms of Vascular Calcification in Chronic Kidney Disease.JAm Soc Nephrol,2008,19(2):213-216.
9 Noordzij M,Korevaar JC,Bos WJ,et al.Mineral metabolism and cardiovascular morbidity and mortality risk:peritoneal dialysis patients compared with haemodialysis patients.Nephrol Dial Transplant,2006,21(9):2513-2520.
10 Wang AY,Woo J,Wang M,et al.Association of inflammation and malnutrition with cardiac valve calcification in continuous ambulatory peritoneal dialysis patients.J Am Soc Nephrol,2001,12(9):1927 -1936,
11 Fox CS,Larson MG,Vasan RS,et al.Cross-Sectional Association of Kidney Function with Valvular and Annular Calcification:The Framingham Heart Study.JAm Soc Nephrol,2006,17(2):521-527.
12 Rodríguez-García M,Gómez-Alonso C,Naves-Díaz M,et al.Vascular calcifications,vertebral fractures and mortality in haemodialysis patients.Nephrol Dial Transplant,2009,24(1):239-246.
13 Floege J,Kim J,Ireland E,etal.Serum iPTH,calcium and phosphate,and the risk of mortality in a European haemodialysis population. Nephrol Dial Transplant,2011,26(6):1948-1955.
Influence of cardiac valve calcification to all-causemortality in chronic hemodialysis patients
ZHONG Bo,NAYu
Department of Nephrology,306 Hospital of PLA,Beijing 100101,China Corresponding author:NA Yu(E-mail:nysnd0701@sina.com)
Objective:To evaluate the influence of cardiac valve calcification to all-causemortality in patientswith end-stage renal disease on hemodialysis. M ethodology:Ninety six hemodialysis patients,who were 55 males and 11 females with a mean of age 55±12 years old and duration of hemodialysis 105±65 weeks,were investigated retrospectively.Baseline echocardiography was performed to screen for calcification of the aortic valve,mitral valve,or both.According to echocardiography examination they were divided into two groups(with valvular calcification,n=31,and without valvular calcification,n=65). Results:During themean follow-up of 75 weeks(range from 12 to 140 weeks),25 deaths were observed.Overall 1-yr survival was 75%and 95%respectively for patients with and without valvular calcification(P<0.01,log-rank test).Cardiovascularmortality was 25.8%and 6.1%respectively for patients with and without valvular calcification(P<0.01).Multivariable Cox regression analysis showed that cardiac valve calcification was predictive of an increased non-cardiovascular death[hazard ratio(HR)2.23,95%CI 1.02~4.25,P<0.01〛and cardiovascular death(HR 3.50,95%CI 2.23~5.52,P<0.01)independent of age,male gender,dialysis duration,C-reactive protein,diabetes,and atherosclerotic vascular disease. Conclusion:Cardiac valve calcification is a predictor for all-causemortality deaths in long-term dialysis patients.It can indicatesmore severe disease and prognosis.
cardiac valve calcification haemodialysis prognosis
2011-03-04
(本文编辑 心 平 纪 文 律 舟)
解放军306医院肾内科(北京,100101)
那 宇(E-mail:nysnd0701@sina.com)
©2011年版权归《肾脏病与透析肾移植杂志》编辑部所有