Aβ寡聚体预处理的BV2细胞对PC12细胞损伤的影响及其机制
2011-06-28蔺慕会何金婷陈晓虹徐忠信
蔺慕会 何金婷 陈晓虹 徐忠信
(辽宁省人民医院神经内科,辽宁 沈阳 110016)
IL-1β是IL-1家族中主要的活性分子〔1〕,在脑内主要来源于小胶质细胞〔2〕。在阿尔茨海默病(AD)患者脑中,IL-1β浓度增高与小胶质细胞活化间有明显相关性〔3〕,提示IL-1β、小胶质细胞活化有可能参与了AD的发生、发展过程。本研究选择与神经元生物学特性有很多相似之处的PC12细胞及已被广泛用来体外培养并代替小胶质细胞的BV2细胞共同培养,进而探讨由Aβ寡聚体预处理的BV2细胞对PC12细胞凋亡的影响及IL-1β在此过程中的作用,来研究小胶质细胞对神经元损伤的作用及机制。
1 材料与方法
1.1 材料 PC12细胞购于中国科学院北京细胞生物研究所,BV2细胞购于上海复祥生物科技有限公司。细胞转移筛网购于美国BD Falcon公司;RPMI1640培养基、DMEM培养基、胎牛血清购于 Gibco公司;Aβ1-42,六氟丙醇(HFIP),抗 tau,tau(pS396)一抗、二抗购于Sigma公司;MTT(噻唑蓝)购于上海华舜生物工程有限公司;BCA蛋白定量试剂盒购于美国PIERCE公司。Western印迹化学发光检测试剂盒和小鼠IL-1βELISA试剂盒购于武汉博士德公司;IL-1ra购于R&D系统(Minneapolis MN);IL-1β购于Sigma公司。
1.2 实验分组 对照组(Aβ+PC12组):PC12细胞培养液中加入Aβ1-42(0、10μmol/L)孵育24 h。实验组1(Aβ+BV2+PC12组):BV2 细胞经 Aβ1-42(0、1、5、10 μmol/L)预处理 24 h后检测IL-1β,并选择0、10μmol/L组与PC12细胞共育24 h。实验组 2(IL-1β +PC12 组):IL-1β(0、0.3、1、3、10 ng/ml)加入PC12细胞培养液中孵育24 h;实验组3〔(Aβ+BV2)+(PC12+IL-1ra)组〕:选择 0、10 μmol/L组,预先用 IL-1ra(50 ng/ml)孵育PC12细胞1 h后,进行实验组1的细胞培养。
1.3 Aβ寡聚体的制备及细胞培养 按Klein WL(2002)方法制备Aβ1-42寡聚体〔4〕,用RPMI1640培养液(含10%胎牛血清,100 U/ml青霉素,100 g/L链霉素)将PC12细胞培养在24孔培养板中。用DMEM培养液(含10%胎牛血清)将BV2细胞培养在转移筛网上。在BV2细胞经Aβ1-42处理24 h后,将培养液及生长有BV2细胞的转移筛网同时移入PC12细胞培养板与PC12细胞共育。
1.4 BV2细胞培养液中IL-1β含量的检测 不同浓度Aβ1-42(0、1、5、10 μmol/L)处理 BV2 细胞 24 h 后,收集培养液,按照试剂盒说明书,用双抗体夹心ABC-ELISA法检测培养液中IL-1β的含量。以96孔酶标计数仪检测光密度值。根据对数公式,通过样品OD值计算出IL-1β量。
1.5 Western印迹法检测PC12细胞tau(pS396)、tau蛋白表达将蛋白裂解缓冲液(预冷至0℃)加入经过漂洗的单层PC12细胞中,静置20 min;用细胞刮棒收集细胞,用蛋白定量分析(BCA法)测定总蛋白浓度。加样蛋白含量50μg,经10%SDSPAGE电泳分离,4℃条件下转膜,置膜于5%脱脂奶粉封闭1 h,在室温下分别加入兔抗大鼠tau(pS396);tau一抗(1∶1 000),4℃ 过夜,室温下加入辣根过氧化物酶标记的二抗(1∶4 000),60 min;化学发光显色,计算机扫描分析。
1.6 统计学处理 数据以x±s表示,采用SPSS10.0软件进行t检验。
2 结果
2.1 Aβ预处理的BV2细胞培养液中IL-1β含量 Aβ寡聚体预处理的BV2细胞培养液中可检测出IL-1β,随着Aβ寡聚体浓度(0,1,5,10 μmol/L)的增加,IL-1β 含量也明显增加〔(16.50 ±1.60),(1 102.13 ±138.25),(2 522 ±94.77),(2 965 ±121.3)pg/ml〕(P <0.05)。
2.2 不同浓度IL-1β处理后PC12细胞tau(pS396)、tau蛋白表达情况 IL-1β(0.3、1、3、10 ng/ml)加入PC12细胞培养液中孵育24 h后,可见PC12细胞tau(pS396)/总tau蛋白比值〔分别为(21.240±2.26)%、(27.775±1.103)%、(35.691±1.320)%、(38.836±1.530)%〕较未加入IL-1β组〔(11.201±2.171)%〕增多(P<0.05),并呈现一定的量效关系。见图1。
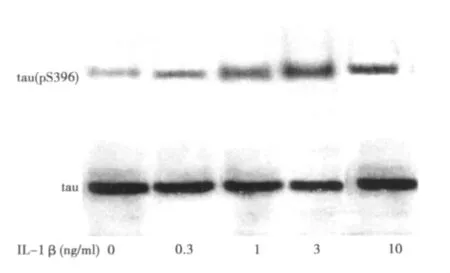
图1 不同浓度IL-1β处理后PC12细胞tau(p S396)、tau蛋白表达结果
2.3 IL-1ra对PC12细胞tau(pS396)蛋白表达的影响 IL-1β(3 ng/ml)+ PC12 组 (35.691% ± 1.320%),Aβ(10μmol/L)+BV2+PC12组,Aβ(10 μmol/L)+BV2+PC12+IL-1ra组tau表达(12.660% ±2.002%)无明显变化;tau(pS396)/总tau比值 Aβ(10μmol/L)+PC12组(35.694% ±1.523%),Aβ(10μmol/L)+BV2+PC12 组(49.504% ±3.146%)均明显增加(P<0.05),后者与前者相比tau(pS396)表达进一步增多(P<0.05);Aβ(10μmol/L)+BV2+IL-1ra+PC12组(40.611% ±3.019%)与 Aβ(10μmol/L)+BV2+PC12组相比tau(pS396)表达有所减少(P<0.05)。见图2。
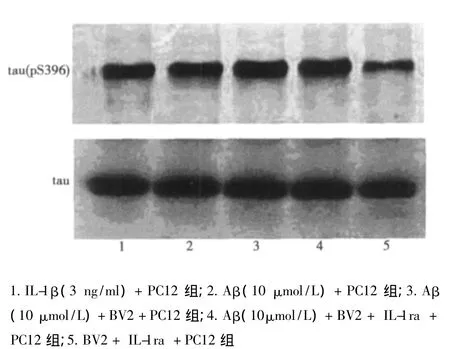
图2 各组PC12细胞tau(pS396)、tau蛋白Western印迹表达结果
3 讨论
IL-1β是IL-1家族的主要活性分子〔1〕,在成年后脑内表达水平很低。但在中枢神经系统炎症、损伤等疾病后,IL-1含量显著增加〔5〕。研究发现,AD患者脑中IL-1β表达水平升高,其血清中的IL-1β也比正常老年人高出数倍,并且IL-1β多态性与AD的发病和进展密切相关〔6〕。
表达P2X7受体的小胶质细胞(MG)在Aβ作用下可分泌大量的IL-1β〔2〕,Griffin等1989年首次发现AD患者脑中 IL-1活性、MG数量较对照组增加约6倍,提示在AD患者脑中MG可能是IL-1的主要来源〔7〕。本研究首先用Aβ寡聚体公认的AD致病因子作用于BV2细胞,排除其他因素干扰,发现BV2细胞能分泌较多IL-1β至培养液上清。并且Aβ寡聚体与BV2分泌的IL-1β有剂量相关性,提示Aβ寡聚体与BV2细胞合成、分泌IL-1β有因果关系,支持既往观点。
IL-1β在AD中的作用有学者认为起保护作用〔8〕,但多数认为IL-1β参与AD发展的炎症反应中,处于反应链的前端,可进一步引起其他炎症介质如NO的增多,加重炎症反应〔9〕,还可以直接引起神经元tau蛋白磷酸化及突触损伤〔10〕。本研究提示IL-1β可导致tau蛋白异常磷酸化,从而导致细胞骨架形成障碍,最终导致神经元凋亡。
本研究结果提示 BV2细胞可促进 Aβ1-42寡聚体导致的PC12细胞tau(pS396)表达。为明确此作用是否与BV2细胞分泌IL-1β有关,本研究用IL-1ra预先处理PC12细胞,封闭PC12细胞IL-1β受体,IL-1受体拮抗蛋白(IL-1ra)在一级结构与空间构象上,与IL-1具有同源性,是IL-1的竞争性拮抗剂,对IL-1α及IL-1β受体结合能力都很强,足以阻断二者的功能〔11〕。本结果提示BV2细胞加重Aβ1-42寡聚体对PC12细胞的损伤与其分泌IL-1β有关。当然,与对照组相比,IL-1ra并未完全拮抗BV2的损伤作用,因为Aβ1-42寡聚体处理BV2细胞后必然有其他因子产生,参与BV2细胞加重对PC12细胞的损伤过程,这一点也在3 ng/ml IL-1β+PC12组与10μmol/L+BV2+PC12组比较中发现,虽然BV2细胞经Aβ(10μmol/L)处理24 h后产生IL-1β约为3 ng/ml左右,但3 ng/ml IL-1β+PC12组蛋白比值却低于Aβ(10μmol/L)+BV2+PC12组,虽无统计学意义,但提示除了IL-1β外还有其他因素参与此过程。至于还有哪些因子参与还有待于进一步研究。
本研究通过体外细胞培养研究证实,IL-1β通过引起tau异常磷酸化通路参与BV2细胞加重Aβ寡聚体对PC12细胞损伤过程,提示对小胶质细胞活化及对其分泌的炎性介质进行干预,可能是治疗AD的一条可行之路。但体内环境复杂,是否通过阻断AD病人IL-1β的作用,就能有助于阻止AD病情发展,还需进一步探讨。
1 Rothwell NJ,Luheshi GN.Interleukin-1 in the brain:biology,pathology and therapeutic target〔J〕.Trends Neurosci,2000;23(12):618-25.
2 Sanz JM,Paola Chiozzi,Davide Ferrari,et al.Activation of microglia by amyloid β requires P2X7 receptor expression〔J〕.J Immunol,2009;182(7):4378-85.
3 Eriksson C,Van Dam AM,Lucassen PJ,et al.Immunohistochemical localization of interleukin-1beta,interleukin-1 receptor antagonist and interleukin-1 beta converting enzyme/caspase-1 in the rat brain after peripheral administration of kainic acid〔J〕.Neuroscience,1999;93(3):915-30.
4 Klein WL.Abeta toxicity in Alzheimer's disease:globular oligomers(ADDLs)as new vaccine and drug targets〔J〕.Neurochem Int,2002;41(5):345-52.
5 Shaftel SS,Kyrkanides S,Olschowka JA,et al.Sustained hippocampal IL-1 beta overexpression mediates chronic neuroinflammation and ameliorates Alzheimer plaque pathology〔J〕.J Clin Invest,2007;117(6):1595-604.
6 Déniz-Naranjo MC,Mu˜noz-Fernandez C,Alemany-Rodríguez MJ,et al.Cytokine IL-1 beta but not IL-1 alpha promoter polymorphism is associated with Alzheimer disease in a population from the Canary Islands,Spain〔J〕.Euro JNeurol,2008;15(10):1080-4.
7 Lemere CA.A beneficial role for IL-1 beta in Alzheimer disease〔J〕?J Clin Invest,2007;117(6):1483-5.
8 Akama KT,Van Eldik LJ.β-Amyloid stimulation of inducible nitric-oxide synthase in astrocytes is interleukin-1β-and tumor necrosis factor-α(TNFα)-dependent,and involves a TNFα receptor-associated factor-and NFκB-inducing kinase-dependent signaling mechanism〔J〕.JBiol Chem,2000;275(11):7918-24.
9 Bellucci A,Westwood AJ,Ingram E,et al.Induction of inflammatory mediators and microglial activation in mice transgenic for mutant human P301Stau protein〔J〕.Am J Pathol,2004;165(5):1643-52.
10 Malyak M,Guthridge JM,Hance KR,et al.Characterization of a low molecular weight isoform of IL-1 receptor antagonis〔t J〕.JImmunol,1998;161(4):1997-2003.
11 Dinarello CA.Interleukin-1 and interleukin-1 antagonism〔J〕.Blood,1991;77(8):1627-52.
