芹菜素壳聚糖微球的制备及体外释药研究
2011-06-18张志国阎雪莹李丽霞丁文财侯铁强
张志国,阎雪莹,李丽霞,何 礼,丁文财,侯铁强
微球(Microsphere)系以天然、合成或半合成高分子材料为基质,将药物均匀分散或包埋在骨架中而制成的球形载体给药系统,属基质型骨架微粒。目前,以壳聚糖(Chitosan,CS)为基质材料制备缓控释制剂的研究己经取得了较大进展。芹菜素(Apigenin,AP)又称芹黄素,是一种天然存在的黄酮类化合物,有"植物雌激素"之称,广泛存在于多种水果蔬菜、豆类和茶叶中,以芹菜中的含量最高,芹菜中提取的芹菜素占提取出的黄酮总量的17%[1]。芹菜素具有抗癌、抗氧化、抗炎、降血压等多种功效[2]。但由于芹菜素不溶于水,亲水性和亲脂性均很差,故难以被消化道粘膜吸收,口服吸收差,大大限制了其临床应用。因此,本文以生物降解型壳聚糖为载体,制备芹菜素壳聚糖微球,拟在提高芹菜素生物利用度、改善口服吸收、延长药物释放时间,为芹菜素新剂型的研究和开发提供实验基础。
1 试验仪器与材料
1.1 试剂与药品 芹菜素对照品(含量≥99%)、芹菜素原料药(含量≥98%),购自西安小草植物科技有限公司;壳聚糖(脱乙酰度92%,青岛海普生物技术有限公司);甲醇(色谱纯,DIKMA公司);其他试剂均为分析纯。
1.2 仪器 LC-2010 AHT型高效液相色谱仪(日本岛津公司);数显恒温磁力搅拌器(HJ-6A,金坛市荣华仪器制造有限公司);Sartorius BT25S电子天平(德国 Sartorius公司);超声波细胞破碎机(Scientz-IID,宁波新芝生物科技股份有限公司);FTIR-8400S傅立叶红外光谱仪(日本岛津有限公司);光学显微镜(日本奥林巴斯 C011);JEOL JSM 6700F场发射扫描电镜(日本电子);Mastersizer 2000激光粒度分析仪(英国马尔文仪器有限公司);KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司)。
2 试验方法与结果
2.1 分析方法的确立
2.1.1 色谱条件 色谱柱:Diamonsil C18(250mm ×4.6mm,5μm);流动相:甲醇-水(60∶40);流速:1.0mL/min;检测波长:340 nm;柱温:35℃;进样量:10μL。
2.1.2 标准曲线的建立 精密称取芹菜素对照品适量,置于25mL容量瓶中,以甲醇溶解并稀释至刻度,配成1 mg/mL储备液,再分别吸取该溶液适量,用甲醇配成 1.0、2.0、4.0、8.0、16.0、24.0、32.0、40.0、48.0μg/mL 的溶液,用 HPLC 法测定,记录峰面积。以芹菜素浓度C(μg/mL)为横坐标、峰面积A为纵坐标,绘制标准曲线,得线性回归方程:A=55027 C+16169,r2=0.9996。结果表明,芹菜素对照品浓度在1.0~48.0μg/mL范围内与峰面积线性关系良好。
2.1.3 精密度试验 精密吸取浓度为15.0μg/mL的芹菜素供试品溶液,按照“2.1.1”项色谱条件下进样测定分析,1 d内,每隔1 h进样1次,连续进样6次,计算日内精密度;每日测定1次,连续测定6 d,计算日间精密度。结果表明,此方法的日内、日间精密度良好,符合含量测定的要求。
2.1.4 回收率试验 称取50 mg空白壳聚糖微球于10mL无水乙醇中,再量取浓度为42.0、21.0、5.25μg/mL的芹菜素无水乙醇溶液10mL,二者混合后,按“2.3”项下进行包封率测定,代入标准曲线中计算检出浓度,进行数据处理。结果表明,此方法的回收率为97.37% ±1.33%,符合方法学要求。
2.2 AP-CS微球的制备 采用复乳-乳化化学交联法[3-4]制备微球。精密称取一定量的壳聚糖细粉溶于5%的醋酸溶液8mL中,静置使其充分溶胀除去气泡备用,为初乳的外相;以三氯甲烷作为初乳内相。称取一定量的芹菜素溶解于2mL三氯甲烷中。将内相加入外相中,置于超声波细胞破碎机中,超声3min后取出,逐滴加入到含4%span-80的液体石蜡40mL中。电磁搅拌器600 r/min搅拌,搅拌60min后加入交联固化剂甲醛,固化120min。固化完成后,静置倾去上层油相,用石油醚洗涤2次后,再用2%亚硫酸氢钠溶液洗涤除去残余的甲醛,异丙醇适量,洗涤2次,抽滤,干燥,即得AP-CS微球。
2.3 微球载药量及包封率的测定 采用研磨-超声法[5]对AP-CS微球进行包封率和载药量的测定。将AP-CS微球50 mg于研钵中研磨成粉末,加入10mL无水乙醇继续研磨至溶液显土黄色,置于锥形瓶中超声30min,静置一段时间后,精密吸取上清液1mL,用无水乙醇定容至10mL,用0.22μm微孔滤膜滤过,注入液相色谱仪。计算微球中药物的包封率和载药量[载药量(%)=微球中的药物量/微球重量×100%;包封率(%)=微球中的药物量/投药量×100%]。微球经过处理后,通过显微镜观察,微球在外力作用下已经被研碎,药物可溶于无水乙醇溶剂中。因此,研磨-超声法测定微球中药物包封率方法可行。
2.4 正交试验设计 在AP-CS微球的制备过程中,本文选取了影响微球载药量和包封率较显著的4个因素作为考察对象,即药物与壳聚糖的比例(A)、壳聚糖浓度(B)、乳化剂 span-80浓度(C)、固化剂甲醛用量(D),每个因素选取3个水平,以载药量、包封率为指标,通过L9(34)正交试验设计优选最佳工艺条件,进行评价。见表1。
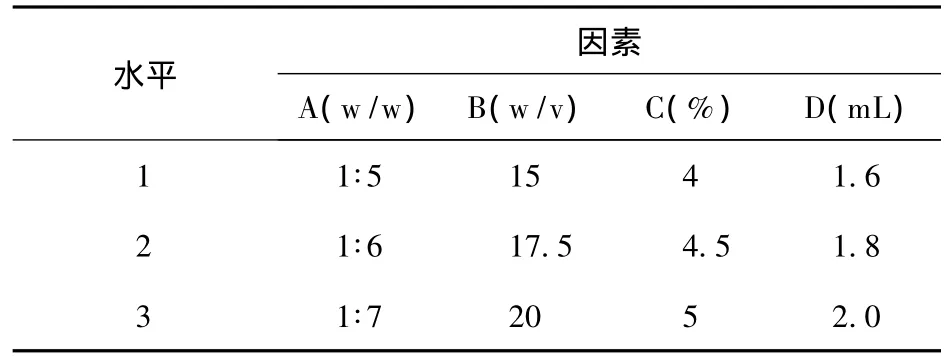
表1 实验影响因素和水平(n=3)
按照L9(34)试验设计,共进行了9组试验,每组3个平行样,并进行综合加权分析。微球平均载药量x、平均包封率y均是越高越好,这里规定微球载药量x=8.5%为满分(100分),X表示微球载药量得分,用公式X=x/8.5×100,把各试验号的微球载药量转化为分数;规定微球包封率y为73%为满分(100分),Y表示微球包封率得分,用公式Y=y/73×100,把各试验号的微球包封率转化为分数。载药量和包封率的权重系数均为0.5,按公式Z=0.5 X+0.5 Y,计算综合得分。见表2。
2.5 工艺条件的选择 实验设计的A、B、C、D因素均影响微球的包封率和载药量,分析结果表明,各因素对载药量、包封率的影响程度:A>B>D>C,即药物与载体比例>壳聚糖浓度>固化剂甲醛用量>乳化剂span-80用量,由于C为不显著因素,但对微球粒径影响较大,虽然随着乳化剂浓度C浓度增大粒径减小,但是加入过高电磁搅拌器搅拌困难,综合考虑,乳化剂span-80浓度确定为C2。最终确定最优水平:A1B1C2D2。
按最佳工艺,即药物与壳聚糖的比例为1∶5,壳聚糖浓度为15 mg/mL,乳化剂span-80的浓度为4.5%,固化剂甲醛用量为1.8mL。制备4批微球,平均包封率为 69.69%,平均载药量为8.54%。
2.6 微球形态、粒度分布及红外光谱考察 按最佳工艺制得的微球,在光学显微镜下观察形态,AP-CS微球呈圆形,边界清晰,表面略显粗糙,不粘连或极少粘连,见图1;在场发射扫描电子显微镜下观察,AP-CS微球呈圆球形,粒径较均匀,表面较光滑,较少粘连,见图2;激光粒度分析仪测定粒径分布的结果表明,微球的平均粒径为84.33μm,粒径分布呈正态分布,90%以上微球的粒径为50.0~110.0μm。
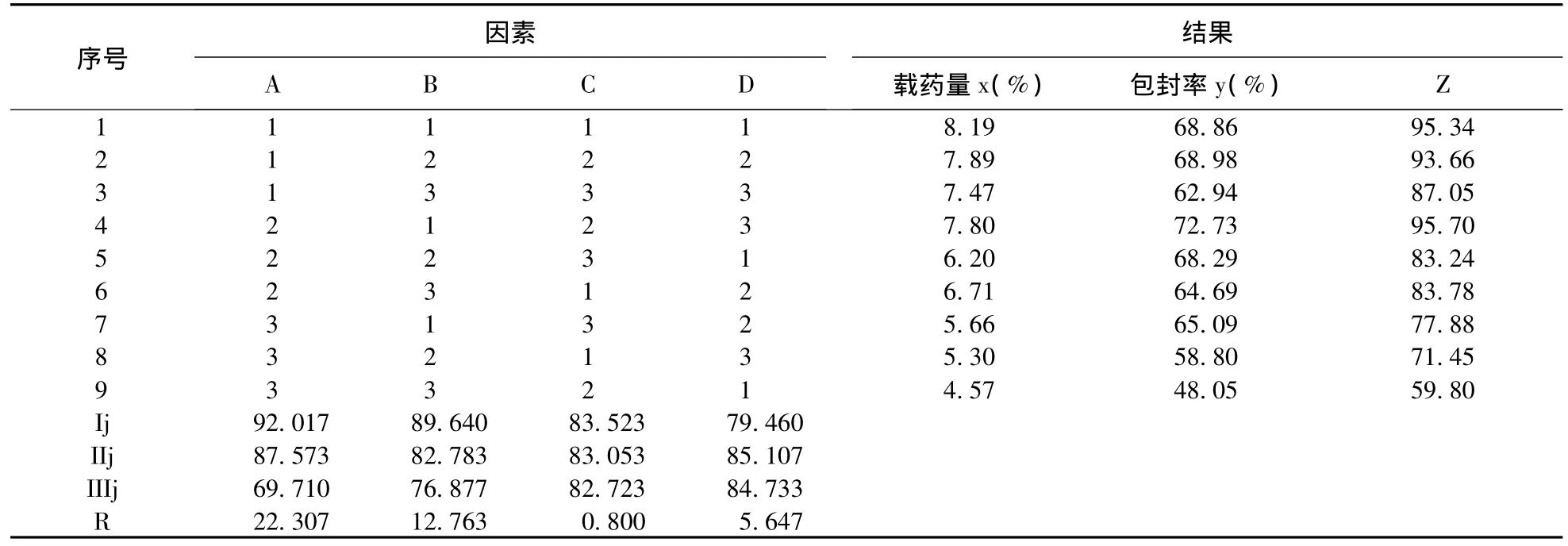
表2 正交试验结果及方差分析
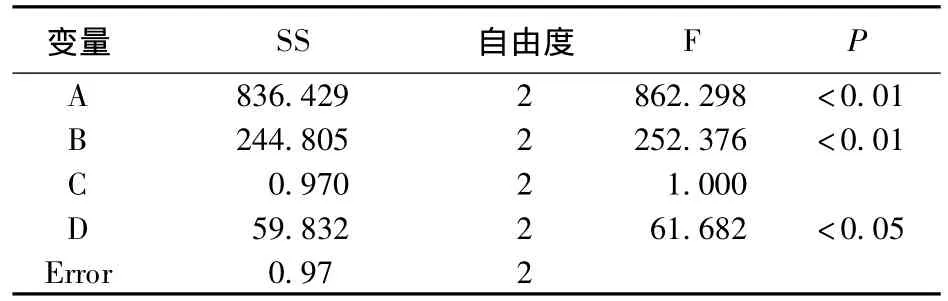
表3 正交试验方差分析
红外光谱结果表明,AP、AP与空白微球的物理混合物在1223 cm-1处均出现C-O-C官能团伸缩振动吸收峰,在1650 cm-1处均出现了-C=O官能团伸缩振动吸收峰,但是在含药微球中,这两处峰都出现减弱及宽化,且在其他位置上,与物理混合物有显著性差异,表明AP-CS制备成功。
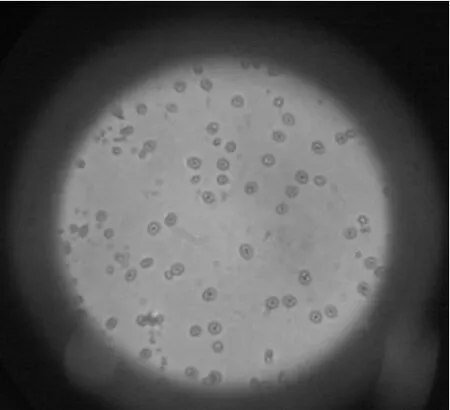
图1 AP-CS微球显微镜照片(×40倍)

图2 AP-CS微球的扫描电子显微镜照片
2.7 微球体外药物释放 芹菜素壳聚糖微球体外释药采用直接释药法测定。笔者考察了pH 6.8和pH 7.4的磷酸盐缓冲溶液对AP-CS微球释药的影响。分别称取AP-CS微球约30 mg(含芹菜素约2 mg),置于盛有100mL pH 6.8、pH 7.4磷酸盐缓冲溶液的烧杯中,于电磁搅拌器(37±1)℃中,以75 r/min转动。定时取释放液2mL,同时补加等量释放介质。释放液经0.45μm微孔滤膜过滤,取续滤液于检测波长处测定,以累积释药率对时间做图,释放率计算公式如下:
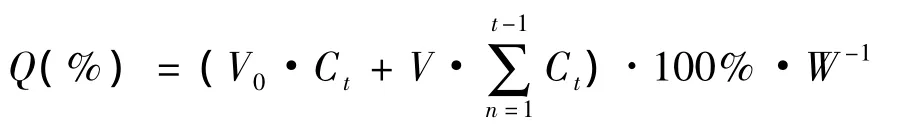
式中Ct为各时间点测得释放介质中的芹菜素浓度(μg/mL),W为投入微球剂型中芹菜素的总重量(μg),V0为释放介质的总体积,V为每次取样体积。计算微球的累积释放百分率,见图3。
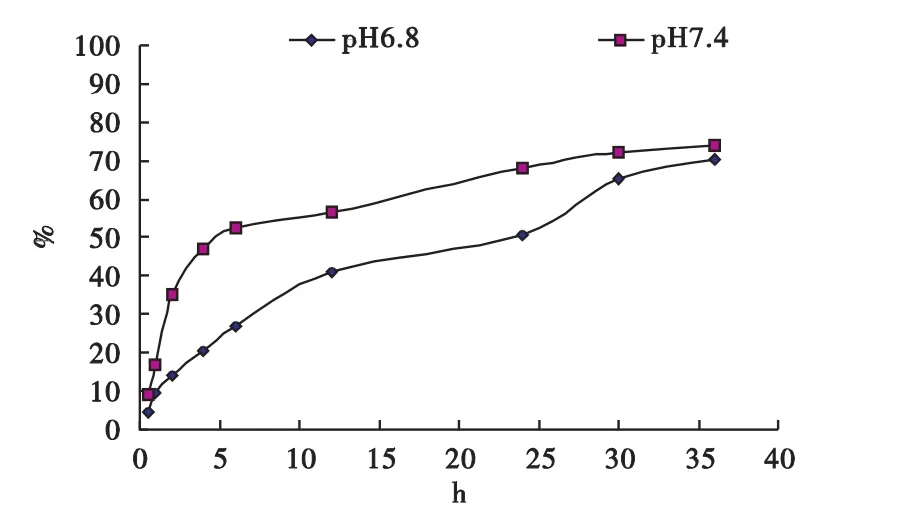
图3 芹菜素壳聚糖微球的体外累积释药曲线
结果表明,AP-CS微球在pH 6.8、pH 7.4磷酸盐缓冲溶液中36 h的累计释放量分别达70.25%与74.14%,说明本实验制得的微球制剂具有一定的缓释作用。
根据《中国药典》2010版附录中微囊、微球与脂质体制剂的指导原则,开始0.5 h内的释放量要求低于40%。本试验制得的微球在0.5 h内药物释放量低于10%,符合药典要求。
2.8 微球释药曲线的拟合 按优化处方和工艺制备的芹菜素壳聚糖微球释药结果分别以零级动力学方程、一级动力学方程、Higuchi方程进行拟合,以拟合优度(r)对方程拟合度加以判断,得到拟合方程,见表4。
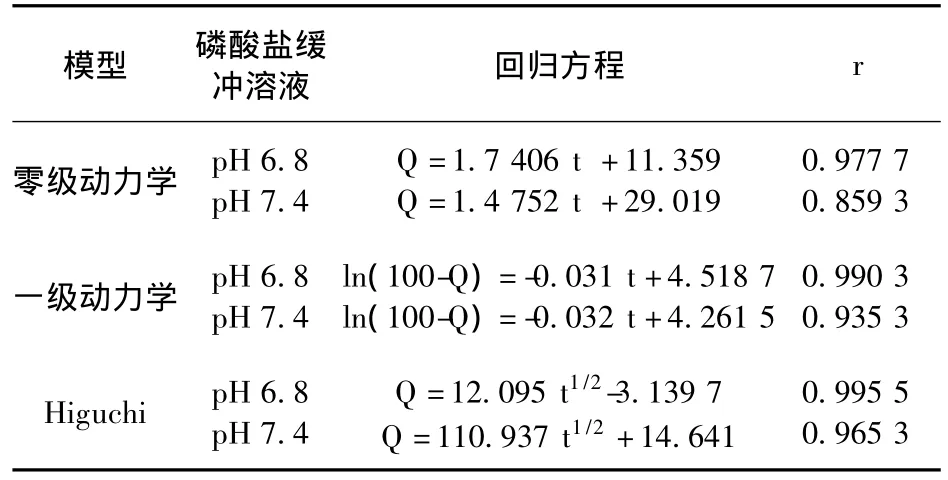
表4 芹菜素壳聚糖微球不同释药模型拟合方程
由表4可见,芹菜素壳聚糖微球在不同pH值的释放液中,释放模型拟合接近程度依次为:Higuchi模型>一级动力学模型>零级动力学模型。
3 讨论
3.1 预实验中,笔者采用了实验室常用的乳化-化学交联法,仅获得了包封率为30.5%的微球。本文采用的复乳-乳化化学交联法是在乳化-化学交联法的基础上发展起来的,更适合于芹菜素类疏水性药物。结果表明,微球形态良好,具有较高的包封率和载药量,符合微球制剂的粉体学要求。方法重现性好,简单、可行。
3.2 微球的药物测定方法种类较多,包括酸回流法、双氧水氧化法、超声粉碎法及溶菌酶等。本实验采用复乳-乳化化学交联法制备微球,壳聚糖分子2位游离氨基与甲醛通过氨醛缩合反应形成键桥,使微球固化,壳聚糖降解性发生变化。制备的微球不能被溶菌酶降解,也不能用硫酸、高氯酸消解。由于芹菜素在无水乙醇中具有一定的溶解度,因此,参考相关文献,通过物理方法(研磨-超声法),取得了较好的结果,且该方法简单、可靠、省时。
3.3 壳聚糖是一种高分子载体材料,相同相对分子质量下,脱乙酰度越高,溶液黏度越低。本实验选择了脱乙酰度92%、相对分子质量10万的壳聚糖,是为了在相同黏度下提高壳聚糖的浓度,增加氨醛缩合反应的氨基数,使得生成的微球骨架更致密。壳聚糖粘度大,制备的微球易粘连,本实验采用加大外油相体积的方法,较好地解决了微球粘连问题。
3.4 体外释放度实验是常用的微球制剂体外释药速度评价方法,文献中应用较多的方法有直接释药法和透析法。笔者对影响AP-CS微球体外释放度的方法进行了考察,预实验结果表明,采用透析法微球的24 h累积释药仅为10%。分析可能有两个原因:①壳聚糖分子量大,堵塞透析袋,影响药物的释放;②制剂是固态粉末,易沉积于透析袋底部,直接影响制剂与释放介质的接触面积。而采用直接释药法,将制备的微球直接投入释放介质中测定,释放效果较好。
[1]Crozier A,Lean MEJ,McDonald MS,et al.Quantitative analysis of the flavonoid content of commercial tomatoes,onions,lettuce,and celery[J].Journal of Agricultural and Food Chemistry,1997,45(3):590-595.
[2]隋海霞,徐海滨,荫士安.芹菜素的生物学作用[J].国外医学:卫生学分册,2008,35:103-107.
[3]Pavanetto F,Perugini P,Conti B.Evaluation of process parameters involved in chitosan microsphere preparation by the o/w/o multiple emulsion method[J].Journal of Microencapsulation,1996,13(6):679.
[4]敦洁宁,邓树海,苗彩云,等.大蒜素壳聚糖微球的研究[J].山东大学学报:医学版,2005,43(5):452-454.
[5]李可欣,陈大为.RP-HPLC法测定壳聚糖微球中5-氟尿嘧啶的包封率[J].沈阳药科大学学报,2005,11(6):434-437.
