清开灵对缺氧体外血脑屏障紧密连接蛋白ZO-1表达的影响1)
2011-06-09朱海燕娄利霞娄晋宁刘明岭高永红
朱海燕,马 涛,娄利霞,娄晋宁,刘明岭,徐 冰,高永红
缺血性中风一直是临床上的治疗难题,血脑屏障(blood brain barrier,BBB)的破坏既是脑缺血损伤的结果,又是进一步导致脑损伤的关键环节[1],而BBB通透性的改变与紧密连接(tight junction,TJ)的主要成分ZO-1分布及缺失密切相关[2]。清开灵对缺血性中风急性期患者有良好的治疗作用[3,4]。探讨脑缺血后BBB上主要功能蛋白ZO-1的改变及清开灵对其表达的影响,对脑中风初期的治疗及预后具有重要意义,同时还有助于揭示清开灵抗脑缺血性损伤的作用机制。
1 材料与方法
1.1 细胞 Balb/c小鼠脑微血管内皮细胞系细胞(中日友好医院娄晋宁教授惠赠),经抗Ⅷ因子抗体、抗CD31抗体及DiI-乙酰化低密度脂蛋白标记摄取检测,符合内皮细胞特性[5]。
1.2 主要药品及试剂 清开灵注射液(每支 10 mL,批号:810906A,北京中医药大学);内皮细胞生长因子(由中日友好医院临床研究所病理生理室提取);SV总RNA纯化系统试剂盒、反转录系统试剂盒(promega公司);Power Sybr Green PCR Master Mix(ABI公司);PVDF膜(millipore公司);RIPA裂解液(普利莱基因公司);ECL发光液(碧云天公司);蛋白质Marker(Fermentas公司);Cocktail蛋白酶抑制剂、PhosSTOP磷酸酶抑制剂(Roche公司);BCA蛋白定量测定试剂盒(塞驰公司)。
1.3 主要仪器 M x3000p定量PCR仪(ZA29-M x3000P,Stratagene公司);倒置相差显微镜(Olympus IM T-2);高速冷冻离心机(HC-3018R,科大创新)。低氧 CO2培养箱(MiniGalaxy A,RS biotech公司);CO2培养箱(MCO-20AIC,SANYO公司),可见光紫外分光光度计(Multispec1501,岛津公司);Genegenome凝胶成像系统(Syngene公司);BioRad Mini-4垂直电泳槽和转膜仪(Biorad公司);Genegenome凝胶成像系统(Syngene公司)。
1.4 脑微血管内皮细胞培养 液氮中取出细胞冻存管,37℃水浴箱迅速融化,传至已用明胶包被的培养瓶中,放入适量内皮细胞培养基,37℃、5%CO2培养箱培养,1 d~2 d换液,3 d~4 d传代一次,用胰酶消化细胞;实验采用第24代细胞。
1.5 实验分组 将单细胞悬液接种于60mm培养皿中,每皿5×105mL个细胞,加培养基 4 mL,置CO2培养箱中孵育,待细胞90%以上融合时随机分为5组。正常对照组,细胞培养液换成有糖Earle液,在CO2培养箱中正常24 h培养。模型组,采用缺氧缺糖模拟缺血。细胞培养液换成无糖 Earle液,在培养条件为37℃,5%CO2,1%O2的低氧CO2培养箱中培养24 h。清开灵低、中、高剂量组,缺氧缺糖同时分别加入0.25%、0.50%、1.00%清开灵培养24 h。尼莫地平组,缺氧缺糖同时加入100 μ g/mL尼莫地平培养24 h。每组设6个复孔。
1.6 荧光实时定量PCR反应
1.6.1 总RNA提取 采用SV总RNA纯化系统试剂盒提取总RNA,在紫外分光光度计中测OD260、OD280值,计算 RNA浓度和含量。采用反转录系统试剂盒进行mRNA反转录反应。1.6.2 引物合成 通过检索NCBI获得小鼠ZO-1 mRNA基因序列,引物交由北京奥科鼎盛生物科技有限公司设计并合成。ZO-1:Forward5'-AGGACACCAAAGCATGTGAG-3',Reverse 5'-GGCATTCCTGCTGGTTACA-3',扩增片段长度86 bp;内参 β-actin:5'-AGG CCA ACC GTG AAA AGA TG-3',Reverse 5'-TGG CGT GAG GGA GAG CAT AG-3',扩增片段长度185bp。
1.6.3 荧光实时定量PCR反应 反应体系及反应条件:总反应体系25 μ L,2 mix 12.5 UL,无 RNA 酶水 5.5 U L,cDNA 5 UL,上游引物 1 UL(10 μ mol/L),下游引物 1 UL(10 μ mol/L),反应条件:95℃10 min预变性;然后95℃变性30 s,55℃退火30 s,72℃延伸30 s,40次循环。反应结束计算机自动计算CT值。扩增效率标准曲线、熔解曲线和扩增曲线:每个引物均把CDNA按倍比稀释5次。观察熔解曲线和扩增曲线。
2 结 果
2.1 标准曲线、熔解曲线和扩增曲线 求得标准曲线,基因扩增效率(Eff)=95.2%,相关系数(Rsq)=0.999,可见引物的Eff在(100±10)%,Rsq>0.98,呈良好的线性关系,定量结果准确可靠。各组目的基因PCR产物的扩增曲线平滑,有明显的指数扩增期;熔解曲线为单特异峰,Tm值均>80℃,说明没有引物二聚体及非特异性扩增产物。
2.2 荧光实时定量ZO-1基因转录量 CT值表示每个反应管内的荧光信号到达设定的域值时所经历的循环数,根据2-△△CT法求出初始cDNA的相对量。模型组ZO-1基因转录量显著低于正常对照组(P<0.01);清开灵中、高剂量组和尼莫地平组能明显升高缺氧复氧后微血管内皮细胞ZO-1的基因转录,(较模型组)(P<0.01)。详见表1。
表1 各组ZO-1基因转录量(±s)
组别 n ZO-1正常组 6 1.017±0.11991)模型组 6 0.313±0.0542)清开灵低剂量组 6 0.433±0.1382)清开灵中剂量组 6 0.702±0.1271)清开灵高剂量组 6 0.983±0.3601)尼莫地平组 6 0.834±0.1331)与模型组比较,1)P<0.01;与正常组比较,2)P<0.01
2.3 ZO-1蛋白表达量 与正常对照相比,模型组ZO-1表达量降低78.90%,表明缺氧损伤能显著抑制细胞ZO-1蛋白的表达(P<0.05)。与模型组相比,低、中、高剂量清开灵分别使ZO-1的表达量提高3.635倍(或 363.51%)、5.554倍(或 555.40%)和7.919倍(或791.89%),清开灵可显著提高缺氧损伤后细胞ZO-1蛋白的表达(P<0.05)。清开灵高剂量组增加ZO-1蛋白的表达非常显著,甚至超过正常组该蛋白的表达水平(P<0.01)。详见表2。
表2 ZO-1蛋白表达量(±s)
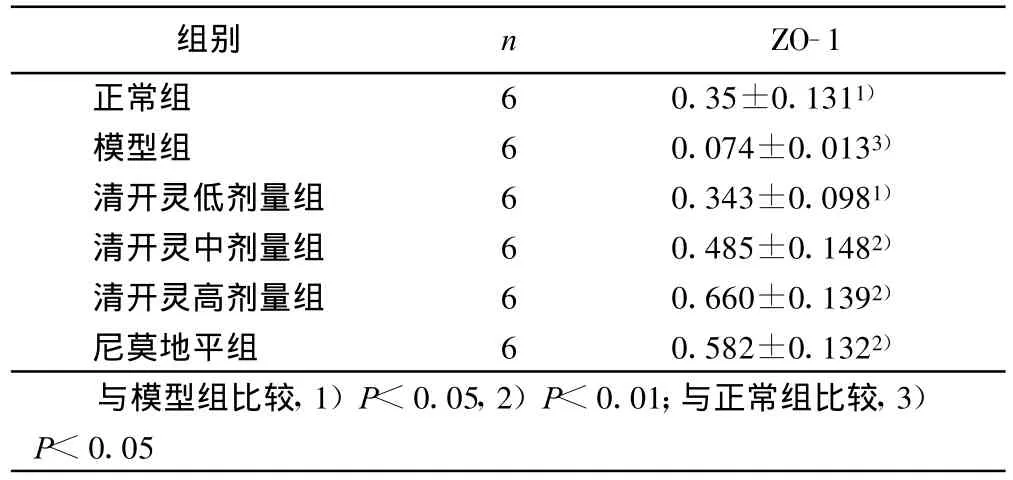
表2 ZO-1蛋白表达量(±s)
组别 n ZO-1正常组 6 0.35±0.1311)模型组 6 0.074±0.0133)清开灵低剂量组 6 0.343±0.0981)清开灵中剂量组 6 0.485±0.1482)清开灵高剂量组 6 0.660±0.1392)尼莫地平组 6 0.582±0.1322)与模型组比较,1)P<0.05,2)P<0.01;与正常组比较,3)P<0.05
3 讨 论
缺血性脑中风会首先损伤大脑的BBB,使其结构和功能发生改变,造成BBB的屏障功能下降,通透性增加[6]。Preston[7]等通过计算BBB对大分子示踪剂和水分子示踪剂通透性的转运常数发现,大鼠短暂性脑缺血再灌注后BBB通透性的增加主要是由TJ开放导致,而并非是胞饮转运增强,脑微血管内皮细胞的TJ闭锁小带长度随着再灌注时间延长逐渐减少。
脑微血管内皮细胞间的TJ是BBB最主要的物质结构基础,它能够封闭内皮细胞顶部的细胞间隙,阻止细胞外的大分子物质经细胞间隙进入组织内,是BBB发挥屏障功能的主要结构[8]。在TJ的构成及功能等方面发挥重要作用的胞质附着蛋白家族,尤其是ZO-1的缺失、分裂,与屏障渗透性的增加有着密切的关系[9]。ZO-1是第一个被证实的TJ胞质蛋白,是膜结合鸟苷酸激酶同系物家族中唯一可形成高度稳定二聚体的蛋白[10]。正常情况下,ZO-1在细胞膜表面表达,并且在胞质内有多个结合位点,能与跨膜蛋白和TJ蛋白的C端相互作用,将跨膜蛋白和细胞骨架连接在一起。同时,ZO-1还与另一个胞质附着蛋白2扣带蛋白的尾端相连,为附着蛋白和跨膜蛋白的连接提供支架。因此,ZO-1对维持TJ的连续性和完整性发挥重要作用。
BBB的破坏既是脑缺血损伤的结果,又是进一步导致脑损伤的关键环节。在缺血早期,微血管内皮细胞上炎症因子的表达使缺血性损伤向炎性损伤转变,白细胞与微血管内皮细胞黏附后从血管内向脑实质转移,改变TJ的结构,导致ZO-1的崩解,进而诱发血管源性水肿和出血[11,12]。
清开灵可以抑制缺血损伤的脑微血管内皮细胞炎症调节因子NF-κ B的表达,下调黏附分子ICAM-1和VCAM-1的表达水平,减少白细胞的黏附[13,14]。本研究发现,缺血24 h后脑微血管内皮细胞中ZO-1的基因转录及蛋白表达均明显减少,而清开灵可明显增加ZO-1的基因转录和蛋白表达,并表现出剂量依赖的趋势。但是清开灵对ZO-1基因转录和蛋白表达水平的影响并不平行,对ZO-1转录后的调节表现出更强的干预作用,使蛋白表达显著升高,清开灵高剂量组ZO-1的表达量甚至超过了正常状态下BBB的表达,这说明损伤状态下的BBB对清开灵的反应非常敏感。清开灵能通过其他途径放大其对ZO-1蛋白表达的影响。
“毒损脑络”是清开灵治疗缺血性脑中风的理论基础。该理论认为中风发病是由于毒邪损伤脑络,络脉破损或络脉拘挛瘀闭,气血渗灌失常所致[15]。脑微血管在分布和功能等方面与中医络脉相似[16],清开灵不但能够抑制缺血后白细胞活化对微血管内皮的毒性损伤,还能恢复脑微血管BBB的分子结构和功能,进而保证气血的正常运行。有关清开灵对TJ的作用机制还需进一步的研究证实。
[1]Allen CL,Bayraktutan U.Oxidative stress and its role in the pathogenesis of ischaemic stroke[J].Int J Stroke,2009,4(6):461-470.
[2]Jiao H,Wang Z,Liu Y,et al.Specific role of tight junction proteins claudin-5,occludin,and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J].J Mol Neurosci,2011,4(22):130-139.
[3]韩文刚,吴中录.清开灵注射液治疗中风的用法与疗效观察[J].河南中医,2002,22(4):60.
[4]叶靖.地坛牌清开灵治疗中风病疗效观察[J].北京中医药大学学报,2001,24(4):74-76.
[5]Lou JN,Gasche Y,Zheng L,et al.Differential reactivity of brain microvascular endothelial cells to TNF reflects the genetic susceptibility to cerebral malaria[J].Eur J Immunol,1998,28:3989-4000.
[6]茅锐,王振华.缺血再灌注对血脑屏障紧密连接蛋白的影响[J].国际病理科学与临床杂志,2010,30(3):235-242.
[7]Preston E,Foster DO.Evidence for pore-like opening of bloodbrain barrier following forebrain ischemia in rats[J].Brain Res,1997,761:4-10.
[8]Paolinelli R,Corada M,Orsenigo F,et al.T he molecular basis of the blood brain barrier differentiation and maintenance.Is it still a my stery[J].Pharmacol Res,2011,63(3):165-171.
[9]石向群,杨金升,王运良,等.脑缺血再灌注损伤后脑内ZO-1蛋白动态变化与神经功能缺损及血脑屏障功能的关系[J].中国临床康复,2005,9(1):113-115.
[10]Abbott NJ,Patabendige AA,Dolman DE,et al.Structure and function of the blood-brain barrier[J].Neurobiol Dis,2010,37(1):13-25.
[11]del Zoppo GJ,M abuchi T.Cerebral microvessel responses to focal ischemia[J].J Cereb Blood Flow Metab,2003,23(8):879-894.
[12]Mark WM,Margaret MW,Eugene BC.Roles of ZO-1,occludin,and actin in oxidant-induced barrier disruption[J].Am J Phy siol Gastrointest Liver Physiol,2006,290(2):222-231.
[13]高永红,袁拯忠,牛福玲,等.清开灵注射液对大鼠脑微血管内皮细胞缺血再灌注损伤黏附分子表达影响[J].中华中医药杂志,2008,23(3):197-199.
[14]高永红,邢雁伟,袁拯忠,等.清开灵有效组分对大鼠脑微血管内皮细胞体外缺血再灌模型核转录因子-κ B的影响[J].中西医结合学报,2009,7(2):135-137.
[15]王永炎.关于提高脑血管疾病疗效难点的思考[J].中国中西医结合杂志,1997,17(4):195-196.
[16]刘伍立,江一平.浅谈微循环与络脉的关联[J].北京中医杂志,1986,2:45-47.
