乌司他丁上调水通道蛋白1保护新生猪体外循环肺缺血/再灌注损伤
2011-05-31肖亮灿郭俊英梁孟亚黄伟明吴钟凯
荣 健,叶 升,肖亮灿,郭俊英,梁孟亚,刘 海,黄伟明,吴钟凯
(中山大学附属第一医院1.麻醉科、2.肿瘤科、3.心脏外科,广东 广州 510000)
肺缺血/再灌注损伤(ischemia reperfusion injury,IRI)引起的肺功能障碍,是体外循环心脏手术后最常见的并发症和导致死亡的主要原因之一[1]。由于未成熟肺组织的特殊解剖生理学特点,使其在体外循环期间更易于受到损伤[2]。乌司他丁(ulinastatin,UTI)是从男性尿中分离纯化的尿胰蛋白酶抑制剂,有很强的抑制水解酶的作用,能改善休克时的循环状态、对溶酶体膜起稳定作用、抑制炎症介质的释放等功能,对内毒素引起的肺损伤具有保护作用[3],但其可能的机制尚未不清楚。水通道蛋白(aquaporin,AQPs)是近年来的研究热点之一,它选择性地分布在与体液吸收或分泌有关的上皮细胞及可能协同液体跨细胞转运的内皮细胞中,执行着各部位的水分重吸收、液体分泌和细胞内外水平衡功能。AQPs有多种亚型,目前研究较多的水通道蛋白1(AQP1)具有清除支气管和脉管周围组织水分的作用[4]。研究表明,AQP1 参与腺病毒[5]、LPS[6]和高氧性[7]肺损伤中的病理性肺水肿过程。但在体外循环肺缺血/再灌注损伤中的作用未见报道。本研究采用新生猪体外循环模型,观察乌司他丁对新生猪体外循环肺缺血/再灌注后AQP1的影响,以期从分子水平探讨乌司他丁肺保护机制,寻求抑制体外循环肺缺血/再灌注损伤的新靶点。
1 材料与方法
1.1实验动物平均体质量4.9(S=0.6)kg,年龄<1月的健康新生五指山小香猪12只(广东省实验动物监测所提供),♀♂不限,依据主动脉开放前是否经肺动脉给予乌司他丁,随机分为对照组和实验组,每组6只。实验组在主动脉开放前通过肺动脉注射乌司他丁10 000 U·kg-1。
1.2麻醉方法及手术过程肌肉注射氯胺酮40 mg·kg-1和芬太尼 2 μg·kg-1,静脉注射维库溴铵0.1 mg·kg-1行气管插管,呼吸机维持机械呼吸(潮气量 13 ~15 ml·kg-1,呼吸频率12 ~16 次/分),股动、静脉分别插管测平均动脉压(mean arterial pressure,MAP)及中心静脉压(central venous pressure,CVP)。胸骨正中劈开,切开心包,右心房内注射肝素3 mg·kg-1,主动脉和上下腔静脉分别插入10F和12F插管,连接人工心肺机。升主动脉根部插入并固定16号针头,连接灌注装置。采用3M人工心肺机,polystan safe micro膜肺,Sarns变温水箱以及东莞科威医疗仪器厂的塑料管道。两组均以羟乙基淀粉130/0.4氯化钠注射液预充,预充总量(110±23)ml。
1.3CPB管理两组新生猪CPB开始后,维持流量180 ~220 ml·(min·kg)-1,并体循环 10 min,阻断升主动脉后在主动脉根部灌注4℃改良 ST.Tomas停跳液 15 ml·kg-1,阻断升主动脉60 min后开放升主动脉,开放后辅助循环90 min。开放主动脉后如心脏出现室颤者使用交流电除颤复跳。
1.4标本采集及检测指标在开胸后即刻(T1)、主动脉开放90 min实验结束前(T2)分别留取标本。通过奥林巴斯纤维支气管镜向右肺中叶注入生理盐水10 ml后负压6.65~13.3 kPa吸引,灌注4次,灌注液总量为40 ml,回收率>40%为有效。所取肺灌洗液即刻以1 000 r·min-1离心 10 min,上清液-70℃保存。左下肺组织部分以3.33 mol·L-1中性甲醛固定,部分-80℃ ~-70℃保存。肺静脉血上清液-80℃ ~-70℃保存。肺组织进行HE染色,石蜡切片,光镜下观察病理变化。将肺泡灌洗液离心所得沉淀用0.5 PBS液悬浮,取10 μl在玻片上制成直径约1 cm的细胞涂片,瑞氏-姬姆萨染色,光学显微镜下计数全片中性粒细胞(PMN),按标准体积换算浓度。ELISA法(美国MDI公司)测定肺静脉血上清液IL-6和TNF-α含量。肺组织于4℃生理盐水中漂洗,剔除结缔组织,滤纸吸干表面水分,分析天平称湿重,然后置80℃温箱内,48 h后称干重,计算 W/D。免疫组化采用浓缩型兔抗羊AQP1多克隆抗体(Santa Cruz Biotechnology,Inc)及超敏即用型S2P通用型免疫组织化学试剂盒(Maxim Biotech.Inc)。AQP1相关抗原以细胞膜或细胞质出现棕黄色颗粒为阳性反应。阴性对照除细胞核染成蓝色外,胞核和胞质内无棕黄色反应物。应用Image-Pro Plus 6.0进行图像半量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),评价指标采用AQP1累计光密度率(IOD率,the percentage of integrated optical density),即AQP1累计光密度与视野实质累计光密度的比率。以每例5个视野的平均AQP1累计光密度率作为该例的测量值。提取肺组织总蛋白,Western blot检测肺组织AQP1蛋白表达,以β-actin蛋白表达做为内参,成像系统进行分析和扫描,结果以光密度比值表示。
1.5统计学方法所有计量数据运用±s进行统计描述分析,应用SPSS 13.0统计软件进行数据分析。计数数据运用百分位数进行统计描述分析。为检验组间差异,对计数数据(discrete variable)组间比较,采用两个独立样本非参数检验(two independent samples tests);对计量数据(measurement data),采用两样本t检验(independent samplesttest)。对重复测量数据比较采用重复测量数据的方差分析(repeated measures analysis of variance)。
2 结果
2.1乌司他丁对新生猪体外循环缺血/再灌注后90 min肺组织病理变化(HE染色)的影响两组猪肺组织在实验结束时均出现炎性细胞渗出、肺间质水肿、肺间隔增厚、肺泡融合等病理改变,但实验组组织病理学损伤程度相对较轻。依据半定量方法[8]对肺损伤进行5级分类:0:无损伤;1:轻度损伤;2:中度损伤;3:严重损伤。400倍光镜下任取10个视野,计算平均每个视野所得分均值代表损伤程度。组间比较,T2时点两组肺损伤评分:(1.4±0.20vs2.8±0.11,实验组vs对照组),P<0.05。见Fig 1。
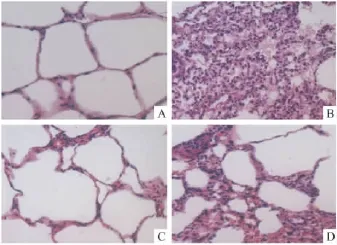
Fig 1 Lung injury of two groups by HE staining (×400)
2.2乌司他丁对新生猪体外循环缺血/再灌注后90 min肺泡灌洗液中PMN计数两组肺泡灌洗液PMN基础值差异无统计学意义(P>0.05),再灌注90 min两组均上升,但实验组明显低于对照组,P<0.05,见 Fig 2。
2.3乌司他丁对新生猪体外循环肺静脉血IL-6和TNF-α含量的影响两组新生猪肺静脉血浆IL-6和TNF-α含量基础值差异无统计学意义(P>0.05)。T2时点组间比较,实验组IL-6和TNF-α含量明显低于对照组,P<0.05,见Fig 3。
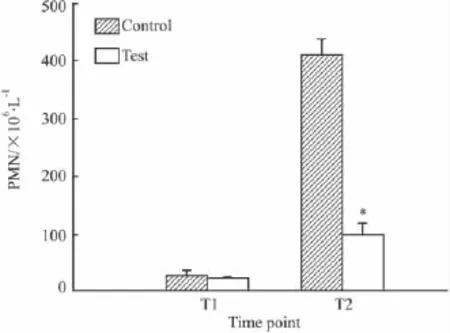
Fig 2 PMN in BALF of two groups
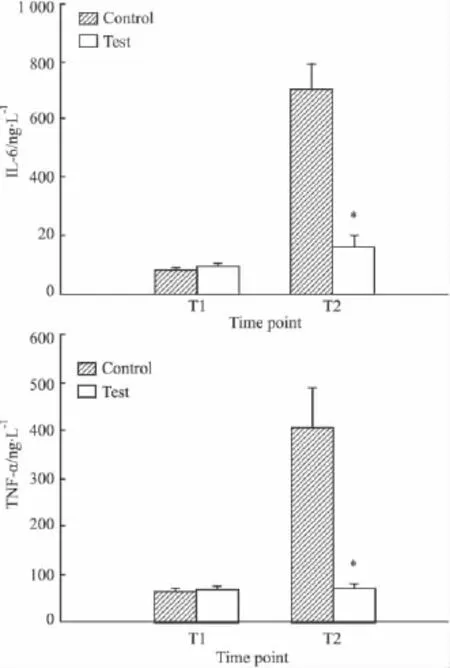
Fig 3 IL-6 and TNF-α of two groups(±s)
Tab 1 W/D weight of two groups(±s,n=6)
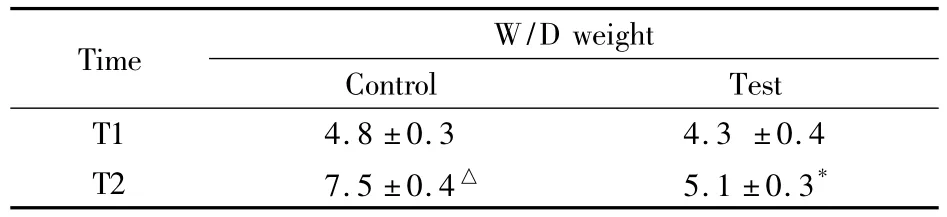
Tab 1 W/D weight of two groups(±s,n=6)
T1:after anesthesia;T2:90 min after declamping.*P <0.05 vs between two groups;△P <0.05 vs T1 in group.
Time W/D weight Control Test T1 4.8 ±0.3 4.3 ±0.4 T2 7.5 ±0.4△ 5.1 ±0.3*
2.4乌司他丁对新生猪体外循环肺组织湿干比重(W/D)的影响两组相比,两组W/D基础值差异无统计学意义(P>0.05),实验组W/D在实验终点均与对照组差异有统计学意义(P<0.05)。见Tab 1。2.5乌司他丁对新生猪体外循环缺血/再灌注后90 min AQP1的影响AQP1阳性染色呈现深棕黄色。可见AQP1主要分布于肺血管内皮和肺泡上皮。与对照组相应时点比较,实验组在T2时点AQP1染色较浓密,提示表达上调。应用Image-Pro Plus 6.0分析,实验组AQP1累计光密度率(IOD率,AQP1累计光密度与视野实质累计光密度的比率)在实验组 T2明显高于对照组,36.05%vs18.2%,P<0.05,见 Fig 4。Western blot检测 AQP1蛋白表达表现出相同的趋势,实验组T2 AQP1表达明显高于对照组T2,P<0.05,见Fig 5。

Fig 4 Expression of AQP1 by immunohistochemistry(×400)

Fig 5 Western blot analysis(B)for AQP1 expression in pulmonary tissue from pig
3 讨论
3.1乌司他丁对新生猪体外循环肺缺血/再灌注损伤的保护作用肺缺血/再灌注引起的肺损伤是临床体外循环术后最主要的并发症之一,其发病率高达15% ~30%[1]。再灌注后氧供突然增加,机体产生大量过氧化产物;同时更多的炎性介质、细胞因子在原来体外循环本身引起的炎性反应的基础上进入循环,引起严重的正反馈性全身性炎症反应,导致器官损伤[9]。未成熟肺脏容量小;功能残气量(FRC)相对较少;肺泡/体表面积比明显小于成人;肺血管内皮通透性较高,存在通气/血流比失调和肺内分流;肺表面活性物质合成及储备较低[10],这些生理特点使其在体外循环期间更易于受到损伤[2]。丝氨酸蛋白酶抑制剂乌司他丁是一种内源性抗侵袭物质,可抑制炎症级联反应的多个环节,具有防治肺损伤的功效[11]。本实验对照组中,反映肺组织损伤的HE染色观察结果,反映肺组织白细胞浸润的肺泡灌洗液中PMN计数、炎症级联反应中的主要炎性介质TNF-α、反应组织损伤程度的敏感指标IL-6和肺组织含水指标W/D在实验结束时明显增加,表明体外循环新生猪发生了缺血/再灌注损伤。给予乌司他丁可以明显改善上述指标,说明乌司他丁有效抑制了体外循环肺缺血/再灌注损伤引起的肺通透性增强、肺水肿形成和白细胞浸润,具有一定的肺保护作用,与其他研究结果[10]相符。
3.2AQP1与新生猪体外循环肺缺血/再灌注早期损伤AQPs又称水孔蛋白,是细胞膜上一种与水的通透性有关的转运蛋白。自从1991年被发现[12],迄今为止共有200余种 AQPs在不同物种中被发现。肺内AQP1主要分布于肺血管内皮。AQP1减轻急性肺损伤中的通透性肺水肿[5-6],AQP1敲除小鼠肺血管内皮通透性降低10倍,从而导致严重肺水肿[13]。皮质类固醇可促进AQP1表达,从而减轻肺水肿[14]。AQP1是否参与体外循环肺缺血/再灌注损伤以及乌司他丁肺保护作用是否与AQP1有关均未见报道。
我们在猪体外循环中发现,对照组AQP1蛋白表达在实验结束时明显升高,表明在再灌注期有AQP1合成过程,提示AQP1参与了体外循环肺缺血/再灌注早期损伤的机体自身的保护过程。在实验组中给予乌司他丁,AQP1的表达较对照组明显增高,下游的IL-6和 TNF-α也较对照组降低。提示乌司他丁不仅具有体外循环肺缺血/再灌注损伤保护作用,而且其可能的机制是通过促进AQP1合成实现的。
由于大动物模型的限制,本实验不能通过阻断途径反向验证AQP1在体外循环肺缺血/再灌注损伤中的确切机制。虽然APQ1与AQP5在肺泡腔与毛细血管之间水分子的运转具有同等重要的作用,但AQP5主要分布于肺泡I型细胞上不易鉴别,并且有研究表明在新生鼠中AQP5表达非常低微[15],因此本实验未对AQP5进行探讨。
3.3乌司他丁的肺保护作用模型探讨虽然众多研究均显示乌司他丁具有肺保护作用,但在体外循环肺缺血/再灌注早期损伤中的作用未见报道。大部分研究关注于乌司他丁对体外循环本身引起的全身炎性反应中肺部表现的保护。由于体外循环肺缺血/再灌注损伤,属于不完全性肺缺血/再灌注损伤[16],因此其导致的肺损伤不能等同于体外循环本身引起的肺部损伤。因此本实验选择主动脉开放前通过肺动脉注射乌司他丁。实验结果提示此种方法具有肺缺血/再灌注损伤保护作用。
3.4小结乌司他丁对新生猪体外循环缺血/再灌注导致的肺损伤具有一定的保护作用,可能的作用机制与其促进AQP1合成有关。提示未来可针对AQP1阻断途径进行进一步探讨。
[1]Apostolakis E,Filos K S,Koletsis E,Dougenis D.Lung dysfunction following cardiopulmonary bypass[J].J Card Surg,2010,25(1):47-55.
[2]Mills A N,Haworth S G.Greater permeability of the neonatal lung.Postnatal changes in surface charge and biochemistry of porcine pulmonary capillary endothelium[J].J Thorac Cardiovasc Surg,1991,101(5):909 -16.
[3]李秀江,杜玉君,董均树,等.乌司他丁对内毒素诱导的脏器损伤的保护作用[J].中国药理学通报,2006,22(11):1387 -9.
[3]Li X J,Du Y J,Dong J S,et al.Protective effects of ulinastatin on injury of organs induced by endotoxin[J].Chin Pharmacol Bull,2006,22(11):1387 -9.
[4]Nielsen S,King L S,Christensen B M,Agre P.Aquaporins in complex tissuesⅡsubcellular distribution in respiratory and glandular tissues of rat[J].Am J Physiol,1997,273(5 pt 1):1549 -61.
[5]Towne J E,Harrod K S,Krane C M,et al.Decreased expression of aquaporin(AQP)1 and AQP5 in mouse lung after acute viral infection[J].Am J Respir Cell Mol Biol,2000,22(1):34 - 44.
[6]Jiao G,Li E,Yu R.Decreased expression of AQP1 and AQP5 in acute injured lungs in rats[J].Chin Med J(Engl),2002,115:963-7.
[7]Song Y,Ma T,Matthay M A,Verkman A S.Role of aquaporin-4 in airspace-to-capillary water permeability in intact mouse lung measured by a novel gravimetric method[J].J Gen Physiol,2000,115(1):17 -27.
[8]King J,Deboisblanc B P,Mason C M,et al.Effect of granulocyte colony-stimulating factor on acure lung injury in the rat[J].Am J Respir Crit Care Med,1995,151(2 Pt 1):302-9.
[9]荣 健,叶 升,江 楠,等.七氟醚后处理下调RAGE抑制犬体外循环肺缺血/再灌注损伤[J].中国药理学通报,2010,26(6):723-26.
[9]Rong J,Ye S,Jiang N,et al.Sevoflurane postconditioning protects the lung against ischemia-reperfusion injury with CPB by downregulating RAGE[J].Chin Pharmacol Bull,2010,26(6):723-6.
[10]吴瑞萍,诸福棠.实用儿科学[M].北京:人民卫生出版社,1996:85- 97,1101-15.
[10]Wu R P,Zhu F T.Practical Pediatrics[M].Beijing:People’s Medical Publishing House,1996:85 -97,1101 -15.
[11]Nakanishi K,Takeda S,Sakamoto A,Kitamura A.Effects of ulinastatin treatment on the cardiopulmonary bypass-induced hemodynamic instability and pulmonary dysfunction[J].Critical Care Med,2006,34(5):1351 -7.
[12]Preston G M,Agre P.Isolation of the cDNA for erythrocyte integral membrane protein of 28 kilodaltons:member of an ancient channel family[J].Proc Natl Acad Sci USA,1991,88(24):11110-4.
[13]Bai C,Fukuda N,Song Y,et al.Lung fluid transport in aquaporin-1 and aquaporin-4 knockout mice[J].J Clin Invest,1999,103(4):555-61.
[14]King L S,Nielsen S,Agre P.Aquaporin-1 water channel protein in lung:ontogeny,steroid-induced expression,and distribution in rat[J].J Clin Invest,1996,97(10):2183 - 91.
[15]Ruddy M K,Drazen J M,Pitkanen O M,et al.Modulation of aquaporin 4 and the amiloride-inhibitable sodium channel in perinatal rat lung epithelial cells[J].Am J Physiol,1998,274(6 Pt 1):L1066-72.
[16]Schlensak C,Doenst T,Preusser S,et al.Cardiopulmonary bypass reduction of bronchial blood flow:A potential mechanism for lung injury in a neonatal pig model[J].J Thor Cardiovascul Surg,2002,123:1199 -205.
