牛磺酸对肾NRK-52E细胞缺氧/复氧损伤的保护及初步机制
2011-05-31万慧芳王美凤余乐涵杨晓红万福生
龚 慧,万慧芳,王美凤,涂 硕,余乐涵,杨晓红,万福生
(1.南昌大学医学院生物化学与分子生物学教研室,江西南昌 330006;2.南昌市第一医院护理部,江西南昌 330008)
牛磺酸(taurine,Tau)在生物体内参与一系列的生理学过程,如与胆汁酸结合、调节渗透压、细胞钙流动调节、抗氧化和抗心律失常等[1-3]。研究表明[2-3],Tau 可下调缺血/再灌注(I/R)心肌和肝细胞内质网GRP78、减少细胞凋亡。研究也表明[4],Tau对大鼠急性肾小管坏死、膜性肾病、糖尿病肾病、局灶节段性肾小球硬化等多种肾脏病具有防治作用,其确切机制尚未完全阐明。本实验拟在建立肾小管上皮细胞株NRK-52E细胞缺氧/复氧 (H/R)模型上,观察Tau对NRK-52E细胞H/R损伤的保护作用及其初步机制。
1 材料与方法
1.1材料与分组大鼠肾小管上皮细胞株NRK-52E细胞购自美国ATCC公司。取对数增长期的NRK-52E细胞,随机分为正常对照组、H/R组和H/R+Tau组,具体操作如下:① 正常对照组:正常培养的肾小管上皮细胞。②H/R组:取缺氧8 h/复氧12 h(以Caspase-12活性最强而定)。③ H/R+Tau组:于培养基中加入牛磺酸液(终浓度为10、20、40、80 mmol·L-1),余操作同 H/R 组。
1.2NRK-52E细胞缺氧/复氧模型的建立从液氮罐中取出冻存的NRK-52E细胞投入37℃的水浴箱中,充分摇动使其尽快解冻,复苏。吸出细胞悬液并滴加10倍体积的含10%(V/V)新生牛血清的高糖 DMEM 培养基,混匀,1 000 r·min-1离心 5 min,弃上清液后再重复洗涤1次。用含10%牛血清的高糖DMEM培养基将细胞悬液稀释混匀,接种于50 ml培养瓶中,37℃下置入体积分数为5%的CO2细胞培养箱中静置12 h,换液除去未贴壁细胞。待细胞汇合80%后换成无血清的高糖DMEM进行同步化培养24 h,而后将培养瓶置于含95%N2-5%CO2(V/V)混合气体的密闭容器中(37℃)进行缺氧孵育8 h,再进行复氧孵育12 h。
1.3台盼蓝排斥试验进行细胞计数及检测细胞存活率制备单个细胞悬液,并作适当稀释(109·L-1)。染色:取9滴细胞悬液移入小试管中,加1滴0.4%台盼蓝溶液,混匀。计数:在3 min内,用血球计数板分别计数活细胞和死细胞。镜下观察,死细胞被染成淡蓝色,而活细胞拒染。根据下式求细胞存活率/%。

1.4分析GRP78、Caspase-12和Caspase-3的mRNA表达采用TRIzol法提取总RNA,经逆转录后得cDNA,进行PCR。各取 cDNA产物2 μl,待测GAPDH 和 GRP78、Caspase-12、Caspase-3 的正、反义引物(见 Tab 1)各 1 μl(10 μmol·L-1),2 × Taq PCR Master Mix 8.5 μl,ddH2O 12.5 μl,总反应体积25 μl。反应条件:94℃ 3 min;94℃ 45 s,60℃ 45 s,72℃ 45 s,35个循环;结束前72℃延伸10 min。分别取PCR产物6 μl,经1.5%琼脂糖凝胶电泳,用凝胶成像系统观察结果,计算并比较各组目的基因的相对表达量。

Tab 1 RT-PCR primer sequences and fragment
1.5检测NRK-52E细胞GRP78、Caspase-12、Caspase-3蛋白的表达经离心收集培养细胞,用预冷PBS漂洗2次,加入含PMSF裂解液400 μl,冰上裂解30 min;然后将细胞转移至 EP管中,离心(12 000×g,4℃)5 min,上清转移至另一 EP管中。取上清50 μl加入2×蛋白提取Loading buffer 40 μl和 10 μl DTT,煮沸 10 min,取 8 μl上样,进行 SDS-聚丙烯酰胺凝胶(12%分离胶和5%积层胶)电泳。电泳结束后,将蛋白转移到PVDF膜上;在含5%脱脂奶粉的TBST中缓慢振荡过夜,分别加入抗β-actin兔抗大鼠多克隆抗体(1∶5 000)、抗GRP78兔抗大鼠多克隆抗体(1∶500)、Caspase-12兔抗大鼠多克隆抗体(1∶1 000)和Caspase-3兔抗大鼠多克隆抗体(1∶500)等一抗,室温缓慢振荡2 h后,加入结合缓冲液稀释的二抗,曝光、显影并定影,半定量分析。
1.6流式细胞仪检测肾小管上皮细胞凋亡率采用Annexin V-FITC和PI联合染色的流式细胞仪检测细胞凋亡率。0.25%胰蛋白酶消化收集肾小管上皮细胞。用500 μl Binding Buffer重悬细胞后,加入FITC 标记的Annexin-V(40 mg·L-1)和PI(50 mg·L-1)各5 μl,避光反应 5 min。用 FACScan 检测各组心肌细胞凋亡水平。设正常细胞且不加Annexin V-FITC及PI的一管作为阴性对照组。
1.7流式细胞仪检测肾小管上皮细胞内游离钙离子浓度用0.25%的胰酶消化并收集细胞。钙敏感荧光探针采用Fluo-3/AM,向收集的细胞中加入终浓度为 1 μmol·L-1的 Fluo-3/AM。振荡混匀,37℃避光孵育45 min,再用PBS洗涤2遍,去除未结合的染料。再孵育15 min后送流式细胞仪检测,Fluo-3/AM的激发光488 nm,吸收光526 nm,共计数10 000个细胞,使用荧光强度来反映细胞内钙离子浓度的变化。
1.8统计学处理结果用±s表示,统计方法采用SPSS 13.0统计软件行方差齐性检验、单因素方差分析(one-way ANOVA)。
2 结果
2.1各组NRK-52E细胞存活率情况对各组细胞进行活细胞计数及细胞存活率的比较(见Tab 2)。细胞给予缺氧/复氧刺激后其生长增值较正常对照组减慢,牛磺酸处理组除10 mmol·L-1浓度组差异无统计学意义外(P>0.05),其余浓度组情况均优于H/R组(均P<0.01)。
Tab 2 Cell count and survival rate in each group(±s,n=6)

Tab 2 Cell count and survival rate in each group(±s,n=6)
**P<0.01 vs control;#P<0.05,##P<0.01 vs H/R
Group Cell count/106·L-1Cell survival rate/%Control 6.36 ±0.91 96.79 ±2.31 H/R 3.40 ±0.50** 52.21 ±6.84**Tau 10 mmol·L-1 3.68 ±0.43** 56.42 ±6.37**Tau 20 mmol·L-1 4.12 ±0.49**# 63.40 ±8.94**##Tau 40 mmol·L-1 4.89 ±0.78**## 74.49 ±6.76**##Tau 80 mmol·L-1 5.20 ±0.81**## 79.36 ±7.03**##
2.2NRK-52E细胞GRP78、Caspase-12和Caspase-3 mRNA表达变化RT-PCR电泳结果显示,除80 mmol·L-1牛磺酸组外,各浓度牛磺酸处理组GRP78/GAPDH、Caspase-12/GAPDH和Caspase-3/GAPDH光密度值之比与正常对照组相比亦有增高(P<0.01),且随着牛磺酸终浓度的增加而呈逐渐降低的趋势(Fig 1),但均明显低于H/R组(P<0.05)。

Fig 1 mRNA expression of GRP78,Caspase-12 and Caspase-3 in NRK-52E cells
2.3NRK-52E细胞GRP78、Caspase-12及Caspase-3蛋白表达变化Western blot方法检测各组NRK-52E细胞 GRP78、Caspase-12及 Caspase-3蛋白表达。结果显示(Fig 2),与正常对照组相比,H/R组和各浓度牛磺酸处理组的 GRP78、Caspase-12及Caspase-3蛋白表达均明显增高(P<0.01);但牛磺酸处理组GRP78、Caspase-12及Caspase-3蛋白表达量均低于H/R组,差异具有显著性(P<0.01)。
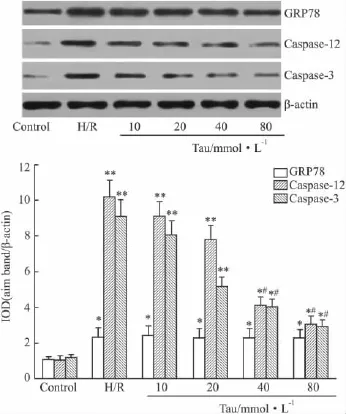
Fig 2 Protein expression of GRP78,Caspase-12 and Caspase-3 in NRK-52E cells
2.4各组NRK-52E细胞Caspase-3活性和凋亡率经荧光分析测得H/R组(2.88±0.19)NRK-52E细胞Caspase-3活性是对照组(0.31±0.06)的9.3倍(P<0.01);各浓度牛磺酸处理组的Caspase-3活性为(1.23±0.16)、(0.95±0.09)、(0.75±0.08)和(0.48±0.06),与 H/R组比较均降低(P<0.01),且有剂量依赖性。表明牛磺酸对H/R损伤NRK-52E细胞的Caspase-3活化升高有较好的抑制作用。
Annexin-V/PI双染法流式细胞仪检测结果显示,与正常对照组相比,H/R组凋亡程度明显增加(P<0.01);与H/R组比较,牛磺酸处理组细胞凋亡率明显降低,除10 mmol·L-1浓度组外,凋亡率与H/R组相比差异有显著性(P<0.01)。表明牛磺酸可减少由缺氧/复氧引起的NRK-52E细胞凋亡并且呈现一定的剂量依赖性(Fig 3)。
2.5NRK-52E细胞胞内Ca2+荧光强度的变化流式细胞仪检测显示NRK-52E细胞H/R后平均胞内钙荧光强度值明显升高(P<0.01),与H/R组相比,牛磺酸处理后平均胞内钙荧光强度值下降(P<0.05),且随牛磺酸终浓度的增加,平均胞内钙荧光强度值有逐渐降低的趋势,并呈现一定的剂量依赖性(Fig 4)。
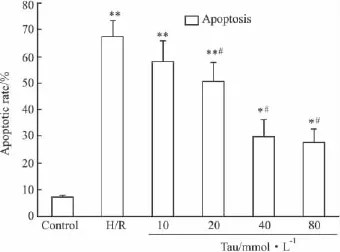
Fig 3 The change of apoptotic rate in NRK-52E cells by flow cytometry
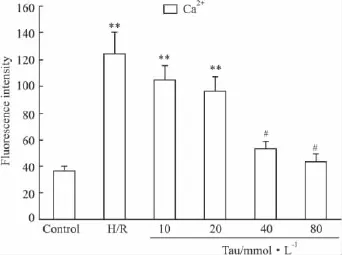
Fig 4 The fluorescence intensity of intracellular Ca2+in NRK-52E cells
3 讨论
大量研究表明[5-7],肾缺血/再灌注诱导了内质网应激(endoplasmic reticulum stress,ERS)反应。ERS是诱导心肌和肾脏等重要脏器细胞损伤的重要因素[8-9],Bando 等[10]发现急性肾衰患者的肾组织出现ERS,在低氧状态下培养的肾小管细胞也出现ERS。Hao等[11]和 Montie 等[12]发现肾小管上皮细胞缺氧/复氧可触发 ERS,包括诱导 GRP94、CHOP表达,激活Caspase-12,诱导细胞凋亡。本实验结果显示,NRK-52E细胞缺氧/复氧刺激后,ERS蛋白GRP78表达明显上调,细胞凋亡率增加。说明ERS参与了大鼠肾小管上皮细胞缺氧/复氧损伤。近年来研究证实,肾小管上皮细胞凋亡在肾缺血/再灌注损伤过程中起关键作用[13],激活肾小球和肾小管上皮细胞凋亡的途径包括存活因子的缺失、死亡受体激活、线粒体损伤、溶酶体失稳态和ERS等[14]。本实验结果显示:NRK-52E细胞缺氧/复氧刺激后,ERS标志性蛋白GRP78和内质网特异性凋亡诱导蛋白Caspase-12升高,表明肾小管上皮细胞缺氧/复氧损伤可通过内质网应激并活化Caspase-12来触发凋亡。牛磺酸处理组 NRK-52E细胞 GRP78、Caspase-12和Caspase-3表达及细胞凋亡率均下降。提示牛磺酸能抑制缺氧/复氧刺激引起NRK-52E细胞凋亡,其部分机制是通过抑制内质网Caspase-12凋亡信号通路而实现的。
有研究认为内质网在维持胞内游离Ca2+稳态方面发挥了关键性作用。静息状态下,内质网中Ca2+浓度比胞质高得多,维持这一外低内高的Ca2+梯度和Ca2+稳态是内质网上3种与Ca2+的摄入和释放相关的通道[15],分别是将Ca2+从胞质中转运至内质网的Ca2+泵(Ca2+ATPase)或肌质网Ca2+泵(SERCA)以及向胞质内释放 Ca2+的 1,4,5-三磷酸肌醇受体(IP3R)和蓝尼叮受体(ryanodine receptor,RyR)。为进一步深入研究Tau在调节缺氧/复氧刺激后NRK-52E细胞内Ca2+稳态的作用,用流式细胞仪检测了NRK-52E细胞内钙荧光强度。结果发现,H/R组平均胞内钙荧光强度值较对照组有明显升高(P<0.01);与H/R组相比,牛磺酸处理组平均胞内钙荧光强度下降(P<0.05),且呈一定的剂量依赖性,说明牛磺酸具有减少细胞内游离钙离子浓度,抑制钙超载的作用。总之,本文结果表明,牛磺酸对肾小管上皮NRK-52E细胞缺氧/复氧损伤具有较好的抑制作用,且呈一定剂量依赖性,其机制主要是降低内质网应激蛋白GRP78和 Caspase-12、Caspase-3的表达,调节胞内钙稳态,减少细胞凋亡,详细机制有待进一步深入研究。
[1]龚文华,万福生,李国辉.牛磺酸对烧伤大鼠心肌细胞凋亡的影响及其机制[J].中国病理生理杂志,2006,22(11):2259-61.
[1]Gong W H,Wan F S,Li G H.Effect of taurine on apoptosis in the myocardium of the rats with severe burns[J].Chin J Pathophysiol,2006,22(11):2259 -61.
[2]殷嫦嫦,何海翔,许宝华,等.严重烧伤诱导大鼠心肌细胞内质网应激反应[J].南昌大学学报(理科版),2007,31(5):481 -4.
[2]Yi C C,He H X,Xu B H,et al.Severe burn induced endoplasmic reticulum stress in rat cardiomyocyte[J].J Nanchang Univ(Nat Sci),2007,31(5):481-4.
[3]高艳丽,谌贻璞.牛磺酸与肾脏[J].国外医学泌尿系统分册,2003,23(6):734 -7.
[3]Gao Y L,Chen Y P.Taurine and kidney[J].Foreign Med Sci:Urol Nephrol,2003,23(6):734 - 7.
[4]龚 慧,万福生.肾缺血/再灌注损伤与内质网应激[J],南昌大学学报(医学版),2010,50(1):121-3.
[4]Gong H,Wan F S.Renal ischemia reperfusion injury and endoplasmic reticulum stress[J].J Nanchang Univ(Med Sci),2010,50(1):121-3.
[5]Inagi R.Endoplasmic reticulum stress in the kidney as a novel mediator of kidney injury[J].Nephron Exp Nephrol,2009,112(1):e1-9.
[6]Szegezdi E,Logue S E,Gorman A M,Samali A.Mediators of endoplasmic reticulum stress-induced apoptosis[J].EMBO Rep,2006,7(9):880-5.
[7]Kitamura M.Endoplasmic reticulum stress and unfolded protein response in renal pathophysiology:Janus faces[J].Am J Physiol-Renal Physiol,2008,295(2):F323 -34.
[8]付晶晶,段 荣,李 红,万福生.PUMA介导大鼠缺氧/复氧心肌细胞凋亡的研究[J].中国药理学通报,2011,27(3):312 -6.
[8]Fu J J,Duan R,Li H,Wan F S.The effect and significance of PUMA in rat cardiomyocyte hypoxia/reoxygenation injury[J].Chin Pharmacol Bull,2011,27(3):312 -6.
[9]张艳侠,刘丹花,角灿武,等.前列腺素E-1预处理对缺血/再灌注心肌PKC及HSP70表达的影响[J].中国药理学通报,2011,27(3):402-5.
[9]Zhang Y X,Liu D H,Jiao C W,et al.Effects of prostaglandin E1 on PKC and HSP70 in ischemia/reperfusion oreconditioning myocyte[J].Chin Pharmacol Bull,2011,27(3):402 -5.
[10]Bando Y,Tsukamoto Y,Katayama T,et al.ORP150/HSP12A protects renal tubular epithelium from ischemia-induced cell death[J].FASEB J,2004,18(12):1401 -3.
[11]Hao W,Takano T,Guillemette J,et al.Induction of apoptosis by the Ste20-like kinase SLK,a germinal center kinase that activates apoptosis signal-regulating kinase and p38[J].Biol Chem,2006,281(6):3075-84.
[12]Montie H L,Kayali F,Haezebrouck A J,et al.Renal ischemia and reperfusion activates the eIF2 alpha kinase pERK[J].Biochim Biophys Acta,2005,1741(3):314-24.
[13]Toronyi E.Role of apoptosis in the kidney after reperfusion[J].Orv Hetil,2008,149(7):305 -15.
[14]Sanz A B,Santamaría B,Ruiz-Ortega M,et al.Mechanisms of renal apoptosis in health and disease[J].J Am Soc Nephrol,2008,19(9):1634-42.
[15]Vázquez-Martínez O,Cañedo-Merino R,Díaz-Muñoz M,Riesgo-Escovar J R.Biochemical characterization,distribution and phylogenetic analysis of Drosophila melanogaster ryanodine and IP3 receptors,and thapsigargin-sensitive Ca2+ATPase[J].J Cell SCI,2003,116(Pt 12):2483 - 94.
