微柱离心结合双波长考马斯亮蓝法/酶标仪法测定牛血清白蛋白脂质体的包封率Δ
2011-05-23侯冬枝梁晓晖赵世洪刘长科平其能刘军广东药学院广州市510006中国药科大学南京市10009南京医科大学第二附属医院南京市10011
侯冬枝,梁晓晖,赵世洪,刘长科,平其能,刘军(1.广东药学院,广州市 510006;.中国药科大学,南京市 10009;.南京医科大学第二附属医院,南京市 10011)
脂质体作为蛋白质、多肽类药物载体,可避免其过早被生物酶降解,增加药物的稳定性,国内、外学者已将其广泛应用到如胰岛素、白细胞介素等生物活性大分子药物的研究中[1,2]。笔者利用逆相蒸发法将牛血清白蛋白(BSA)包封于脂质体中,以增加其稳定性。为检测该脂质体的包封率,笔者将葡聚糖凝胶DEAE-Sephadex A50微柱离心与双波长考马斯亮蓝法/酶标仪法结合,建立了可以用于BSA脂质体包封率测定中对痕量蛋白质检测的方法,所需样品量仅为100 μL,一次即可进行较大量样本的检测,且操作快速、简单、重复性好。
1 仪器与试药
1.1 仪器
BS214D电子分析天平(德国赛多利斯公司);RE-52A旋转蒸发仪(上海亚荣生化仪器);循环水式多用真空泵(郑州长城科工贸公司);550酶标仪(美国Bio-Rad公司)。
1.2 试药
BSA脂质体(批号:20061022,BSA含量:800 ng·mL-1)和空白脂质体(批号:20061011)均由中国药科大学药剂学平其能教授实验室自制;大豆磷脂(以下简称磷脂,上海太伟药业有限公司,注射级);考马斯亮蓝(美国Amresco公司,G-250型);BSA(南京生兴科技有限公司,含量:≥98%);葡聚糖凝胶DEAE-Sephadex A50(美国Pharmcia公司);胆固醇、95%乙醇、浓磷酸、乙醚、正己烷等均为分析纯。
2 方法与结果
2.1 空白脂质体和BSA脂质体的制备
采用逆相蒸发法制备空白脂质体和BSA脂质体。具体如下:称取处方量磷脂、胆固醇和吐温-80置于茄形瓶中,加入适量混合溶剂(乙醚-正己烷=10∶1),待膜材溶解后,滤膜过滤,注射器注入BSA水溶液适量,短时超声使成乳液后,置于0℃冰水浴减压旋转蒸发,至胶态后,再继续旋转蒸发,直至得到BSA脂质体混悬液。最终制得样品中的BSA含量为800 ng·mL-1。
空白脂质体制备方法同上,只缺少注入BSA水溶液的步骤。
2.2 染料的制备
将100 mg考马斯亮蓝溶解在50 mL 95%乙醇中,再加入100 mL的浓磷酸(85%,W/V),最后加蒸馏水至1000 mL,过滤,冷藏避光保存。
2.3 双波长考马斯亮蓝法/酶标仪法含量测定方法的建立
2.3.1 BSA样品液与染料体积比的确定。在洁净小离心管中精密加入以纯净水溶解制备的BSA样品液,使其浓度分别为0.25、0.5、1、2、4、8、16、32 μg·mL-1,再加入“2.2”项下制备的染料,使样品与染料体积比分别为1∶1、1∶3、1∶4,轻轻振摇均匀,取出200 μL置于酶标板中,反应10 min后,以595、450 nm作为检测波长测定吸光度,以A595/A450值对BSA浓度(c)进行线性回归,得回归方程的相关系数分别为0.9856、0.9992、0.9980,表明BSA样品液与染料体积比为1∶3时,线性相关性较好,因此本试验中选择样品液与染料体积比为1∶3。
2.3.2 反应时间的确定。在洁净小离心管中精密加入4 μg·mL-1BSA溶液100 μL,再加入300 μL染料,轻轻振摇,取200 μL置于酶标板中,以595、450 nm作为检测波长,分别于反应2.5、5、10、20、30、40、50、60 min后测定吸光度,计算A595/A450。测定结果见图1。
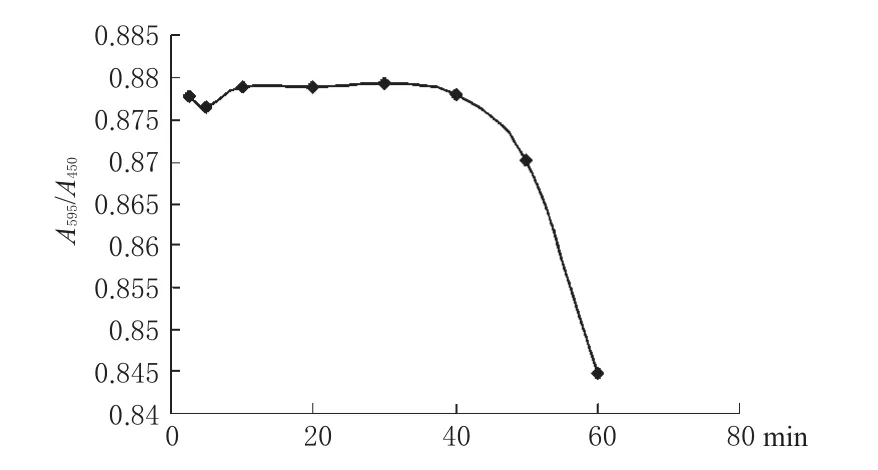
图1 吸光度值-反应时间曲线Fig 1 Absorbance-reaction time curves
图1结果表明,反应时间在10 min以前,BSA与染料未反应完全,30 min以后,体系不稳定,明显褪色,因此反应时间应控制在10~30 min之间,本研究将反应时间选定为10 min。
2.3.3 测定方法的确定。根据上述试验,最终确定的测定方法为:在离心管中精密加入100 μL待测样品,再加入300 μL染料,轻轻振摇,取200 μL置于酶标板中,以595、450 nm作为检测波长,反应10 min后测定吸光度。
2.3.4 标准曲线的绘制。制备0.25、0.5、1、2、4、8、16、32 μg·mL-1系列浓度待测样品,按照“2.3.3”项下方法进行操作,以A595/A450值对BSA浓度(c)进行线性回归,得标准曲线方程为:A595/A450=0.1168c+0.7791(r=0.9992)。结果表明BSA检测浓度线性范围为0.25~32 μg·mL-1。
2.3.5 方法回收率考察。在离心管中分别精密加入0.25、4、32 μg·mL-1的待测样品各4份,按照“2.3.3”项下方法进行操作,计算回收率,结果平均回收率为99.56%,RSD=1.52%,表明方法回收率良好,详见表1。
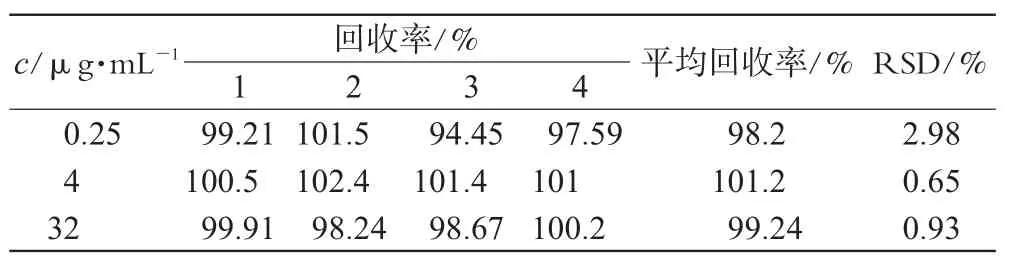
表1 回收率试验结果Tab 1 Results of recovery tests
2.3.6 方法精密度试验。在离心管中分别精密加入0.25、4、32 μg·mL-1的待测样品各4份,按精密度试验方法操作并计算,结果各浓度组RSD分别为2.73%、0.95%、1.62%。
2.4 BSA脂质体包封率的测定
2.4.1 DEAE-Sephadex A50微柱离心法。(1)凝胶的活化处理。称取少许DEAE-Sephadex A50颗粒于水中浸泡,并在搅拌下加入0.0175 mol·L-1、pH6.3 磷酸盐缓冲液1000 mL,室温放置过夜,第2天用同一缓冲液洗3~4次,倾出上层较小颗粒后,进行装柱、平衡。(2)微柱离心分离步骤。于自制的微型离心柱中加入上述活化处理后的DEAE-Sephadex A50至5 mL体积处,将此柱置于塑料离心管中,1500 r·min-1离心3 min除水,准备上样。精密吸取0.2 mL BSA脂质体混悬液上柱,500 r·min-1离心5 min。加水0.3 mL,1500 r·min-1离心8 min,收集离心液。
2.4.2 DEAE-Sephadex A50微柱离心法柱系统的考察。(1)微柱对空白脂质体的回收率。为考察自制微柱对脂质体是否有吸附,以空白脂质体进行下述试验:微柱离心除去水分,精密吸取0.2 mL空白脂质体,上柱4份,按照“2.3.5”项下方法操作,收集离心液;另取0.2 mL空白脂质体4份,加水0.3 mL;分别将离心液及空白脂质体置于10 mL容量瓶中,用混合溶剂(乙醚-异丙醇-水=1∶2∶2)定容至刻度,于267 nm波长下测定吸光度。按照下式计算微柱对空白脂质体的回收率:回收率(%)=A离心液/A脂质体×100%(A离心液为上柱离心处理后得到液体的吸光度值,A脂质体为空白脂质体的吸光度值)。结果,平均回收率为97.78%(RSD=0.18%)。(2)微柱分离效率。将微柱离心除水,精密量取5 μg·mL-1BSA溶液0.8 mL,加入0.2 mL空白脂质体成为混合液。从中精密吸取0.2 mL上柱(n=4),以下按照“2.4.1”项中“微柱离心分离步骤”项下方法操作,收集离心液;另从混合液中精密吸取0.2 mL,加水0.3 mL,混合后作为混悬液,分别在滤液和混悬液中加10%乳化剂辛基酚聚氧乙烯醚(OP)0.5 mL振摇,按照“2.3.3”项下方法操作,计算A595/A450,代入回归方程计算离心液及混悬液中BSA的浓度c离心液、c混悬液,根据柱分离效率(%)=[1-(c离心液/c混悬液)]×100%计算,得其值大于90%,说明柱分离效率较好。
2.4.3 BSA脂质体包封率测定。(1)脂质体混悬液中的BSA的含量测定。精密加入0.2 mL BSA脂质体混悬液于5 mL容量瓶中,依次加入0.3 mL水、10%乳化剂OP 0.5 mL振摇,按照“2.3.3”项下方法操作,计算A595/A450,代入回归方程计算混悬液中BSA的含量为c总。(2)脂质体中包载的BSA量测定。收集“2.4.1”项中“微柱离心分离步骤”项下获得离心液,加入乳化剂OP 0.5 mL,按照“2.3.3”项下方法操作,计算A595/A450,代入回归方程计算脂质体中包载BSA的含量c包封。参照文献[3~6]中公式计算BSA脂质体包封率分别为(31.32±0.67)%、(34.68±0.62)%、(32.75±0.83)%,平均值为32.91%(n=3)。
3 讨论
在酸性条件下,考马斯亮蓝染料呈红色,当其与蛋白质结合时变成蓝色,因此考马斯亮蓝染料和考马斯亮蓝-蛋白质结合物有不同的吸光系数。传统考马斯亮蓝法利用考马斯亮蓝-蛋白结合物最大吸收波长595 nm时的吸光度值来反映蛋白质的浓度,而忽略了游离考马斯亮蓝染料在此波长下也有一定的吸光度。因此,本试验利用双波长法来消除杂质吸收的影响从而提高分析的准确度[7,8]。
酶标仪可一次检测大量标本,所需样品量少,并能减少系统误差,因此本试验是在原有实验[7]的基础上运用酶标仪代替紫外-可见分光光度计进行的,以进一步提高检测灵敏度、降低实验误差。
本文中采用层析法将BSA脂质体与未包封的游离药物分离开,经过前期的试验研究[7],发现采用交联度较高的DEAE-Sephadex A50凝胶可以更加有效地将脂质体与BSA分离。试验中将自制的BSA脂质体装入自制凝胶微柱中,可以实现游离蛋白质与脂质体快速、有效的分离,方法简单易行,相对于普通凝胶层析柱分离法对样品的稀释倍率大大降低,适用于测定痕量大分子蛋白质脂质体的包封率,且还可以用于其他痕量蛋白质的测定。
在此次BSA脂质体包封率测定试验中,0.2 mL样品在经过了微柱的分离稀释、添加破乳剂及酶标仪测定时添加染料等诸多稀释步骤后,其中蛋白质的浓度降至0.3 μg·mL-1左右,接近此方法的检测浓度下限0.25 μg·mL-1,此乃本方法不足之处,今后试验还需探索灵敏度更高的检测方法和手段。
[1]Ye Q,Asherman J,Stevenson M,et al.Depofoam technology,a vehicle for controlled delivery of protein and peptide drugs[J].J Control Release,2000,64(1):155.
[2]侯冬枝,谢长生,黄寿吾.用注射法和复乳法制备低分子肝素脂质纳米粒[J].中国医院药学杂志,2004,24(11):672.
[3]Hou DZ,Xie CS,Huang KJ,et al.The production and characteristics of solid lipid nanoparticles(SLNs)[J].Biomaterials,2003,24(5):1781.
[4]侯冬枝,平其能,谢长生,等.雷公藤内酯醇新型固体脂质纳米粒(SLN)微观结构研究[J].药学学报,2007,42(4):23.
[5]侯冬枝,谢长生,平其能,等.雷公藤内酯醇新型SLN载体的制备[J].中国药学杂志,2007,42(12):33.
[6]侯冬枝,谢长生.米非司酮固体脂质纳米粒的性状研究[J].中国医药工业杂志,2004,42(10):545.
[7]侯冬枝,刘长科,平其能,等.牛血清白蛋白脂质体包封率的测定方法研究[J].药学学报,2007,42(6):2.
[8]陈鸿琪,李宝惠.定量测定与蛋白质的新进展[J].理化检验-化学分册,2000,36(2):91.
