马传染性贫血病毒弱毒疫苗S2基因在体内变异分析
2011-05-21王雪峰林跃智姜成刚吕晓玲赵立平周建华曲娟娟
王 帅,王雪峰,林跃智,姜成刚,吕晓玲,赵立平,周建华*,曲娟娟
(1.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江 哈尔滨 150001)
马传染性贫血病毒(Equine infectious anemia virus,EIAV)可以导致马属动物患马传染性贫血(EIA),主要表现为持续感染、反复发热和贫血等症状[1]。EIAV基因组全长约8.2 kb,除编码3个主要结构蛋白外,还编码3个非结构蛋白Tat、S2和Rev蛋白。其中,S2蛋白的作用机制尚不明确。但研究表明,S2基因在EIAV感染马体内高度保守;缺失S2基因将导致病毒毒力减弱,并使其在体内复制能力明显降低[2]。而在体外试验中,S2基因的缺失并不影响病毒在培养细胞中的复制[3]。
EIAV驴白细胞弱毒疫苗EIAVDLV121是将致病性强毒株在体外驴白细胞中传代弱化后获得的,该疫苗具有良好的安全性和诱导免疫保护效果[4]。我们的研究表明,EIAVDLV121的S2基因与其亲本强毒株存在明显差异,两者核苷酸和氨基酸序列差异率分别为4.1%和10.4%[5]。由此推测,EIAVDLV121的致弱与S2基因在体外传代过程中的变异有关,而关于EIAVDLV121S2基因在接种马体内的变异情况尚无报道。本实验以EIAVDLV121接种实验马匹,定期检测EIA体征,采取样品,测定并分析EIAVS2基因的序列,以研究EIAVDLV121S2基因在体内的变异规律。
1 材料和方法
1.1 EIAV疫苗株与实验动物 驴白细胞弱毒疫苗株EIAVDLV121由哈尔滨兽医研究所大动物研究室慢病毒课题组提供;实验马购自黑龙江省某马场,经两次免疫琼脂扩散法检测EIAV抗体为阴性。
1.2 主要试剂 QIAamp Viral RNA Mini试剂盒购自QIAGEN公司;M-MLV Reverse Transcriptase反转录试剂盒购自Invitrogen公司。
1.3 接种病毒和血样采集 将2匹实验马于颈部皮下接种EIAVDLV1212×105TCID50/匹,命名为#1、#2;另外2匹作为阴性对照注射等体积生理盐水。每天检测直肠温度和临床体征,并每隔14 d采集颈静脉肝素抗凝血,检测血小板量,3个月后每隔30 d采集,共持续5个月。采用文献[6]方法测定免疫马体内各时期的病毒载量。
1.4 病毒RNA的提取和S2基因的扩增 按照病毒RNA提取试剂盒说明书进行,并以该RNA为模板进行反转录。根据EIAVDLV121参考序列(AF327878.1)利用软件 Oligo 6.0设计 PCR引物(外套引物 P7:5'-CCACCAGTGTTGTGGAAAGGTGA-3'和 P8:5'-T GACCCCATGATTCATTCCA-3'; 内 套 引 物 P7-1:5'-TTGTAAGGTTTGGTGTATGGG-3'和 P8-1:5'-AT GGCAGCTATTATAGCAG-3'),通过套式PCR反应扩增S2基因。将胶回收的目的片段连接于pMD18-T载体中,转化至大肠杆菌DH5α感受态细胞中,随机挑取15个以上的阳性克隆进行测序。
1.5 序列分析 利用 DNAStar、Bioedit、ClustalX和MEGA4.0等生物学软件对测序结果进行整理和生物信息学分析。
2 结果
2.1 实验马的临床特征 免疫马在接种后150 d的检测期间内均未出现EIA的临床症状。其中,#1马在第24 d、25 d和88 d,#2马在第3 d、12 d、29 d、88 d、108 d和126 d时出现一过性体温升高(0.1℃~0.3℃)。但EIA的其它主要诊断指标如血小板数量和血浆病毒载量均低于发病阈值(血小板>1×105/μL、病毒载量 1×107copies/mL)(图 1),可以排除EIA临床发病。
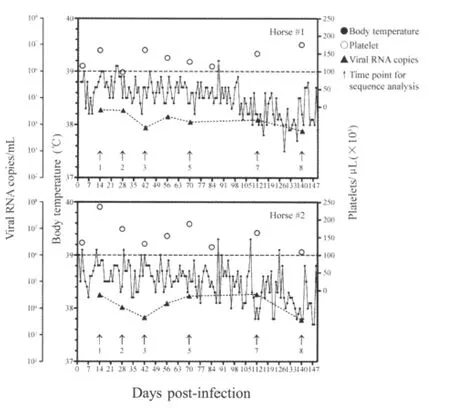
图1 EIAVDLV121免疫马体温、血小板和病毒载量动态曲线Fig.1 Dynamic curves of temperature,platelet counts and viral RNA copies of immuned horses
2.2 进化树分析 利用MEGA 4.0软件的Neighbor-Joining方法对免疫马体内各8个采样点(14 copies~23 copies/点)共202个S2基因序列以及EIAVDLV121参考序列的26个S2基因序列和亲本强毒株EIAVLN40的18个S2基因序列构建系统进化树。结果显示,进化树形成4个大的分支,其中EIAVDLV121序列位于两个分支中,EIAVLN40序列处于另一个分支中,而#1马的第1采样检测点1-1(数字组的前部分为马匹号,后部分为采样期号)的序列和2-3的序列共处于一个独立的分支中(图2)。1-5的序列与EIAVDLV121的优势序列亲缘关系最近,2-1和2-2的序列与EIAVDLV的非优势序列处于一个独立的分支中。与EIAVLN40亲缘较近的为1-3、1-7和1-8的序列。
2.3 S2推导氨基酸突变位点分析 将测序所得的247个S2核苷酸序列利用DNAStar软件转换为氨基酸序列后利用ClustalX进行比对分析。EIAVDLV121S2蛋白在免疫马匹体内的氨基酸突变位点主要集中在第17位、22位、39位、41位、51位和55位。免疫前,这些位点在EIAVDLV121中均呈现两种氨基酸共存的状态,而在免疫后各位点趋于单一。#1马在免疫期内,第17位、22位和39位氨基酸均回复突变为EIAVLN40相应位点的氨基酸,而第41位、51位和55位,在免疫后期也均回复突变为EIAVLN40的氨基酸;而#2马仅第17位在免疫后期回复突变为EIAVLN40的氨基酸,第22位由亲本E突变为K,虽然第39位和第41位在免疫前期回复突变为EIAVLN40的氨基酸,但免疫后期则分别突变为E和I,与EIAVDLV121中该位点的优势氨基酸相同(表1)。
2.4 分离株与EIAVLN40S2推导氨基酸序列的遗传距离分析 将实验马各时期S2推导氨基酸序列与EIAVLN40S2优势序列进行比较显示,#1马的1-3、1-7和1-8的S2蛋白与EIAVLN40亲缘相近,氨基酸平均差异率分别为0.9%、1.3%和0.8%,而该3个时期的S2优势序列与EIAVLN40相应序列完全相同,其他各时期S2蛋白与EIAVLN40的平均差异率均在5%以上(图3)。而#2马各时期的序列与EIAVLN40的遗传距离相对较远,差异率最小为3.0%,最大可达12.5%,但仍存在与EIAVLN40序列接近的时期(2-3和 2-5,图 3)。
3 讨论
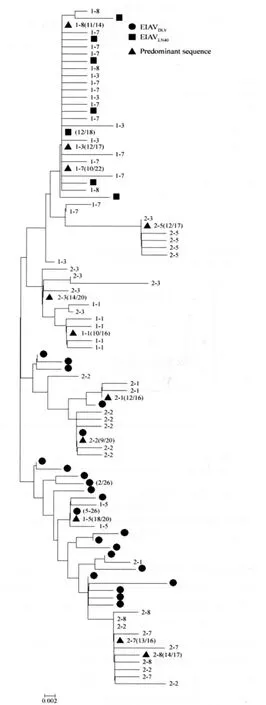
图2 S2基因进化树分析Fig.2 Phylogenetic trees of S2gene of EIAV
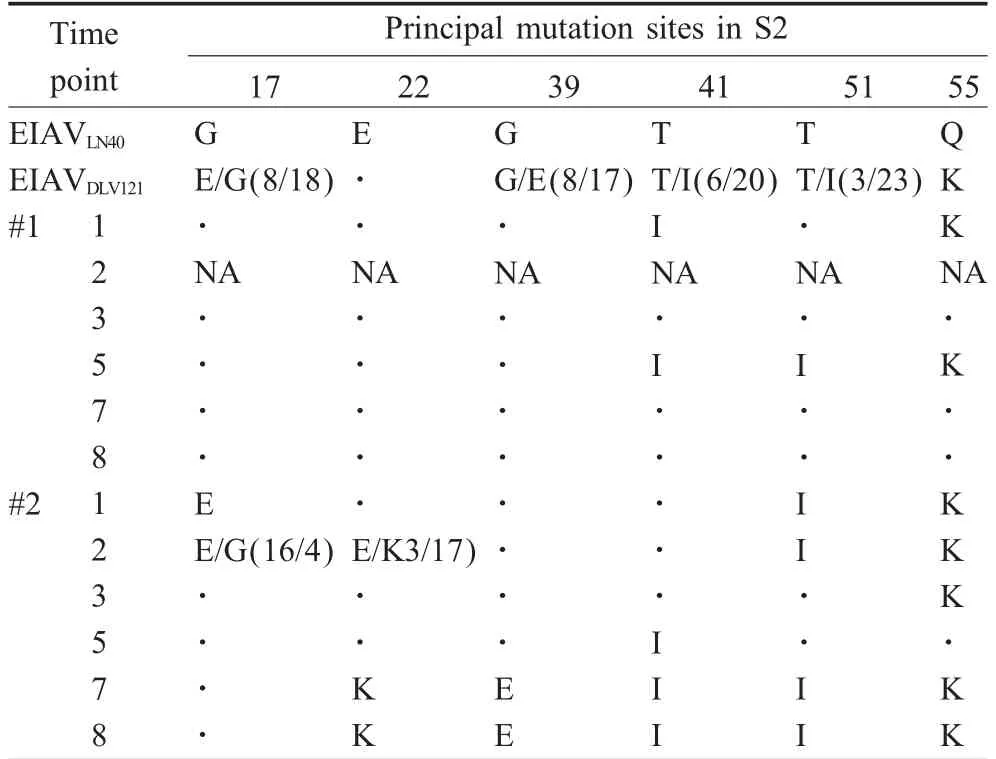
表1 S2蛋白主要氨基酸突变位点分析Table 1 The analysis of principal mutation for amino acid in S2 protein
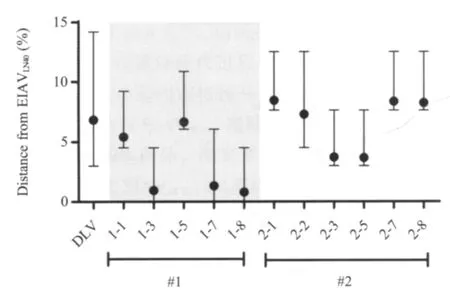
图3 马体内不同时期EIAVDLV121与EIAVLN40S2推导氨基酸遗传距离(%)Fig.3 The distance from EIAVDLV121and EIAVLN40for amino acid in S2 protein(%)
研究显示,EIAVDLV121在体外传代的过程中发生了多基因、多位点的高频率变异,使疫苗株在构成上成为具有一定差异的准种混合体,与亲本强毒株具有较大差异[5]。其中,差异最大的基因组区域包括LTR、env以及S2基因。EIAVDLV121作为弱毒疫苗免疫马后的变异特点尚不清楚。本研究分析EIAVDLV121在免疫马后S2基因的变异特点,结果显示其不断发生变异,不同时间点分离的病毒在S2推导氨基酸水平的平均差异率最大可达8.0%。进化分析显示,EIAVDLV121免疫马后不仅含有其原有S2基因型,同时也有新基因型出现。进化树表现为部分S2基因与EIAVDLV121位于进化树的同一分支,而部分S2基因克隆单独形成新分支。
本研究显示,EIAVDLV121免疫马匹后在某些时间点分离病毒的S2基因与亲本强毒株EIAVLN40在进化树中处于同一分支,甚至某些克隆的序列是一致的,但免疫马匹并未出现发病症状,外周血病毒载量维持在1×105copies/mL以下。高旭等对EIAV弱毒疫苗感染性克隆的S2基因进行回复突变,将其衍生病毒感染马匹也未引起发病[7]。表明S2基因单独的回复突变并不能引起病毒毒力的增强,也提示EIAV弱毒疫苗的毒力减弱由多基因变异导致。马建等研究显示,EIAVDLV121gp90基因在体内进化过程中会出现与EIAVLN40相似的病毒变异体,即使进行药物免疫抑制,病毒载量仍保持低拷贝的水平,也无任何EIA临床症状[8]。以上结果进一步表明EIAV弱毒疫苗具有良好的安全性。
本研究显示EIAVDLV121S2基因在马体内发生了高水平的变异,这些变异是否改变EIAV弱毒疫苗株在马体内的生物学特性仍需要深入研究;在体内某些时间点分离病毒的S2基因序列与致病性强毒相同,但并未引起马匹发病,表明EIAV弱毒疫苗具有良好的安全性。而关于EIAV弱毒疫苗其他基因在体内变异特点我们将进行深入研究。
[1]Cheevers W P.Equine infectious anemia virus:immunopathogenesis and persistence[J].Rev Infect Dis,1985,7(1):83-88.
[2]Li Feng,Leroux C,Craigo J K,et al.TheS2gene of equine infectious anemia virus is a highly conserved determinant of viral replication and virulence properties in experimentally infected ponies[J].J Virol,2000,74(1):573-579.
[3]Li Feng,Puffer B A,Montelaro R C.TheS2gene of equine infectious anemia virus is dispensable for viral replication in vitro[J].J Virol,1998,72(10):8344-8348.
[4]沈荣显,相文华.马传染性贫血病驴白细胞弱毒株的致弱及免疫机理的研究[J].中国兽医学报,2003,5:505-512.
[5]王雪峰,姜成刚,郭巍,等.马传染性贫血病毒白细胞弱毒疫苗株及其亲本毒驴强毒株前病毒基因组比较分析[J].病毒学报,2008,6:443-450.
[6]曹学智,林跃智,李利,等.马传染性贫血病毒弱毒疫苗株与亲本强毒株的体内病毒载量与诱导保护性免疫关系的研究[J].病毒学报,2010,2:128-133.
[7]高旭.S2基因变异在中国马传染性贫血病毒弱毒疫苗致弱中作用的研究[A].北京:中国农业科学院,2009.
[8]Ma Jian,Jiang Cenggang,Lin Yuezhi,et al.In vivo evolution of the gp90 gene and consistently low plasma viral load during transient immune suppression demonstrate the safety of an attenuated equine infectious anemia virus(EIAV)vaccine[J].Arch Virol,2009,154(5):867-873.
