硫酸二甲酯对白花泡桐丛枝病幼苗形态变化及DNA碱基序列的影响
2011-05-10赵改丽赵振利范国强曹喜兵
赵改丽,赵振利,范国强,曹喜兵
(河南农业大学,河南 郑州450002)
泡桐丛枝病是由现在仍不能体外培养的植原体引起的一种传染性林病,由于其特异的生物学特性,目前直接从植原体入手弄清泡桐丛枝病发生机理还存在较多困难[1~3].DNA是生物遗传信息的载体,其结构或碱基组成的任何变化都会引起生物形态或生理代谢的变化.DNA甲基化可导致DNA结构变化、基因特异表达、细胞分化和染色质失活等[4~7],DNA 甲基化水平过高或过低,都会导致植物形态发生异常[8,9].研究人员曾用不同外源物质处理泡桐丛枝病苗木使其形态发生变化,但效果较差[10~13].目前,虽然有甲基磺酸甲酯(Methylmethane sulfonate,MMS)抑制豫杂1号泡桐丛枝病幼苗发病的研究,但至今国内外未见硫酸二甲酯(Dimethyl sulphonate,DMS)对泡桐丛枝病影响的文献报道.由于作为DNA甲基剂的MMS和DMS,在相同质量浓度条件下,供给DNA的甲基数存在差异.因此必然会对泡桐丛枝病影响的程度不同.本研究通过不同质量浓度DMS处理白花泡桐丛枝病幼苗,在观察其形态变化的同时,利用巢式PCR和SSR分子标记技术,研究其对泡桐丛枝病植原体和DNA碱基序列变化的影响,以期为深入阐明泡桐丛枝病发生分子机理和建立其更有效的防治方法奠定基础.
1 材料与方法
1.1 材料及处理
材料为河南农业大学泡桐研究所继代培养30 d的白花泡桐[Paulownia fortunei(Seem.)Hemsl.]丛枝病组培幼苗.剪取上述培养的丛枝病幼苗长约4 cm的适量顶芽(外植体),分别放入盛有200 mL质量浓度为0,15,25,50,75,100,125,150 mg·L-1DMS的500 mL三角瓶内,在温度为16℃的黑暗条件下浸泡处理3 h和5 h后,分别接种到不含任何植物生长调节物质的1/2MS培养基(蔗糖和琼脂粉质量浓度分别为25,8 g·L-1)的100 mL三角瓶中.同一质量浓度和时间处理外植体20瓶,每瓶接种3个外植体.然后,在温度(25±2)℃,光强 130 μmol·m-2·s-1,光照时间 16 h·d-1的条件下培养,试验重复3次.
1.2 试验方法
1.2.1 硫酸二甲酯处理幼苗形态变化 在DMS处理后10,20,30 d时,分别观察统计幼芽生根率(生根幼芽数/60×100%),参照范国强等[10]的方法观察并记录培养30 d幼苗的形态变化情况,并取适量DMS处理幼苗顶芽和对照幼苗顶芽液氮冷冻后,贮于-80℃冰箱内备用.
1.2.2 DMS处理幼苗植原体检测 上述培养30 d幼苗DNA提取参照黎明等[14]法,植原体16S rDNA巢式PCR扩增引物对为R16mF1/R16mR1(5’-CATGCAAGTCGAACGGA-3’/5’-CTTAACCCCAATCATCGAC-3’)和 R16mF2/R16mR2(5’-ACGACTGCTAAGACTGG-3’/5’-CGGGGTTTGTACACACCGC-3’)(上海生物工程公司合成).第1次扩增以20 ng泡桐DNA为模板,以R16mF1/R16mR1为引物;第2次扩增以稀释50倍的第1次扩增产物为模板,以R16mF2/R16mR2为引物.扩增体系为25 μL(10×PCR缓冲液,500 nmol·L-1引物对,100 μmol·L-1dNTP,1.25 U Taq 聚合酶,适量 ddH2O).2 次 PCR反应程序均为94℃预处理3 min,94℃变性1 min,52℃复性1 min,72 ℃延伸2 min,5次循环;然后94℃变性30 s,52℃复性1 min,72℃延伸2 min,25次循环,最后72℃延伸10 min,4℃保存.扩增产物琼脂糖凝胶电泳及成像参照范国强等[10]的方法.
1.2.3 SSR扩增及电泳分析 利用曹喜兵等[15]优化的SSR反应体系和从相关木本植物417对SSR引物中筛选出适合泡桐扩增的45对引物(上海捷瑞公司合成)在Biometra TGradient PCR仪上进行SSR扩增.反应体系为20 μL,包括10×PCR缓冲液,300 nmol·L-1引物对,100 μmol·L-1dNTP,0.5 U Taq 聚合酶,1 ng DNA.扩增采用Touchdown程序:94℃预变性3 min;94℃变性45 s,65℃退火45 s(以后1个循环降低0.5℃),72℃延伸45 s,30个循环;94℃变性45 s,55℃退火45 s,72℃延伸45 s,30个循环;72℃延伸5 min,在扩增产物中加入5.5 μL加样缓冲液,95℃变性5 min.扩增结束后,产物用6%的非梯度聚丙烯酰胺凝胶电泳分离,银染检测.
1.2.4 数据处理 根诱导率经反正玄转换后,采用SPSS 12.0统计软件进行多重统计分析并用LSR检验.
2 结果与分析
2.1 DMS对白花泡桐丛枝病幼苗形态变化的影响
DMS处理白花泡桐丛枝病幼苗形态变化结果(图1,表1)表明,不同质量浓度的DMS对白花泡桐丛枝病幼苗形态变化的作用效果存在明显差异.在处理时间为3 h,DMS质量浓度为15~125 mg·L-1时,处理的白花泡桐丛枝病幼苗形态上皆呈现健康状态,15 mg·L-1DMS处理的幼苗生长30 d时,叶片呈现淡绿色,并且随着DMS质量浓度的增大,幼苗生长在一定程度上受到抑制(图1-B~G);当DMS质量浓度为150 mg·L-1时,接种的丛枝病幼芽生根率为0、顶芽全部死亡.而在处理时间为5 h,DMS质量浓度为 15 ~100 mg·L-1时,处理的白花泡桐丛枝病幼苗形态上皆呈现健康状态,并且随着DMS质量浓度的增大,幼苗生长在一定程度上受到抑制(图1-H~K);当DMS质量浓度等于和大于125 mg·L-1时,接种的丛枝病幼芽生根率为0、顶芽全部死亡.造成该结果的原因可能与DMS在抑制泡桐植原体生长、分裂的同时,也抑制了泡桐本身生长涉及的一系列生理生化过程有一定的关系.
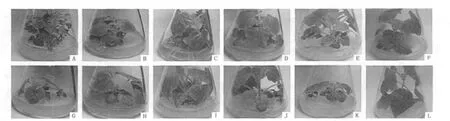
图1 不同质量浓度DMS处理后白花泡桐丛枝病幼苗的形态变化Fig.1 Morphological changes of the seedlings treated with different concentrations of DMS
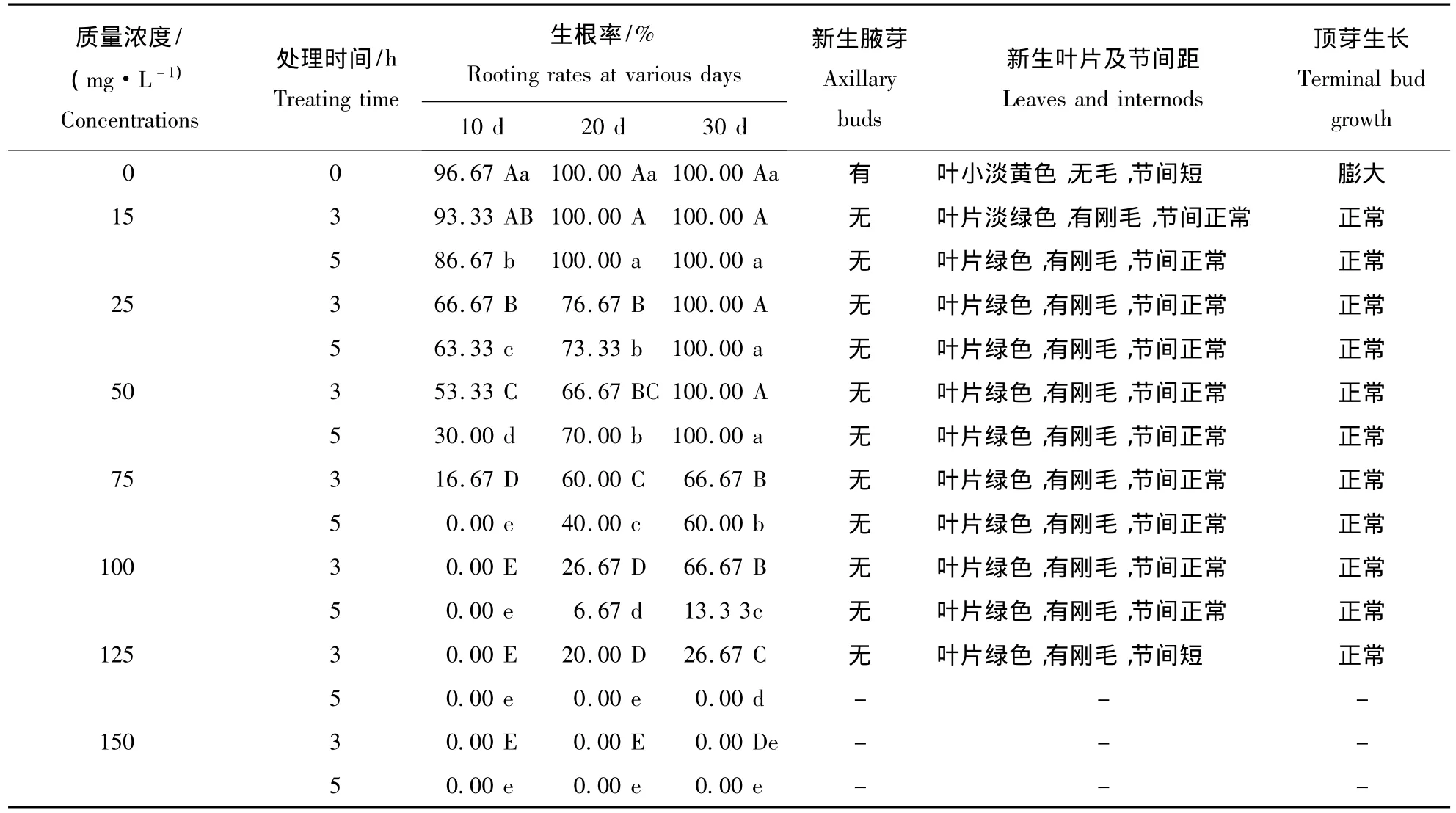
表1 DMS对白花泡桐丛枝病泡桐组培幼苗形态变化的影响Table 1 Effects of DMS on the morphological changes of the seedlings with witches’broom
2.2 DMS对白泡桐丛枝病幼苗植原体的影响

图2 DMS处理患病幼苗植原体的巢式PCR扩增Fig.2 The nested PCR of Phytoplasma in the seedlings treated with different concentrations of DMS
由DMS处理白花泡桐丛枝病桐幼苗DNA巢式PCR扩增产物电泳结果(图2)可以看出,不同质量浓度DMS对丛枝病植原体产生的抑制效果不同.当DMS质量浓度为15 mg·L-1,处理时间为3 h时,处理幼苗虽然形态上呈现健康状态(图1-B),但是其幼苗内仍有丛枝病植原体的存在,即提取该处理幼苗的DNA扩增出了泡桐丛枝病植原体16S rDNA特有的1.2 kb条带,而在25~125 mg·L-1处理的幼苗内皆未发现丛枝病植原体的存在.该结果表明,适宜质量浓度DMS在抑制植原体复制、降解的同时,可提高丛枝病植原体降低的泡桐DNA甲基化水平,使幼苗转变为健康幼苗,但过高质量浓度DMS除具消除植原体效果外,还产生了使泡桐DNA发生过甲基化,关闭与生长相关基因表达,从而抑制幼苗生长的负作用.
2.3 DMS处理幼苗的SSR分析
DMS处理白花泡桐丛枝病幼苗DNA的SSR扩增结果(图3)表明,白花泡桐健康苗,病苗和DMS处理的遗传背景相同.虽然白花泡桐健康幼苗、丛枝病幼苗以及DMS处理病苗DNA经不同SSR引物扩增后,产生片段的大小和数量存在一定的差异,但其幼苗DNA经同一引物扩增后产生了数量相同和大小一致的DNA片段.这些结果说明,植原体侵入导致白花泡桐发生丛枝病的幼苗与健康幼苗及DMS处理幼苗DNA在SSR水平上具有相同的的遗传背景.

图3 DMS处理白花泡桐病苗的SSR扩增产物的部分凝胶电泳Fig.3 Electrophoresis of part SSR products of the seedlings treated with DMS
3 讨论
丛枝病植原体侵入泡桐后必然与其DNA发生直接关系,从而导致体内发生一系列生理生化变化.在这些变化中,一部分是泡桐丛枝病症状出现后产生的变化,另一部分则是植原体与泡桐互作产生的直接变化.植物生理生化变化是植物发病后代谢出现异常的结果,而不是寄主发病的直接原因.植物任何形状的改变必然在其遗传物质上存在着应答关系.研究表明,丛枝病植原体的存在关闭了泡桐体内MW24 kD,pI6.0蛋白质对应基因的表达,消除丛枝病幼苗内植原体,该蛋白对应基因又重新启动表达[10,15,16].DNA 甲基化是真核生物基因组最常见的一种DNA共价修饰形式,在植物生长发育过程中起着重要的作用[5,8].DNA 甲基化是在不改变生物DNA碱基排列顺序的同时,阻断了遗传信息的传递,引起生物形态性状的变化.DMS是一种DNA甲基剂,在相关酶的作用下可将其活泼的甲基转移到电子密度较高的DNA分子链上,从而影响基因的表达.本试验中,用DMS处理白花泡桐丛枝病幼苗后发现,适宜质量浓度的DMS可使丛枝病幼苗转变为形态上健康幼苗,并且利用巢式PCR检测不到植原体的存在.此外,白花泡桐丛枝病幼苗、健康幼苗、DMS处理后幼苗DNA的碱基序列在SSR水平上没有发生变化.研究发现,泡桐丛枝病幼苗DNA甲基化水平低于健康幼苗,清除植原体的幼苗DNA甲基化又可升高到较高水平[14].由此可知,丛枝病植原体侵入或侵入后与泡桐相互作用产生的物质没有引起白花泡桐遗传背景的变化,丛枝病症状发生与DNA甲基化水平降低密切相关.适宜质量浓度DMS处理,一方面可使丛枝病植原体降解,另一方面可使泡桐染色体构型发生变化,阻止泡桐丛枝病发生基因的表达,重新启动抑制丛枝病发生基因的表达.
[1] KOUI T,NATSUAKI T,OKUDA S.Phylogenetic analysis of elongation factor Tu gene of phytoplasmas from Japan[J].Gen Plant Pathol,2003,69:316 -319.
[2] LIN C L,ZHOU T,LI H F,et al.Molecular characterisation of two plasmids from paulownia witches’-broom phytoplasma and detection of a plasmid encoded protein in infected plants[J].Eur J Plant Pathol,2009,123:321-330.
[3] ZHAO Y,LIU Q Z,DAVIS R E.Transgene expression in strawberries driven by a heterologous phloem-specific promoter[J].Plant Cell Reports,2004,23:224 - 230.
[4] MEYER P,NIEDENHOLF I,TEN L M.Evidence for cytosine methylation of nonsymmetrical sequence in transgenic petunia hybrid[J].EMBO Journal,1994,13:2084-2088.
[5] UILAN E C,MAGILL J M,MAGILL C W.DNA methylation and expression of NPTII in transgenic petunias and progeny[J].Theoretical and Applied Genetic,1996,92:976 -981.
[6] ROSSI V,MOTTO M,PELLEGRINI L.Analysis of the methylation pattern of the maize opque-z(oz)promoter and in vitro binding studies indicate that the oz B-Zip protein and other endosperm factors can bind to methylated target sequences[J].Journal of Biological Chemistry,1997,272:13758-13765.
[7] GONZALGO M L,JONES P A.Mutagenic and epigenetie effects of DNA methylation[J].Mutation Research,1997,386:107-118.
[8] FINNEGAN E J,KOVAC K A.Plant DNA methylationforases[J].Plant Mol Biol,2000,43:189 -201.
[9] FINNEGAN E J,PESCOCK W J,DENNIS E.DNA methylation,a key regulation of plant development and other processes[J].Curr Opion Genet Develop,2000,10:217-223.
[10]范国强,冯志敏,翟晓巧,等.植物生长调节物质对泡桐丛枝病株幼苗形态和叶片蛋白质含量变化的影响[J].河南农业大学学报,2006,40(2):137-141.
[11]范国强,张 胜,翟晓巧,等.抗生素对泡桐丛枝病植原体和发病相关蛋白质的影响[J].林业科学,2007,43(3):138-142.
[12]范国强,曾 辉,翟晓巧.泡桐丛枝病发生特异相关蛋白质亚细胞定位及质谱鉴定[J].林业科学,2008,44(4):83-86.
[13]翟晓巧,曹喜兵,范国强.甲基磺酸甲酯处理的豫杂一号泡桐丛枝病幼苗的生长及SSR分析[J].林业科学,2010,46(12):176-181.
[14]黎 明,翟晓巧,范国强,等.土霉素对豫杂一号泡桐丛枝病幼苗形态和DNA甲基化水平的影响[J].林业科学,2008,44(9):152-156.
[15]曹喜兵,何 佳,翟巧云,等.泡桐AFLP反应体系的建立及引物筛选[J].河南农业大学学报,2010,44(2):145-151.
[16]范国强,李 有,郑建伟,等.泡桐丛枝病发生相关蛋白质的电泳分析[J].林业科学,2003,39(2):119-122.
