好氧反硝化菌Pseudomonas aeruginosa NO62筛选分离与性质鉴定
2011-04-26蔡亚君杨小俊武汉纺织大学环境科学研究所湖北武汉430073
蔡亚君,桂 震,李 锋,杨小俊 (武汉纺织大学环境科学研究所,湖北武汉430073)
反硝化菌在自然界氮素循环以及水环境氮的污染治理中起着重要的作用,目前水处理生物处理工艺中的反硝化菌基本为厌氧反硝化菌,而厌氧反硝化菌因为其生长条件严格,限制了生物除氮工艺的发展[1]。因此,对供氧条件不敏感的好氧或兼性厌氧反硝化菌株的筛选及对其反硝化性质的研究,在水处理中的应用研究具有更广泛的实际应用价值。
本研究从生活污水处理场的活性污泥中筛选分离出具有好氧反硝化活性的菌株NO62,对其进行生理生化特性以及16S rDNA的分子生物学鉴定,在鉴定结果的基础上,对菌株的好氧反硝化活性进行检测的同时,也进行了反硝化功能蛋白——硝酸盐还原酶的编码基因的初步研究,取得了较好结果。对该菌株生理生化特性、反硝化特性、功能基因等的研究,可为该菌株在污水脱氮处理中的应用奠定良好的理论基础。
1 材料与方法
1.1 材料与设备
样品来源:取自武汉纺织大学生活污水处理场活性污泥。
硝酸盐培养基:牛肉膏3 g,蛋白胨10 g,硝酸钠1 g,蒸馏水1 000 mL,pH 7.0~7.2。固体培养基按2%比例添加琼脂。
主要仪器与设备:摇床、恒温培养箱、Vitek-32全自动细菌鉴定系统、iCvcler Thermal Cycler梯度PCR仪、JY3000+凝胶电泳仪、Syngone Cs-Bos H R凝胶成像系统等。
1.2 好氧反硝化菌的鉴定
将目的菌株平板划线活化24 h后,观察单菌落形态,镜检后进行革兰氏染色、接触酶试验。挑取单菌落用全自动细菌鉴定系统Vitek-32进行生化鉴定。同时,采用16S rDNA PCR方法进行分子生物学鉴定,测序由上海生工生物工程技术有限公司完成。
1.3 好氧反硝化活性测定
将筛选到的活性较高的反硝化菌转接到液体培养基中活化12 h,再以1∶100比例转接到50 mL硝酸盐培养基中25℃、200 r/min培养,定时取样测定菌体生长状态 (分光光度法测600 nm波长下光密度D600)及培养基中亚硝态氮含量以检测其反硝化活性。-N含量检测采用N-(1-萘基)-乙二胺光度法[2]。
1.4 反硝化菌NO62总DNA的提取
NO62接种到有5 mL液体培养基的试管中,振荡培养 (37℃,150 r/min)过夜。取1 mL菌液于1.5 mL离心管中,1 000 r/min离心1 min收集菌体,弃去上清液。加入0.5~0.7 mL含10 mg/mL溶菌酶的TES(30 mmol/L Tris,5 mmol/L EDTA,20%蔗糖,pH 8.0),振荡混匀后于37℃下水浴30~50 min。加入0.1 mL蛋白酶PK,0.1 mL10%SDS,温和混匀后于 37℃下水浴30~50 min。12 000 r/min离心15 min,取上清。体积酚∶氯仿∶异戊醇 (25∶24∶1)抽提2次,取上清,加入2.5倍体积的冰冻无水乙醇或等体积冰冻异丙醇于—20℃下放置30 min以上,于12 000 r/min下离心30 min,弃去上清液,用70%乙醇洗涤,干燥,加20 μ L T E,待DNA充分溶解后保存于—20℃。
琼脂糖凝胶电泳检测总DNA,凝胶成像系统分析DNA大小及量。
1.5 硝酸盐还原酶编码基因检测
根据GenBank中假单胞菌将硝酸盐还原成亚硝酸盐的硝酸盐还原酶编码基因narG序列的保守区设计了引物narGF:5'-TATGTCGGCCAGGAGAA-3'和narGR:5'-TTCTCGTACCAGGTAGC-3'。引物由北京奥科生物技术有限责任公司合成。反应体系:10×TaqDNA聚合酶缓冲液2.5 μ L,引物narGF/narGR各100 pmol,dNTPs 40 μ mol,0.1 μ L总DNA,TaqDNA聚合酶 1 U,加入无菌的去离子水至总体积为25 μ L。PCR反应程序:94℃预变性5 min,94℃1 min、50℃1 min、72℃1 min循环35次,最后72℃延伸7 min。反应结束后取PCR产物在1%琼脂糖凝胶上进行凝胶电泳分析。
2 结果与分析
2.1 反硝化菌NO62鉴定结果
对反硝化菌NO62的形态特征进行了鉴定,菌落为蓝绿色、半透明,圆形、凸起、边缘规则,镜检 (1 500×)为革兰氏染色阴性细长杆状菌 (图1)。
对NO62初步鉴定后,利用Vitek-32细菌鉴定系统对其生理生化特征进行进一步鉴定 (表1),鉴定NO62为铜绿假单胞菌 (Pseudomonasaeruginosa)。
图1 菌株NO62菌体形态图
用琼脂糖凝胶电泳检测16S rDNA基因PCR产物为大小约1 500 bp的片段。用PCR产物纯化试剂盒对PCR产物纯化后测序,对测序得到菌株NO62的全长1 436 bp 16S rDNA序列进行Blast分析,结果表明,NO62菌株的16S rDNA与铜绿假单胞菌 (Pseudomonas aeruginosa)菌株LESB58、PA7、UCBPP-PA14PAO1的16S rDNA相似性均达100%;与施氏假单胞菌 (Pseudomonas stutzeri)A1501相似性达97%;与门多萨假单胞菌(Pseudomonasmendocina)ymp相似性达96%;与恶臭假单胞菌 (Pseudomonas putida)KT2440相似性达95%;与假单胞菌虫 (Pseudomonasentomophila)L48相似性达95%;与荧光假单胞菌 (Pseudomonas f luorescens)Pf0-1相似性达95%;与棕色固氮菌 (Azotobacter vinelandii)DJ相似性达96%。

表1 菌株NO62生理生化特征鉴定结果
2.2 好氧反硝化活性分析结果
将活化培养12 h后菌液按1∶100比例转接到新鲜液体培养基中,分别在不同温度下 (25、30、37、40、42℃)好氧培养 (150 r/min),从初始转接开始取样,检测其菌体量 (D600表示,图2)及亚硝态氮浓度 (图3)。
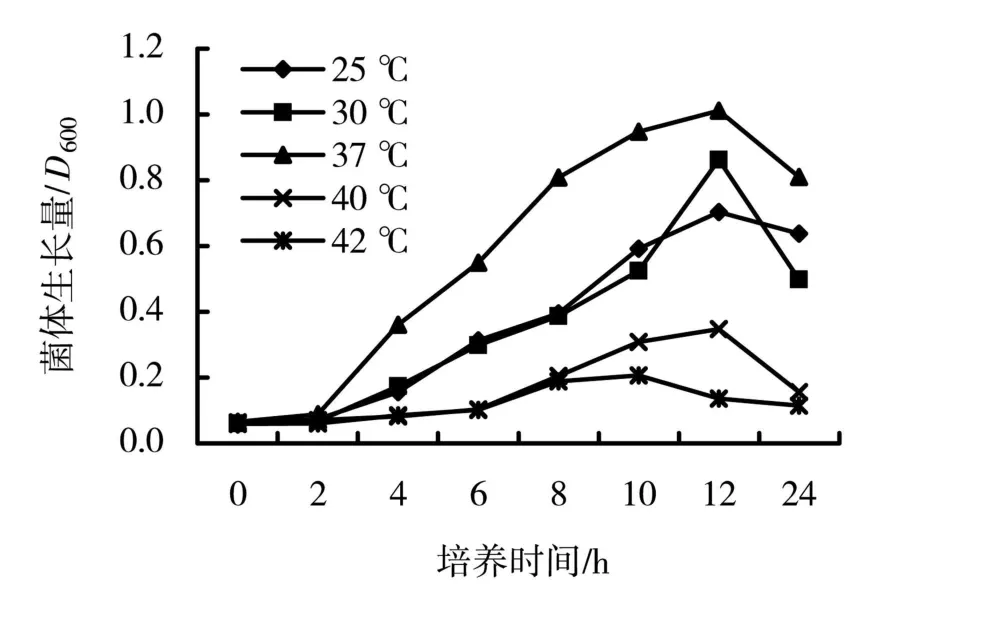
图2 菌株NO62好氧培养时生长曲线
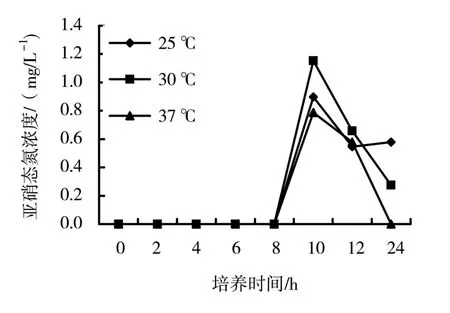
图3 菌株NO62好氧培养时反硝化活性
由图2可知,NO62在37℃培养时生长状况最好,培养至12 h时菌体量最大,D600达到1.012。在25℃和30℃培养时,生长状况相对较差,培养至12 h时菌体量最大,最高D600值分别为0.703和0.863。而在40℃及42℃培养时基本不生长,最高D600仅为0.347(12 h)和0.207(10 h)。
由图3可知,NO62培养8 h后开始表现反硝化活性,随着培养时间的增加、菌体量的增大,硝态氮不断转化为亚硝态氮,培养至10 h时,培养物中亚硝态氮的积累量达到最高,在30℃培养时,反硝化活性最好,最高亚硝态氮浓度为1.154 mg/L(10 h),在25℃和37℃培养时,反硝化活性相对较低,最高亚硝态氮浓度分别为0.898 mg/L(10 h)和0.787 mg/L(10 h)。此后随着培养的继续,亚硝态氮浓度逐步降低。
综合菌体生长及反硝化活性两个方面的结果,在30℃培养时,NO62的生长状况和反硝化活性都相对较高,因此,后续实验选取30℃作为NO62的培养温度对其进行研究。
2.3 硝酸盐还原酶编码基因检测结果
对菌株NO62硝酸盐还原酶编码基因narG的PCR检测结果 (图4)显示为阳性,其扩增出的特异片断大小约为694 bp。
3 讨 论
从活性污泥中分离得到1株具有较高好氧反硝化活性的菌株NO62,结合细菌鉴定以及16S rDNA鉴定系统鉴定,确定该菌为铜绿假单胞菌(Pseudomonas aeruginosa),将其命名为 P.aeruginosa NO62。NO62在37℃培养时的生长状况最好,能够最快进入对数生长期,且生长最旺盛,25℃和30℃培养时的生长状况稍差,但与37℃培养时相差不大,而培养温度高于40℃后基本不生长。30℃培养时,NO62的反硝化活性最高,亚硝态氮的积累量最大,而25℃和37℃培养时,NO62的反硝化活性稍低。菌株NO62的反硝化活性与生长曲线一致,在菌株对数生长期表现反硝化活性,且在菌量最大时亚硝酸盐积累同时达到最高。随着培养时间的增加,亚硝态氮的浓度逐渐降低,推测亚硝态氮可能被进一步还原成了NO、N2O或N2,需要进一步的实验证明其最终的还原产物。

图4 菌株NO62 narG基因PCR检测结果
本研究仅对菌株NO62的好氧反硝化活性及相关功能酶进行了初步鉴定,而本研究所使用的培养条件还有待优化,对该菌株的好氧反硝化的机理及其功能酶也有待进一步研究。此外,现在逐渐发展起来的一种新型高效生物除氮工艺——短程硝化反硝化工艺,将氮的去除通过简单的途径即能实现,比传统硝化反硝化生物脱氮节省了25%的耗氧量、40%的碳源,且大大缩短了反应历程,提高了脱氮效率[3~5]。短程消化反硝化工艺在微生物水平上主要由氨氧化菌将氨盐氧化成亚硝酸盐后由反硝化菌将亚硝酸盐直接还原成N2。而NO62菌株已证明能将亚硝酸盐反硝化,因此,它在短程硝化反硝化工艺中也具有良好的应用前景。
[1]郑 平,徐向阳,胡宝兰,等.新型生物脱氮理论与技术[M].北京:科学出版社,2004.55~74.
[2]中国标准出版社第二编辑室.水质分析方法国家标注汇编[M].北京:国家标准出版社,1996.149~152.
[3]肖文胜,郭建林.短程硝化反硝化生物脱氮工艺及影响因子[J].黄石理工学院学报,2005,(2):21~23.
[4]袁林江,彭党聪,王志盈.短程硝化-反硝化生物脱氮[J].中国给水排水,2000,16(2):29.
[5]李松良,林华东,王 鹏.生物脱氮的短程硝化反硝化及影响因素[J].能源环境保护,2007,21(4):16~19.
