喀什小檗花色素微胶囊化工艺及产品特性
2011-03-28黄敬德
黄敬德,杨 玲*
(新疆生产建设兵团 塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
喀什小檗花色素微胶囊化工艺及产品特性
黄敬德,杨 玲*
(新疆生产建设兵团 塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
建立喷雾干燥法制备喀什小檗花色素的微胶囊工艺。采用单因素试验和正交试验筛选合适的壁材及配方,通过喷雾干燥法制备喀什小檗花色素的微胶囊产品。结果表明:花色素∶壁材1∶5、麦芽糊精∶β-环糊精 1∶6、固形物含量30%、乳化剂阿拉伯树胶1.0%、喷雾干燥进口温度160℃、出口温度80℃时,喀什小檗花色素的包埋率最高。稳定性实验表明微胶囊化的喀什小檗花色素对光、温度、碳水化合物、氧化剂、还原剂、金属离子等的稳定性都有一定程度的提高。
喀什小檗;花色素;微胶囊;稳定性
喀什小檗(Berberis kaschgarica Rupr)隶属小檗科落叶灌木,其果实含有丰富的水溶性天然色素——花色素[1-3]。研究表明花色素不仅是一种很好的天然着色剂,还具有很好的抗氧化性、促进视力、抗衰老、预防心脑血管疾病等药理作用[4-5],在食品、保健品、化妆和医药等方面有很大的应用潜力,但是,花色素多羟基的特性使其对光照、温度、p H值、氧化剂等比较敏感,从而限制了它的利用。
微胶囊技术是将固体、液体等物质用天然或合成高分子物质将其包埋在一个致密的囊壳内,使被包埋的物质与外界环境隔离,以保持其原有的性能和生物活性,控制释放速度,延长存贮时间。
β-环糊精是一种中空环状低聚糖化合物,具有环内疏水、环外亲水的特性,与化合物包合后,可改善多种物理化学性质,如溶解度、稳定性等[6-7]。阿拉伯树胶是一种水溶性多糖,黏度低,抗氧化性、成膜性和乳化稳定性良好。麦芽糊精是淀粉不完全水解的产物,黏度低,水溶性好,还具有营养价值,因此是微胶囊工艺中应用广泛的配伍壁材[8]。
本实验以麦芽糊精、β-环糊精为壁材,阿拉伯树胶为乳化剂,花色素为芯材,采用喷雾干燥技术,对花色素进行微胶囊化工艺和微胶囊产品稳定性研究,希望能为喀什小檗的深度开发应用提供参考。
1 材料与方法
1.1 材料与试剂
喀什小檗(Berberis kaschgarica Rupr)果实,2009年8月采集于新疆天山林场,冷冻保存备用。
麦芽糊精(DE值20) 孟州市麦特灵有限责任公司;β-环糊精(生化试剂)、阿拉伯树胶(生化试剂) 上海山浦化工有限公司。
1.2 仪器与设备
DC-1500实验型喷雾干燥机 上海达程实验有限公司;BME- 100 L高剪切混合乳化机 上海威广机械制造有限公司;Cary-100型紫外-可见分光光度计 美国Varian公司;DK- 80数显恒温水浴锅 金坛市医疗仪器厂;SK 3200H超声波清洗机 上海科导超声仪器公司;imaging A1高级多功能显微镜 德国蔡司公司。
1.3 方法
1.3.1 微胶囊花色素工艺[9-12]
称取100g喀什小檗果实,研碎,用80%(含0.1%盐酸)无水乙醇溶液,超声提取3次,每次超声15min,每次用170mL提取液,合并提取液,40℃旋蒸浓缩,浓缩液真空干燥,得花色素,冷藏备用。
称取定量阿拉伯树胶溶解在蒸馏水中,使其在50℃水浴中恒温30min,全部溶解,冷却至室温,加入到定量麦芽糊精和β-环糊精的溶液中,缓慢加入定量花色素产品,搅拌均匀,乳化均质,进行喷雾干燥,得到微胶囊花色素。
1.3.2 微胶囊花色素配方优化试验
在2000r/min乳化5min,喷雾干燥温度,进料速度为400r/h,恒定不变的条件下,以芯材与壁材比例、壁材组分比例(麦芽糊精∶β-环糊精)、固形物含量、乳化剂(阿拉伯树胶)含量为单因素进行试验。
在单因素试验基础上,采用正交试验优化微胶囊配方,4因素分别为芯材与壁材比例、壁材组分比例(麦芽糊精∶β-环糊精)、固形物含量、乳化剂含量,在2000r/min乳化5min、进口温度160℃、出口温度80℃条件,以包埋率为指标进行考察。
1.3.3 指标测定
1.3.3.1 花色素微胶囊化前后紫外-可见光谱性质检测
取微胶囊溶解于pH1的蒸馏水中,完全溶解,用紫外-可见光光度计在200~800nm光谱范围内扫描。花色素的扫描方法与此相同。
1.3.3.2 包埋率的测定[13]

微胶囊产品中总花色素的含量:准确称取0.15g微胶囊溶解于pH1的蒸馏水中,完全溶解,定容至50mL容量瓶中,在517nm处测定吸光度,吸光度与花色素含量呈线性关系,据此来表征花色素含量。
1.3.3.3 微胶囊花色素理化性质测定
用冷水和温水测定溶解性[14]、质量恒定法测水分含量、用量筒测密度、用蔡司高级多功能显微镜观察和检测微胶囊花色素的超微结构[15]。
1.3.4 微胶囊花色素稳定性研究[9,16-19]
分别取一定量的花色素和微胶囊化花色素置于不同的光照、温度条件下,以及在含有K+、Na+、Cu2+、Fe3+、Al3+溶液中,在一定浓度的葡萄糖、蔗糖、亚硫酸氢钠、过氧化氢溶液中,定时测定在517nm波长处的吸光度。
1.3.5 微胶囊花色素在人工肠/胃液中缓释效果研究[20]
人工肠液的配制:3.4g K H2PO4溶于125mL水中,加入95mL 0.2mol/L NaOH溶液和200mL水,调节pH7.2,并加水稀释到500mL;人工胃液的配制:4.5mL盐酸加入到500mL水中,调节pH1.2。
称取0.2g微胶囊花色素放入装有50mL人工肠/胃液的150mL锥形瓶中,放入(37±0.5)℃的恒温水浴中,每隔15min振荡1次,定时测定在波长517nm处的吸光度。
2 结果与分析
2.1 微胶囊花色素工艺研究
2.1.1 微胶囊花色素配方单因素试验
2.1.1.1 芯材与壁材比例对微胶囊花色素形成效果的影响
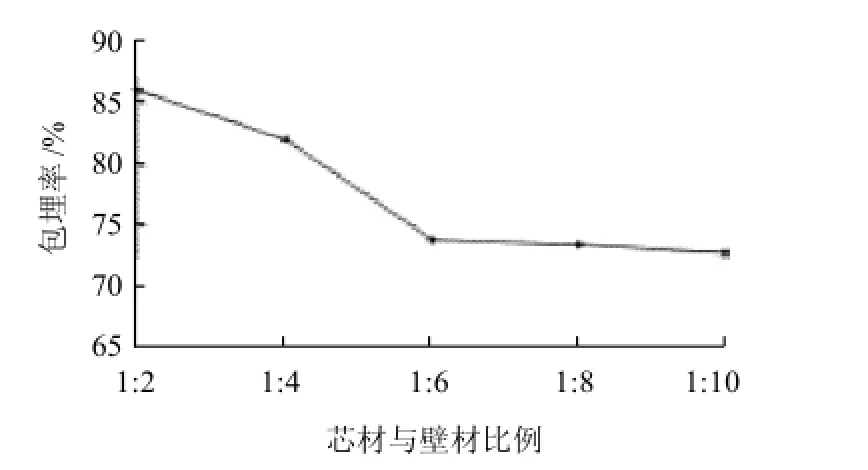
图1 不同芯材与壁材比例对微胶囊花色素形成效果的影响Fig.1 Effect of core-to-wall material ratio on microencapsulation efficiency
从图1可以看出,芯材与壁材比较大时,包埋率也较高,但是随着芯材与壁材比例的减小,其包埋率也逐渐减小,当芯材与壁材比例达到1∶6后,包埋率变化缓慢,趋于不变。这是由于芯材量大时,壁材量对其包埋的多,包埋率亦大,但是芯材过大时,壁材的包埋能力有限,不能对芯材进行充分包埋,微胶囊大量粘壁,故选择1∶5作为最佳芯材与壁材比例。
2.1.1.2 不同麦芽糊精与β-环糊精比例对微胶囊花色素形成效果的影响
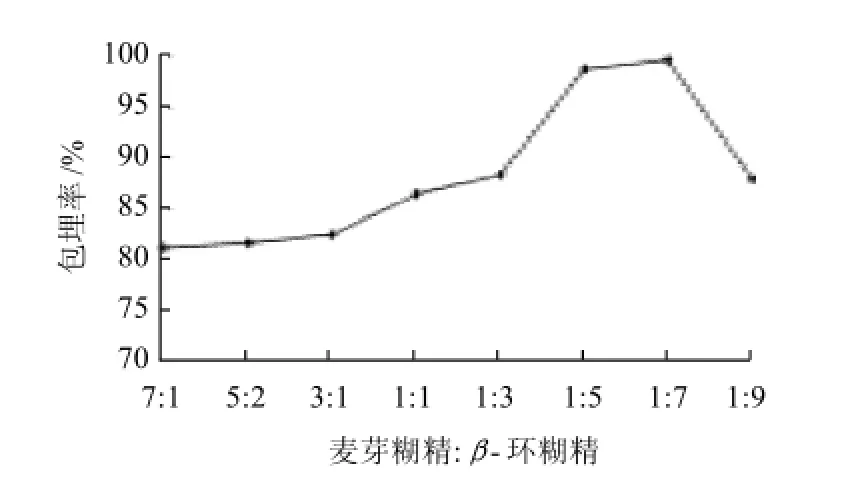
图2 麦芽糊精与β-环糊精的不同比例对微胶囊花色素包埋率的影响Fig.2 Effect of maltodextrin-to-β-cyclodextrin ratio on microencapsulation efficiency
从图2可知,随着麦芽糊精与β-环糊精比例的减小,包埋率逐渐增加,这可能是因为β-环糊精的特殊空腔结构,使花色素很好的包埋进去。但是,当比例小于1∶7后,可能是由于β-环糊精的包埋能力有限,包埋率反而降低。故选择1∶7作为最佳麦芽糊精与β-环糊精比例。
2.1.1.3 不同固形物含量对微胶囊花色素形成效果的影响
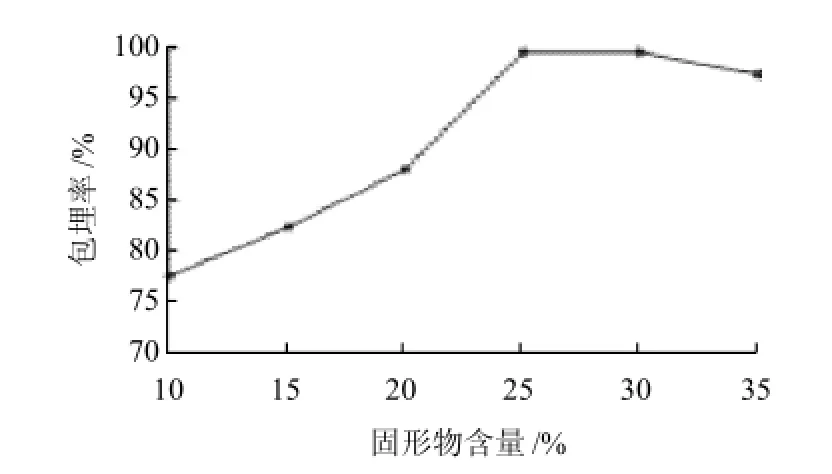
图3 不同固形物含量对微胶囊花色素包埋率的影响Fig.3 Effect of total solid content on microencapsulation efficiency
从图3可知,包埋率随固形物含量的增加先上升再下降,当固形物含量达到25%时包埋率最大,可能是因为适当地提高固形物含量有利于在喷雾干燥中囊壁的形成,由于体系黏度的增加,减低了芯材向壁材表面迁移的几率,因而更快更好地包埋,但固形物含量过高时,喷雾干燥的雾化效果不好,易堵塞和粘壁,因此,控制固形物含量25%最佳。
2.1.1.4 不同乳化剂阿拉伯树胶含量对微胶囊花色素形成效果的影响
从图4可知,随着乳化剂含量的增加,包埋率也逐渐增加,达到1.0%时,逐渐下降。可能原因是随着乳化剂阿拉伯树胶的加入,由于阿拉伯树胶的乳化性和成膜性较好,包埋率也随之上升,但是阿拉伯树胶含量太大时,料液体系的黏性增加,易堵塞喷雾干燥机的喷头和易粘壁,包埋率随之减低。故选择1.0%作为最佳的乳化剂含量。
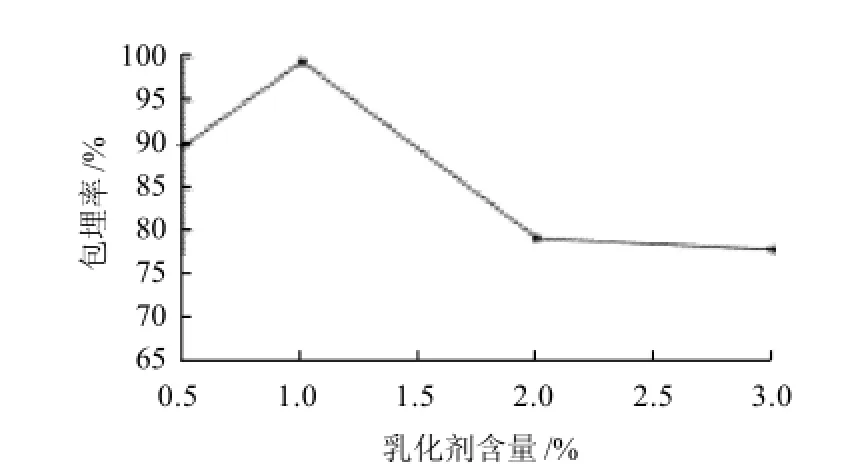
图4 不同乳化剂阿拉伯树胶含量对微胶囊花色素包埋率的影响Fig.4 Effect of gum acacia content on microencapsulation efficiency
2.1.2 微胶囊花色素喷雾干燥单因素试验
2.1.2.1 进口温度对微胶囊花色素形成效果的影响
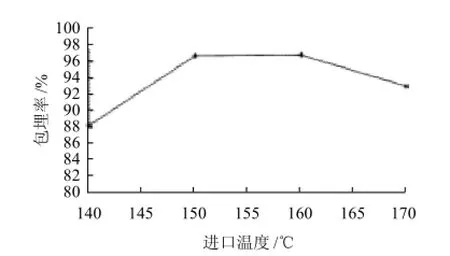
图5 进口温度对微胶囊花色素包埋率的影响Fig.5 Effect of inlet air temperature on microencapsulation efficiency
从图5可看出,进口温度在140~160℃时,微胶囊的包埋率随温度升高而提高,这是因为适当地提升进风温度,壁材的成膜速度加快,利于保护芯材,易于形成微胶囊,但温度高于160℃时,微胶囊的包埋率开始下降,且易粘壁,因为过高的温度使水分蒸发过快而发生破壁,从而影响包埋率,所以最佳进口温度为150~160℃。
2.1.2.2 出口温度对微胶囊花色素形成效果的影响
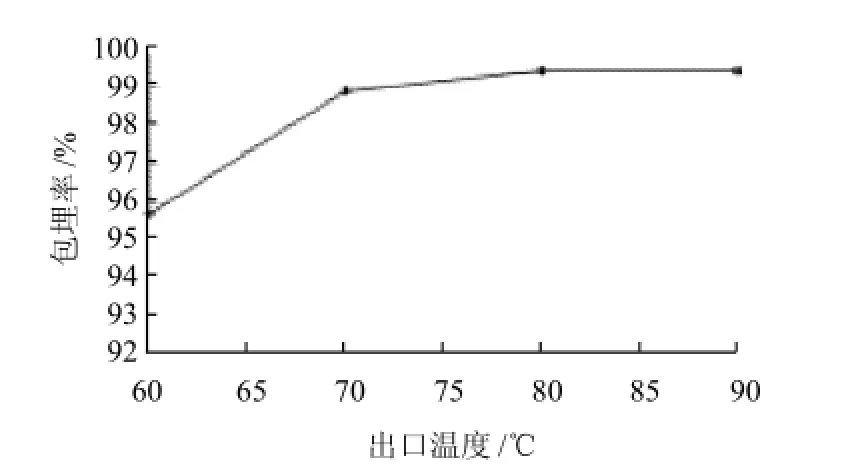
图6 出口温度对微胶囊花色素包埋率的影响Fig.6 Effect of outlet air temperature on microencapsulation efficiency
从图6可看出,出口温度在80℃时,包埋率最高。适当升高出口温度,可以减少干燥时间,快速形成微胶囊的致密结构,温度低于70℃时,微胶囊水分含量高且粘壁,温度高于80℃时,过高的温度会使微胶囊破壁而粘壁。因此,出口温度最佳为8 0℃。
2.1.3 微胶囊花色素配方优化正交试验
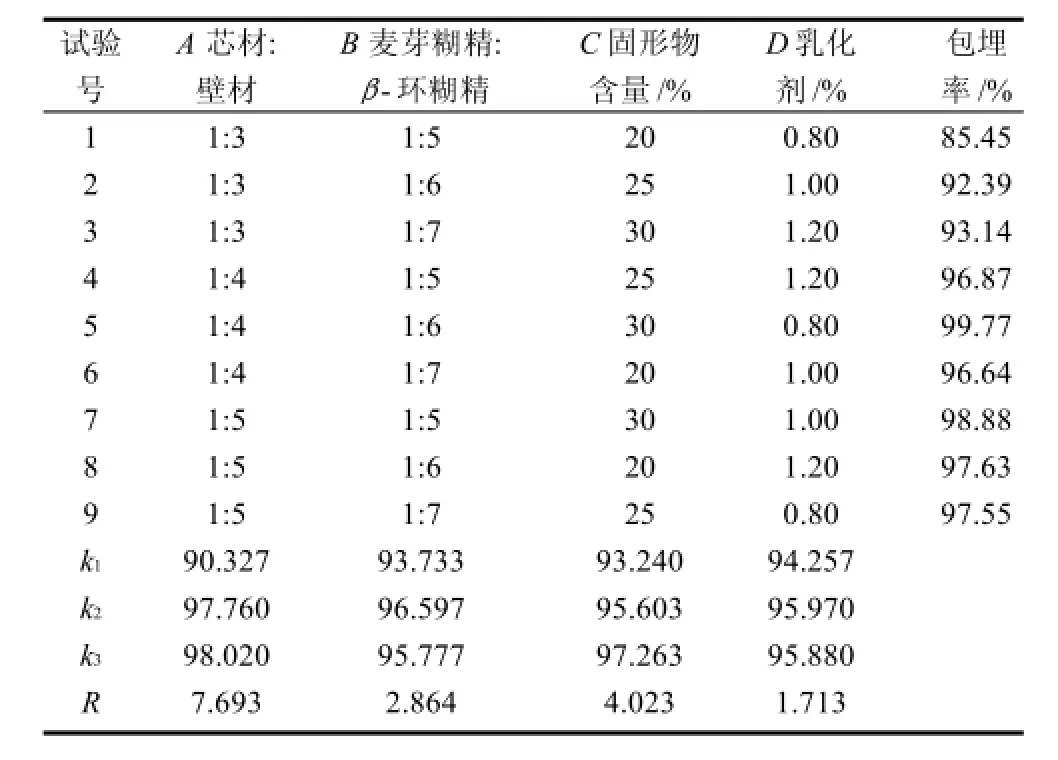
表1 微胶囊花色素配方正交试验设计及结果Table 1 Orthogonal array design and corresponding experimental results
由表1可得出,影响微胶囊产品的主次因素依次为:芯材与壁材比例>固形物含量>芯材与壁材比>乳化剂含量。试验得出的最佳组成因素水平为A3B2C3D2,芯材与壁材比例1∶5、麦芽糊精∶β-环糊精1∶6、固形物含量30%、乳化剂含量1.0%。
2.2 微胶囊花色素产品质量评定
2.2.1 花色素微胶囊化前后紫外可见光谱性质检测
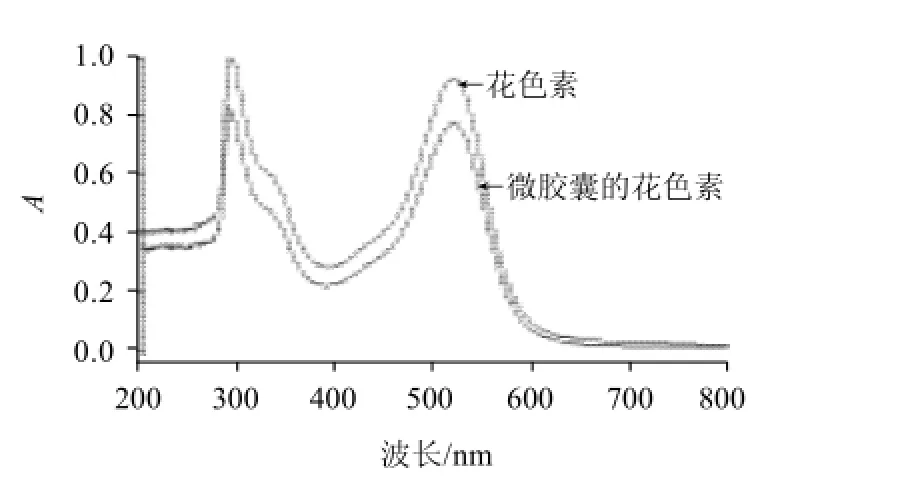
图7 微胶囊化前后紫外-可见光谱Fig.7 UV-Vis scanning spectra of anthocyanins from the fruits of Berberis kaschgarica Rupr before and after microencapsulation
从图7可看出,微胶囊化前后紫外-可见光谱图很类似,均在517nm和280nm附近有最大吸收波长峰。所以,微胶囊化前后花色素结构没有发生变化。
2.2.2 微胶囊花色素溶解性的测定
温水极易溶解,在40min几乎全部自然溶解,溶液澄清,呈紫红色,颜色随着浓度增加而逐渐加深。冷水易溶解,自然溶解约一半,搅拌后马上全部溶解,溶液澄清,呈紫红色,颜色随着浓度增加而逐渐加深。所以微胶囊化后的花色素易溶解于水。
2.2.3 微胶囊花色素水分含量的测定
平行测定3份,微胶囊的质量均为0.09g,微胶囊的干物质质量分别为0.0739、0.0730、0.0764g,得到平均含水量为17%。
2.2.4 微胶囊花色素密度的测定
平行测定3份,微胶囊的密度分别为0.36、0.38、0.39g/cm3,得平均密度为0.38g/cm3。
2.2.5 微胶囊花色素超微结构的观察
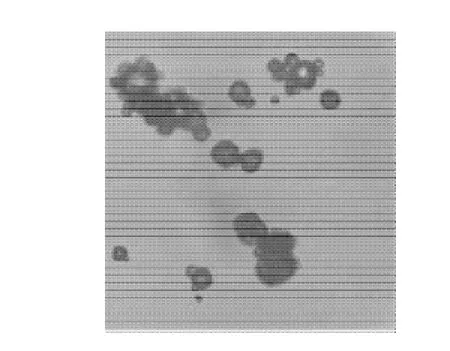
图8 微胶囊显微照片(×100)Fig.8 Microphoto of microencapsulated anthocyanins (×100)
经观察和检测:微胶囊产品外观为红色粉末,无特殊气味,其形状为圆球形(图8),其粒径为1.97~45.57μm,平均粒径为9.9μm。
2.3 微胶囊花色素稳定性研究
2.3.1 光照对微胶囊花色素稳定性的影响
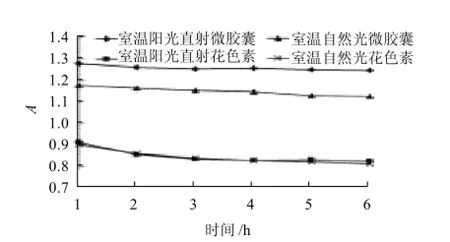
图9 花色素和微胶囊花色素在不同光照条件下的稳定性Fig.9 Stability of free and microencapsulated anthocyanins towards different illumination conditions
从图9可看出,在室温阳光直射和室温自然光下,微胶囊花色素的吸光度变化不大,但是花色素的吸光度变化较大,表明微胶囊花色素有一定程度的耐光性。
2.3.2 温度对微胶囊花色素稳定性的影响
从图10可看出,温度对微胶囊化的微胶囊和花色素的稳定性有一定影响,当温度高于70℃时,花色素稳定性急剧下降,而微胶囊花色素的稳定性却变化不大,表明微胶囊化后耐热性有明显的提高。
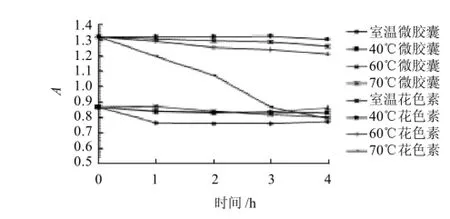
图10 花色素和微胶囊花色素在不同温度下的吸光度Fig.10 Stability of free and microencapsulated anthocyanins towards different temperatures
2.3.3 金属离子对微胶囊花色素稳定性的影响
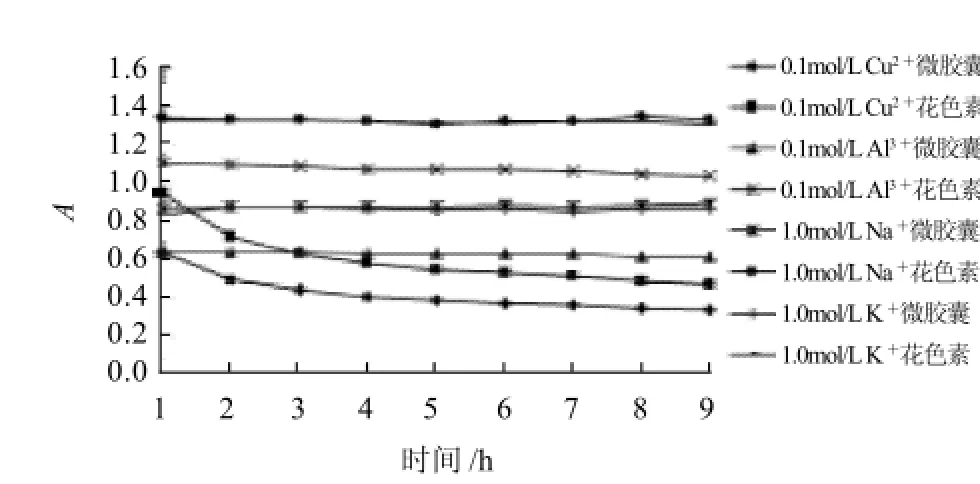
图11 花色素和微胶囊花色素在金属离子中的稳定性Fig.11 Stability of free and microencapsulated anthocyanins towards different metal ions
从图11可以看出,花色素和微胶囊花色素在加入金属离子后吸光度普遍降低,但两者在Na+、K+、Al3+溶液中稳定均较好,微胶囊花色素在Cu2+溶液中的稳定性比花色素好。综上说明:微胶囊花色素在金属离子中的稳定性比花色素有所提高。
2.3.4 碳水化合物对微胶囊花色素稳定性的影响
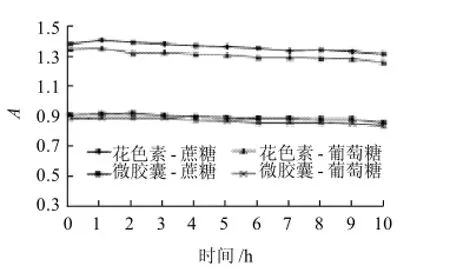
图12 花色素和微胶囊花色素在碳水化合物中的稳定性Fig.12 Stability of free and microencapsulated anthocyanins towards different carbohydrates
从图12可以看出,花色素和微胶囊花色素在加入碳水化合物后吸光度无明显变化,说明花色素和微胶囊花色素在碳水化合物中的稳定性均很好。
2.3.5 还原剂氧化剂对花色素和微胶囊花色素稳定性的影响
2.3.5.1 NaHSO3对花色素和微胶囊花色素稳定性的影响

图13 花色素和微胶囊花色素在不同质量浓度NaHSO3中的稳定性Fig.13 Stability of free and microencapsulated anthocyanins towards NaHSO3
从图13可看出,当NaHSO3质量浓度小于0.1g/mL时,对微胶囊花色素和花色素稳定性影响不明显,但随着NaHSO3质量浓度的增加,花色素的吸光度降低很快,微胶囊花色素吸光度降低得较慢,且花色素和微胶囊花色素褪色均愈加明显,该结果表明微胶囊花色素具有一定抗还原能力和保护作用。
2.3.5.2 H2O2对花色素和微胶囊花色素稳定性的影响
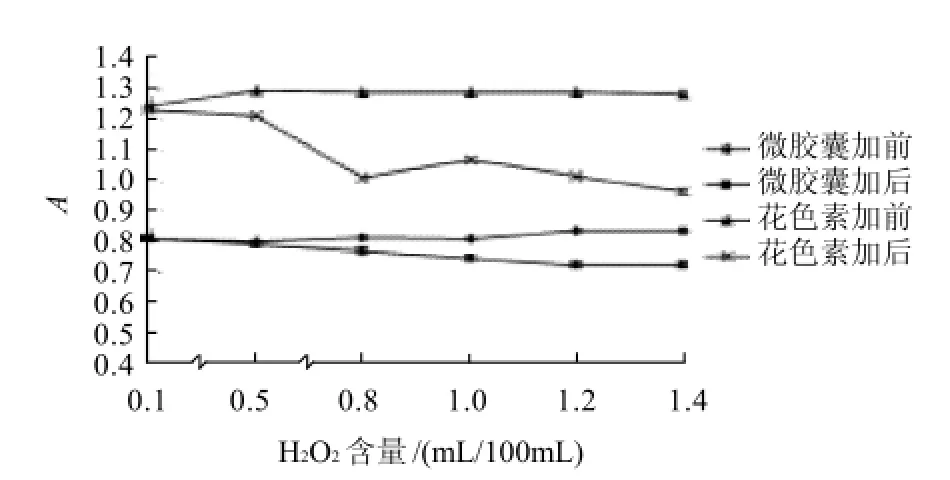
图14 花色素和微胶囊花色素在不同含量H2O2中的稳定性Fig.14 Stability of free and microencapsulated anthocyanins towards H2O2
从图14可看出,当H2O2含量<0.5mL/100mL时,对微胶囊花色素和花色素稳定性无明显影响,随着H2O2含量的增加,花色素的吸光度降低很快,而微胶囊花色素吸光度降低的很慢,且花色素和微胶囊花色素褪色均愈加明显。说明微胶囊花色素具有一定的抗氧化能力和保护作用。
2.4 微胶囊花色素缓释效果研究
2.4.1 微胶囊花色素在人工胃液中的缓释效果研究
从图1 5可看出,微胶囊花色素在人工胃液中,50min前释放得较快,50min时基本全部释放出来,说明微胶囊花色素适宜在人工胃液的酸性环境中存在,且其有一定的缓释作用。
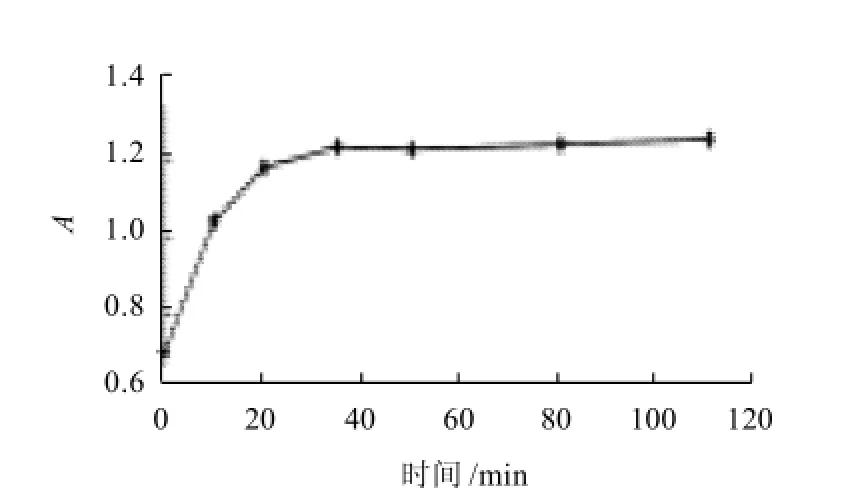
图15 微胶囊花色素在人工胃液中的释放Fig.15 Release of microencapsulated anthocyanins in artificial gastric juice
2.4.2 微胶囊花色素在人工肠液中的缓释效果研究
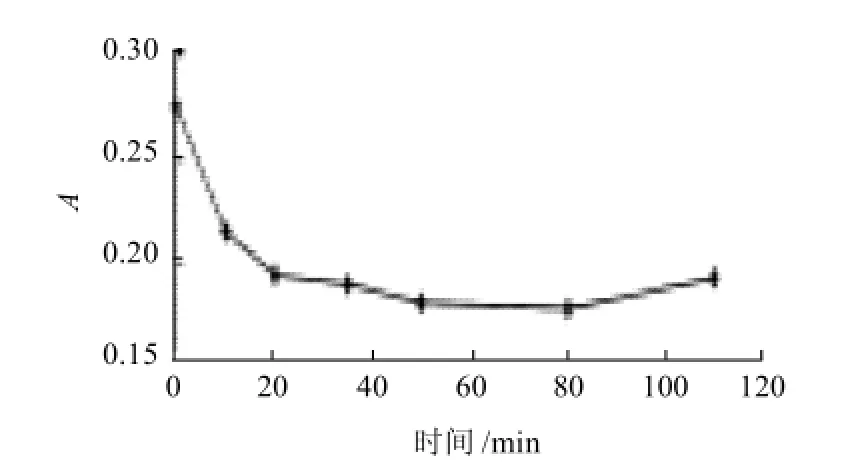
图16 微胶囊花色素在人工肠液中的释放Fig.16 Release of microencapsulated anthocyanins in artificial intestinal juice
从图16可看出,吸光度下降得很快,可能原因是在肠液的碱性环境中,花色素的化学结构遭到破坏,说明微胶囊花色素不适合存在于人工肠液环境中。
3 结 论
3.1 制备微胶囊花色素的工艺条件为花色素∶壁材1∶5、麦芽糊精∶β-环糊精1∶6、固形物含量30%、乳化剂阿拉伯树胶1.0%、喷雾干燥进口温度160℃、出口温度80℃。
3.2 研究温度、光照、蔗糖、葡萄糖、H2O2、NaHSO3、几种常见金属离子对花色素微胶囊前后的稳定性的影响,结果表明:微胶囊花色素的稳定性均有不同程度的提高,微胶囊花色素对光照、H2O2、NaHSO3、蔗糖、葡萄糖、金属离子的稳定性作用良好,但对过高的温度稳定性作用较差。
3.3 微胶囊花色素颗粒呈圆球形,水溶性较好,在人工胃液中有比较好的缓释作用,表明微胶囊花色素具有一定的缓释效果。
[1]汪慧华, 赵晨霞. 花青素结构性质及稳定性影响因素研究进展[J]. 农产品加工业, 2009(9)∶ 32-35.
[2]吴克伟, 马越, 赵晓燕, 等. 花青素类色素提取纯化研究现状及发展趋势[J] .中国食品添加剂, 2008(增刊1)∶ 147-150.
[3]ABDEL-AAL E M, YOUNG J C, RABALSKI I. Anthocyanin composition in black, blue, pink, purple, and red cereal grains[J]. Agricultural Food Chemisty, 2006, 54(13)∶ 4696-4704.
[4]黄小霞, 廖森泰, 刘学铭. 桑椹花青素与紫心红薯花青素理化性质和生物活性比较[J]. 广东蚕业, 2009, 43(2)∶ 41-45.
[5]高爱红, 袁海波, 童华荣. 天然食用色素∶ 花青素应用研究进展[J].广州食品工业科技, 2001, 17(3)∶ 75-78.
[6]李延辉, 郑凤荣, 宋人楷. 微胶囊技术及其在食品工业中的应用研究[J]. 包装与食品机械, 2003, 21(6)∶18-21.
[7]吴文娟, 郑敦胜, 蔡诗填, 等. β-环糊精聚合物微球的合成及药物控释行为的研究[J] .中药材, 2007, 30(3)∶ 329-332.
[8]刘文慧, 王颉, 王静, 等. 麦芽糊精在食品工业中的应用现状[J]. 中国食品添加剂, 2007(2)∶ 183-186.
[9]曾伟, 王燕, 杨玲. 喀什小檗色素稳定性研究[J]. 中国食品添加剂, 2010, 16(3)∶ 90-93.
[10]刘云海, 曹小红, 刘瑛. 天然色素花青素的微胶囊化研究[J]. 食品科技, 2004, 29(11)∶ 18-20.
[11]徐文秀, 吴彩娥, 李强, 等. 丁香油喷雾干燥微胶囊技术研究[J]. 食品科学, 2006, 27(1)∶ 278-281.
[12]BANGS W E, REINECCIUS G A. Characterization of selected materials for lemon oil encapsulation by spray drying[J]. Jounral of Food Science, 1990, 55(5)∶ 1356-1358.
[13]张连富, 牟德华, 杜彦山. 原花青素提取及微胶囊化研究[J]. 天然产物研究与开发, 2007, 19(4)∶ 657-661.
[14]杨玉峰, 韩春亮, 胡小军, 等. 微胶囊化姜黄色素化学稳定性的研究[J]. 河南工业大学学报, 2005, 26(2)∶ 48-50.
[15]ROSENBERG M. A scanning electorn microscopy study of microencapsulation[J]. Journal of Food Science, 1985, 50(1)∶ 139-144.
[16]WANG Y J, PAN M H, CHENG A I. Stability of curcumin in buffer solutions and characterization of its degradation products[J]. Journal of Pharmaceutical and Biomedical Analysis, 1997, 15(12)∶ 1867-1876.
[17]CABRITA L, FOSSEN T, ANDERSEN Q M. Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J]. Food Chemistry, 2000, 68(1)∶ 101-107.
[18]LAINE P, KYLLI P, HEINONEN M, et al. Storage stability of microencapsulated cloudberry (Rubus Chamaemorus) phenolics[J]. Agric Food Chem, 2008, 56(23)∶ 11251-11261.
[19]WANG Yu, LU Zhaoxin, LU Fengxia, et al. Study on microencapsulation of curcumin pigments by spray drying[J]. European Food Research and Technology, 2009, 229(3)∶ 391-396.
[20]吴春, 孔琪, 李健, 等. 槲皮素微胶囊的稳定性及缓释性能研究[J].化学与黏合, 2008, 26(1)∶ 11-13.
Microencapsulation of Anthocyanins from Fruits of Berberis kaschgarica Rupr
HUANG Jing-de,YANG Ling*
(Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Xinjiang Production and Construction corps, Alar 843300, China)
One-factor-at-a-time combined with orthogonal array design method was employed to optimize the microencapslation condition of athocyanins extracted from the fruits of Berberis kaschgarica Rupr with 80% acidified aqueous ethanol solution three times for 15 min each time under the assistance of ultrasonic. The optimal microencapslation conditions for maximizing the microencapsulation efficiency of athocyanins from the fruits of Berberis kaschgarica Rupr were core-to-wall material ratio 1∶5, maltodextrin-to-β-cyclodextrin ratio 1∶6, solid content 30%, gum acacia amount 1.0%, inlet air temperature 160 ℃, and outlet air temperature 80 ℃. Athocyanins from the fruits of Berberis kaschgarica Rupr showed an increase in the stability towards light, temperature, carbohydrates, reducing agents, oxidants and metal ions after microencapsulation.
Berberis kaschgarica Rupr;anthocyanin;microencapsulation;stability
TS201.2
A
1002-6630(2011)16-0016-06
2010-09-18
新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室开放课题(BR0905)
黄敬德(1981—),男,硕士研究生,研究方向为天然产物化学。E-mail:huangjingde81021@126.com
*通信作者:杨玲(1965—),女,教授,硕士,研究方向为天然产物化学。E-mail:yangling29@yahoo.com.cn
