灵芝多糖树脂法脱色工艺优化
2011-03-28唐庆九张劲松刘艳芳乔彦茹赵明文
罗 玺,唐庆九*,张劲松,周 帅,吴 迪,刘艳芳,王 琪,乔彦茹,杨 焱,赵明文
(1.国家食用菌工程技术研究中心,农业部应用真菌资源与利用重点开放实验室,上海市农业遗传重点开放实验室,上海市农业科学院食用菌研究所,上海 201106;2.南京农业大学生命科学学院微生物系,江苏 南京 210095;3. 河北省食用菌研究所,河北 石家庄 050035)
灵芝多糖树脂法脱色工艺优化
罗 玺1,2,3,唐庆九1,*,张劲松1,周 帅1,吴 迪1,刘艳芳1,王 琪1,2,乔彦茹1,杨 焱1,赵明文2
(1.国家食用菌工程技术研究中心,农业部应用真菌资源与利用重点开放实验室,上海市农业遗传重点开放实验室,上海市农业科学院食用菌研究所,上海 201106;2.南京农业大学生命科学学院微生物系,江苏 南京 210095;3. 河北省食用菌研究所,河北 石家庄 050035)
利用大孔树脂对灵芝多糖进行脱色。比较10种大孔树脂在脱色方面的性能,以灵芝多糖的脱色率和多糖保留率为考察指标,结果发现D303树脂的脱色效果最佳,通过单因素试验和正交试验对D303树脂的灵芝多糖脱色各种工艺参数进行优化,得到D303树脂静态脱色的最佳参数为在样品上样质量浓度15mg/mL、pH6、脱色温度50℃、脱色时间7h条件下,灵芝多糖溶液的脱色率可达91.89%,多糖保留率75.28%;D303树脂动态脱色的最佳参数为上样流速3BV/h、每毫升树脂上样量150mg,此条件下灵芝多糖溶液的脱色率可达92.01%,多糖保留率71.85%。研究表明D303树脂适合应用于灵芝多糖的脱色工艺。
灵芝;多糖;脱色;树脂
灵芝(Ganoderma lucidum (Curtis∶Fr.) P.Karst)为多孔菌科的担子菌,在我国是一种重要药用真菌,作为药用已有2000多年的历史[1]。大量研究表明灵芝多糖是其主要活性成分之一,具有免疫调节[2-4]、抗肿瘤[5-7]、抗氧化[8]、抗病毒、降血糖和保肝等药理作用。
传统工艺提取的灵芝多糖产品颜色深、杂质多,不利于作为功能性食品或药品进一步研究与开发。为去除产品中的色素,需要对其进行脱色处理。传统脱色方法一般有活性炭吸附、双氧水氧化法[9]等,其中活性炭法脱色时间较长,多糖保留率低,双氧水是强氧化剂,容易破坏多糖结构,影响其活性[10]。
大孔树脂技术是上世纪七十年代发展起来的一种新工艺,近年来常应用于色素精制[11]及中药提取分离。大孔树脂具有物理化学稳定性高、比表面积大、处理能力大、选择性好、吸附速度快、解吸条件温和、再生处理方便、使用周期长、成本不高等诸多优点,运用大孔树脂的分离工艺所得提取物体积小、不吸潮,容易制成外型美观的产品,解决了产品的粗、大、黑等问题[12]。本实验探讨大孔吸附树脂和大孔离子交换树脂对灵芝多糖的脱色情况,采用单因素和正交试验对脱色条件进行优化。
1 材料与方法
1.1 材料与试剂
灵芝原材料为上海市食用菌所灵芝品种(沪农1号),在安徽金寨灵芝基地栽培获得;Balb/c小鼠(SPF级,8~10周龄,体质量28g±2g) 中国科学院上海实验动物研究中心;小鼠RAW264.7骨髓巨噬细胞株 美国国家菌种保藏中心。
D303、D315、335、HZ202、HZ801、HZ806、HZ816、JK206树脂 上海华震科技有限公司;D-900、MG-1树脂 沧州宝恩吸附材料科技有限公司;无色RPMI1640培养基;0.05%胰蛋白酶;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;抗生素(青霉素和链霉素) 美国Amresco公司;Alamar Blue试剂 美国Biosource公司;植物凝集素(phytohemagg lutinin,PHA)、5-Fu 美国Simga-Aldrich公司;95%乙醇、苯酚、浓硫酸、盐酸及氢氧化钠均为国产分析纯。
1.2 仪器与设备
BC-R2001型旋转蒸发仪 上海贝凯生物化工设备有限公司;Synergy HT型多功能酶标仪 美国Bio-Tek公司;UF-3530超滤膜 上海弗立特实业有限公司。
1.3 方法
1.3.1 树脂的预处理
大孔离子交换树脂D303、D315、335、JK206、 D-900用2倍体积4% NaOH溶液搅拌浸泡2h,蒸馏水洗至中性,再用2倍体积4% HCl溶液搅拌浸泡2h,蒸馏水洗至中性,再用2倍体积4% N aOH溶液搅拌浸泡2 h,蒸馏水洗至p H 8,备用。
大孔吸附树脂HZ202、HZ801、HZ806、HZ816、MG-1用95%乙醇搅拌浸泡4h,使其充分溶胀,然后用乙醇重复洗至洗涤液在试管中加3倍水不显浑浊为止,用蒸馏水洗至无醇味,备用。
1.3.2 灵芝粗多糖的制备
1kg灵芝子实体粉碎后,按料液比1∶20(g/mL)加水,沸水浸提2h,过滤,滤渣再沸水提取一次后过滤,合并两次提取的滤液。滤液浓缩至10L后,将浓缩液转到UF-3530超滤膜上进行超滤(选用截留分子质量为10000D和500000D的超滤膜),冷冻干燥最终得到10000~500000D的灵芝粗多糖干品。
1.3.3 静态试验粗筛树脂
准确量取50mL经预处理的10种树脂于250mL三角瓶中,加入40mL 40mg/mL 10000~500000D灵芝多糖粗提物溶液,置于摇床中,120r/min、25℃振荡24h,取上清液在波长450nm处测定吸光度计算脱色率,测定多糖含量计算多糖保留率。
1.3.4 不同型号树脂脱色后的灵芝多糖粗提物对巨噬细胞产生NO的刺激试验
将样品用PBS溶解并配成20、100、500μg/mL的溶液(终质量浓度2、10、50μg/mL),以10μg/mL的LPS为阳性对照(终质量浓度1μg/mL)、PBS为阴性对照,参照文献[13]方法测定不同型号树脂脱色后的灵芝多糖粗提物对巨噬细胞产生NO的刺激作用。
1.3.5 不同型号树脂脱色后的灵芝多糖粗提物刺激淋巴细胞增殖试验
将样品用PBS溶解并配成200、500、1000μg/mL溶液(终质量浓度20、50、100μg/mL),以60μg/mL的PHA为阳性对照(终质量浓度6μg/mL),PBS为阴性对照,参照文献[14]的方法测定不同型号树脂脱色后的灵芝多糖粗提物对淋巴细胞的增殖作用。
1.3.6 单因素试验和正交试验
静态试验结合细胞试验筛选出的树脂,以灵芝多糖粗提物溶液的脱色时间、温度、pH值和样品质量浓度为单因素条件,测定并计算不同条件下的脱色率及多糖保留率,在单因素试验基础上设计正交试验,优化脱色条件。
1.3.6.1 静态吸附动力学试验
准确量取处理好的大孔树脂5mL,加入20mg/mL 40mL灵芝多糖粗提物,置于摇床中,120r/min、20℃脱色。取上清液在450nm测定吸光度计算脱色率。
1.3.6.2 温度对树脂脱色的影响
准确量取大孔树脂5mL,加入20mg/mL 40mL灵芝多糖粗提物,分别在10、20、30、40、50、60℃,置于摇床中,120r/min、pH7脱色100min,取上清液在波长450nm处测定吸光度计算脱色率,测定多糖含量计算多糖保留率。
1.3.6.3 pH值对树脂脱色的影响
准确量取大孔树脂5mL,加入20mg/mL 40mL灵芝多糖粗提物,将样品溶液pH值调为4、6、7、8、10、12,置于摇床中,120r/min、20℃脱色60min,取上清液在波长450nm处测定吸光度计算脱色率,测定多糖含量计算多糖保留率。
1.3.6.4 样品质量浓度对树脂脱色的影响
准确量取大孔树脂5mL,加入40mL灵芝多糖粗提物,样品溶液事先配成5、10、15、20、30、40mg/mL,置于摇床中,120r/min、20℃、pH7脱色6h,取上清液在波长450nm处测定吸光度计算脱色率,测定多糖含量计算多糖保留率。
1.3.6.5 灵芝多糖粗提物脱色正交试验
在单因素试验的基础上,采用正交试验法确定10000~500000D的灵芝多糖粗提物的最佳脱色条件,按照L9(34)正交表设计试验(表1)。
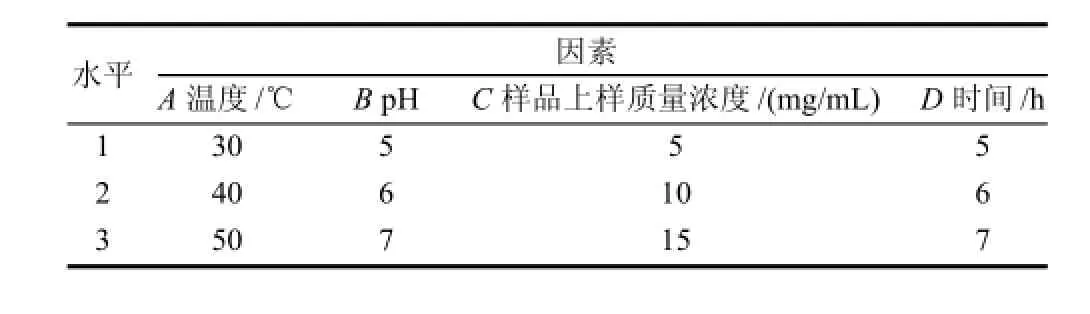
表1 灵芝多糖粗提物脱色正交试验因素及水平Table 1 Factors and their levels in orthogonal array design
1.3.7 动态试验
1.3.7.1 上样流速对树脂脱色的影响
取预处理好的D303树脂10mL湿法装住(φ1.7cm× 30cm玻璃层析柱),样品溶液分别以1、3、3.5、4.5BV/h的流速进行动态脱色试验(1BV=10mL)。在450nm波长处测定上清液的吸光度,计算脱色率。
1.3.7.2 上样量对树脂脱色的影响
取预处理好的D303树脂10mL湿法装住(φ1.7cm× 30cm玻璃层析柱),将15mg/mL样品溶液以3BV/h的流速经过大孔树脂层析柱,分段收集流出液,在波长450nm处测定上清液的吸光度,并计算脱色率,测定多糖含量,并计算多糖保留率。
1.3.8 分析方法
1.3.8.1 脱色率的测定及计算方法
将灵芝多糖粗提物溶液在200~800nm波长范围内进行全波长扫描,发现溶液在可见光区无吸收峰,而在380~550nm的吸收呈递减趋势。根据互补色原理可知,溶液呈现的颜色是它吸收光的互补色,由于多糖溶液脱色前后稀释后均为橙黄色,所以溶液主要吸收蓝色波段可见光。因此选择处于该波段中心的450nm波长为检测波长,测定溶液的吸光度,并计算脱色率。

1.3.8.2 多糖保留率的测定
采用苯酚-硫酸法[15]测定灵芝粗多糖脱色前后的多糖含量。

2 结果与分析
2.1 树脂粗筛
通过10种树脂对灵芝多糖的脱色率和多糖保留率的比较发现(表2),在弱阴离子交换树脂D303、D315、335、D-900中,D303和D315脱色效果好,多糖保留率较高,适合灵芝多糖溶液的脱色。强阴离子交换树脂HZ202、JK206对灵芝多糖的吸附比较大,多糖损失多,故保留率均极低,不适合灵芝多糖溶液的脱色。大孔吸附树脂HZ801、HZ816(非极性)、吸附树脂HZ806 (中极性)和MG-1(强极性)中,HZ801和HZ816多糖保留率较低,MG-1脱色率较低,不适合灵芝多糖溶液的脱色。综合考虑多糖保留率、脱色率,D303、D315、HZ806这3种型号的大孔树脂脱色效果较好。
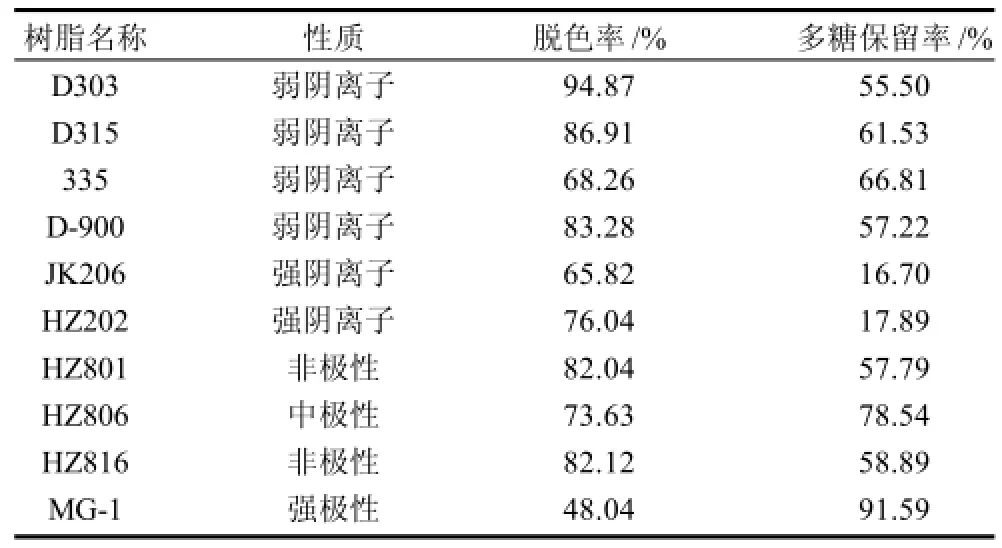
表2 10种树脂的脱色能力比较Table 2 Comparison of decolorization performance of 10 types of macroporous resin
2.2 体外刺激RAW264.7巨噬细胞株生成NO试验
灵芝多糖主要具有调节免疫的功能,具有激活巨噬细胞作用,对树脂处理前后的灵芝多糖刺激巨噬细胞活性进行比较发现(图1),在2~50μg/mL的质量浓度条件下,处理前的样品以及经D-900、JK206、HZ202、HZ801、HZ806、HZ816树脂脱色处理后的样品,不能刺激巨噬细胞产生NO,MG-1脱色处理后的样品仅在高浓度下才有刺激NO产生的作用,而经D315、D303、335树脂处理后的样品,活性明显增强,可明显刺激巨噬细胞产生NO。
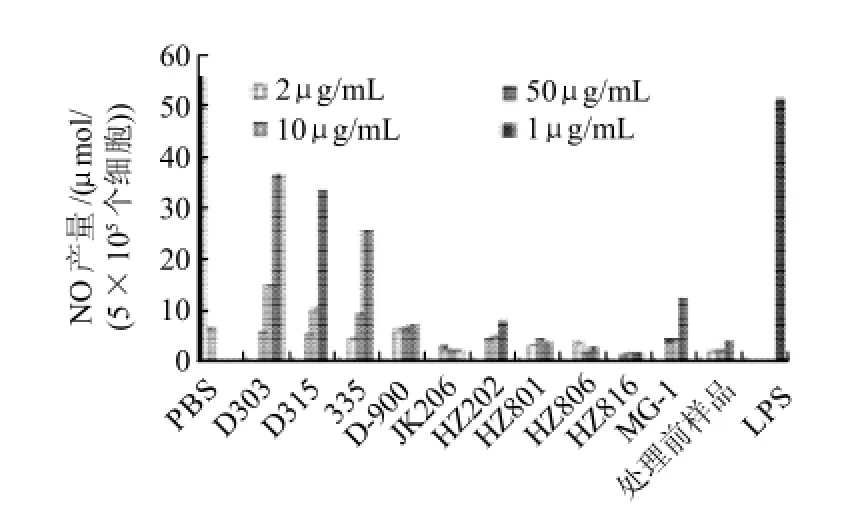
图1 不同型号树脂脱色后灵芝多糖对巨噬细胞产生NO的影响Fig.1 Effect of Ganoderma lucidum polysaccharides decolorized by 10 types of macroporous resin on nitrite production by macrophages
2.3 体外刺激淋巴细胞增殖试验
同时对灵芝多糖脱色前后对淋巴细胞的刺激作用进行比较发现(图2),在20~100μg/mL质量浓度条件下,处理前的样品和经HZ806树脂脱色处理的样品对淋巴细胞没有明显增殖作用,而经D315、D303树脂处理后的样品能明显刺激淋巴细胞增殖。

图2 不同型号树脂脱色后灵芝多糖对淋巴细胞增殖的影响Fig.2 Effect of Ganoderma lucidum polysaccharides decolorized by 10 types of macroporous resin on lymphocyte proliferation rate
综合考虑脱色率、多糖保留率以及免疫活性3个指标,最终选择D315、D303两种型号的树脂做进一步脱色试验。
2.4 单因素和正交试验
2.4.1 静态吸附色素动力学过程
由图3可知,随着时间的延长,D303树脂脱色效果明显增强,D303树脂到6h后,脱色率增加缓慢,几乎不再变化,色素的吸附和解吸达到了平衡,因此D303树脂最佳脱色时间为6h。D315树脂脱色缓慢,吸附色素的平衡时间大于12h,不利于试验研究,并且24h后的脱色率明显不如D303树脂,故后面的试验以D303为主要研究对象。
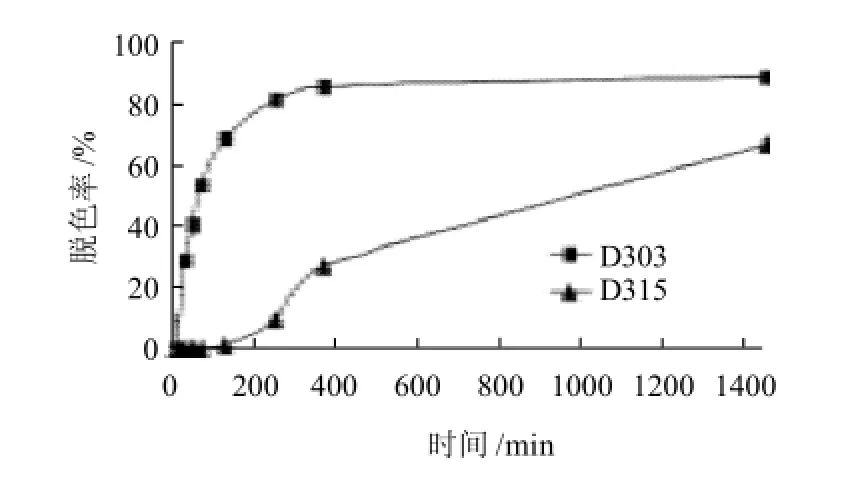
图3 静态吸附色素动力学曲线Fig.3 Dynamic decolorization curves of types D303 and D315 macroporous resins
2.4.2 温度对脱色效果的影响
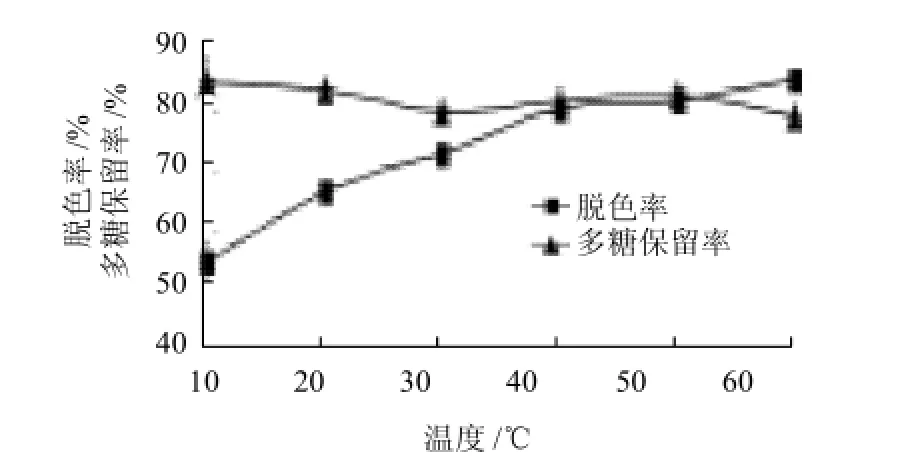
图4 温度对D303脱色效果的影响Fig.4 Effect of temperature on decolorization rate and polysaccharide retention rate
由图4可知,随着温度的增加,色素分子扩散速度加快,多糖溶液的黏度下降,有利于色素的吸附。D303树脂达到40℃后,脱色率变化缓慢,温度对多糖保留率的影响不大,多糖保留率一直保持在80%左右,考虑到加热设备等因素,D303树脂最佳脱色温度设为40℃。
2.4.3 pH值对脱色效果的影响

图5 pH值对D303脱色效果的影响Fig.5 Effect of pH value on decolorization rate and polysaccharide retention rate
由图5可知,在pH6时,D303树脂脱色效果最佳,这可能与灵芝多糖溶液中的色素在偏酸性条件下表现为弱极性或非极性有关。当样品溶液碱性太强时,某些色素分子性质可能发生改变,使得样品溶液颜色加深,从而使脱色率降低,多糖保留率一直保持在80%左右,故D303树脂最佳pH值为6。
2.4.4 样品上样质量浓度对脱色效果的影响
由图6看出,随着上样质量浓度的增加,脱色率下降,多糖保留率提高,在上样质量浓度为10~15mg/mL范围内,脱色率开始明显下降,在20mg/mL时脱色率已经降低到90%以下,故D303树脂上样质量浓度设为10~15mg/mL。

图6 样品上样质量浓度对D303脱色效果的影响Fig.6 Effect of sample concentration on decolorization rate and polysaccharide retention rate
2.4.5 灵芝多糖粗提物脱色正交试验
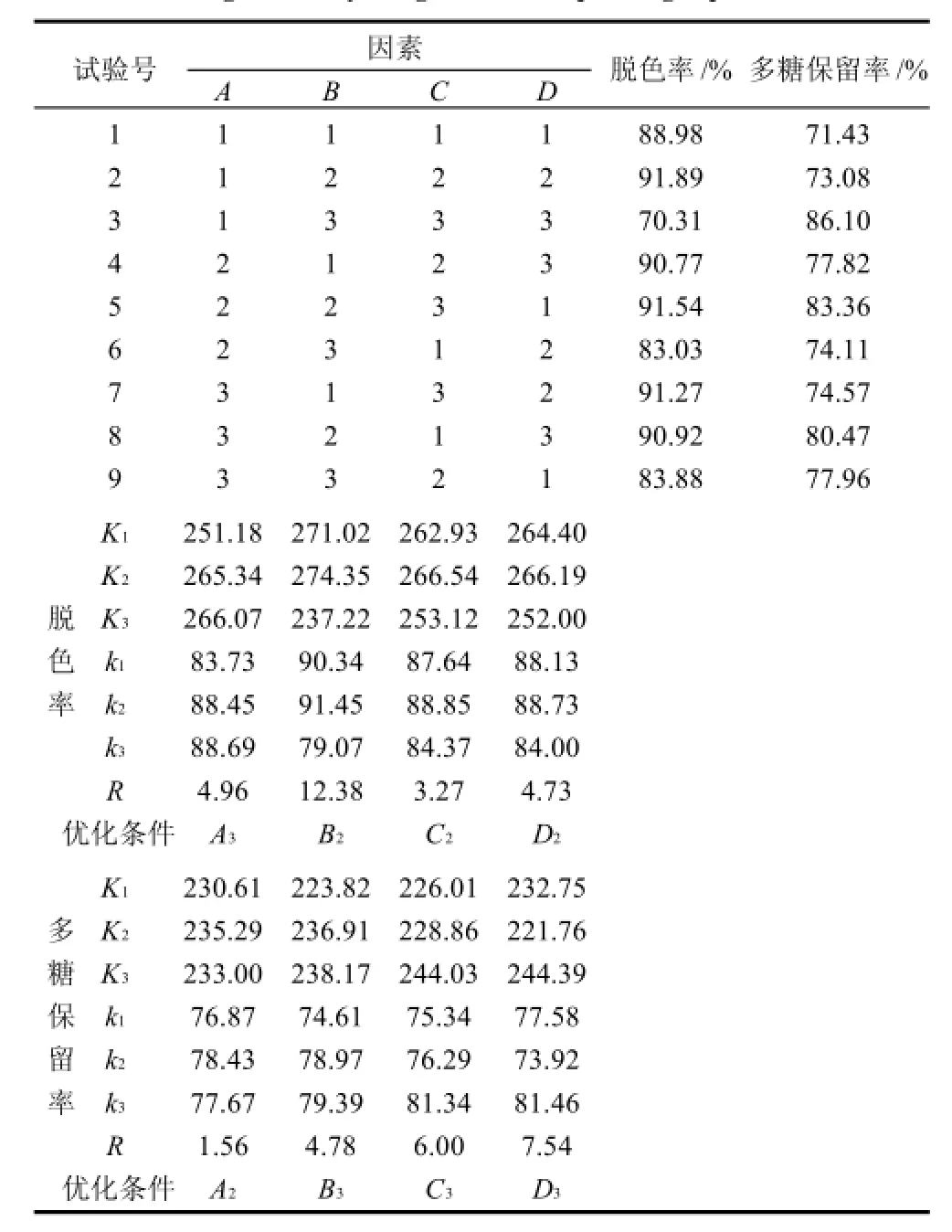
表3 灵芝多糖粗提物脱色正交试验设计及结果Table 3 Orthogonal array design and corresponding experimental results
由表3脱色率极差分析可知,pH值对脱色率影响较大,温度次之,上样质量浓度对脱色率影响最小。偏碱性或偏酸性条件下,可能改变了色素分子的某些性质,如所带的电荷、疏水性、极性,以及与树脂形成氢键的能力,故pH值对大孔树脂的脱色能力影响较大。D303树脂最佳脱色条件为温度50℃、pH6、上样质量浓度10mg/mL、脱色时间6h。
由表3多糖保留率极差分析可知,脱色时间对于多糖保留率影响较大,上样质量浓度次之,温度对多糖保留率影响最小。D303树脂最佳多糖保留率条件为温度40℃、pH7、上样质量浓度15mg/mL、脱色时间7h。
综合脱色率及多糖保留率的极差分析表,最终确定D303树脂对10000~500000D的灵芝多糖粗提物的最佳脱色工艺为脱色温度50℃、pH6、上样质量浓度15mg/mL、脱色时间7h。在此条件下测得灵芝多糖粗提物脱色率可达到91.89%,多糖保留率达75.28%。
2.5 动态试验
2.5.1 上样流速对树脂脱色的影响
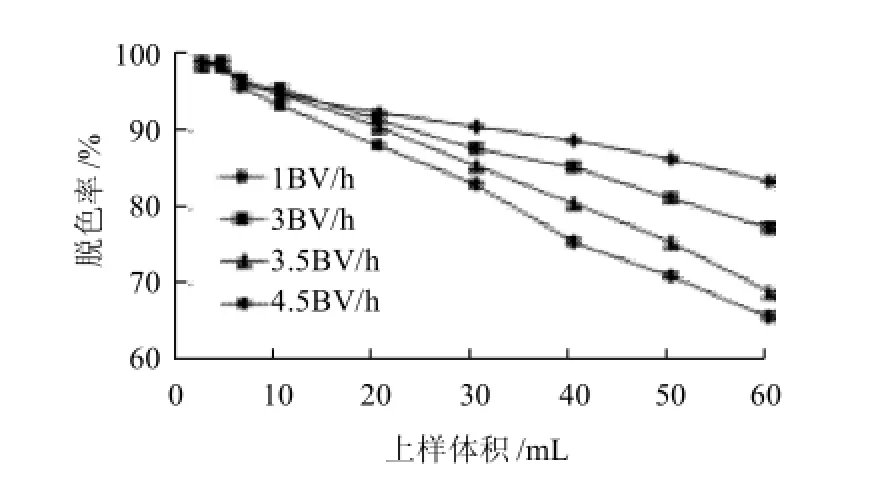
图7 上样流速对D303脱色效果的影响Fig.7 Effect of sample loading flow rate on decolorization rate
由图7看出,随着上样体积的增加,脱色率降低。当流速为1BV/h时,脱色率较高且降低缓慢,流速低有利于色素在树脂柱中充分扩散,使其充分被树脂吸附,但是流速过慢,影响生产效率,延长了脱色的生产周期。流速过高时,色素没有充分被树脂吸附,造成脱色率的快速下降。综合考虑,最佳上样流速设为3BV/h。
2.5.2 上样量对树脂脱色的影响
由图8可看出,随着上样体积的不断增加,脱色率逐渐下降,多糖保留率逐渐升高,在上样质量浓度15mg/mL条件下,上样量150mg时,脱色率开始明显下降,多糖保留率上升缓慢,说明树脂已达到饱和,饱和上样量为每毫升树脂150mg。
在上样流速3BV/h、每毫升树脂上样量150mg条件下,测得灵芝粗多糖溶液的脱色率可达到92.01%,多糖保留率71.85%。
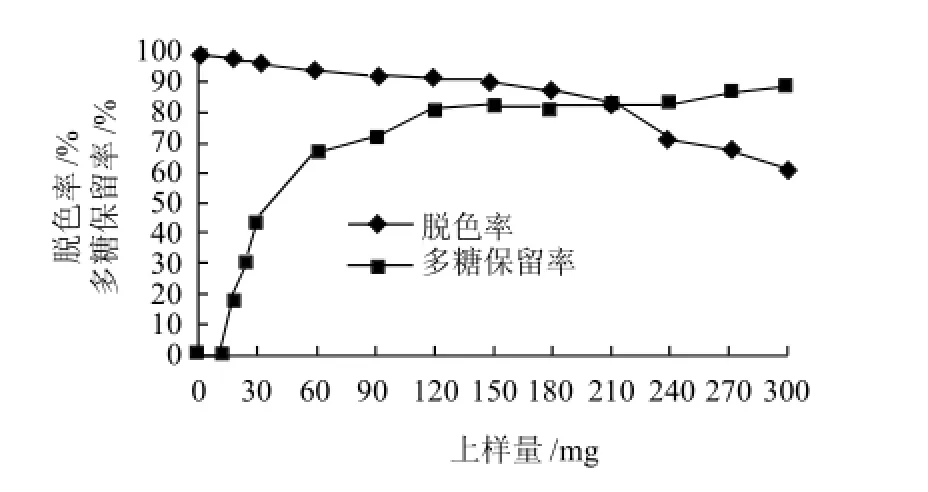
图8 上样量对D303脱色效果的影响Fig.8 Effect of sample loading amount on decolorization rate and polysaccharide retention rate
3 讨 论
采用大孔离子交换树脂和大孔吸附树脂对灵芝多糖粗提物进行脱色处理,以脱色率、多糖保留率以及免疫活性3个指标筛选出D303树脂脱色效果最好。试验结果表明非极性和弱阴离子树脂的脱色效果较好,推测灵芝中的色素可能为阴离子型的非极性或弱极性物质。D303等弱阴离子交换树脂,对多糖的吸附较弱,所以多糖保留率较高,经脱色后的灵芝粗多糖免疫活性提高,可能因为其吸附色素或者其他物质,这些物质可能对免疫活性具有抑制作用,所以这类物质去除后灵芝粗多糖免疫活性显著提高,对于这类物质是否具有免疫抑制作用还需做进一步研究。HZ202等强阴离子交换树脂,对多糖的吸附强,部分活性多糖大量损失,所以经脱色后的灵芝多糖免疫活性很低,不适合灵芝多糖的脱色;HZ801、HZ806等大孔吸附树脂在吸附色素的同时,也对多糖有吸附作用,可能吸附了具有活性的灵芝多糖,因此经其脱色后灵芝多糖免疫活性仍然很低,不适合灵芝多糖的脱色。因此弱阴离子交换树脂是一种适合用于灵芝多糖脱色的树脂。
通过单因素和正交试验对其进行优化,获得D303树脂最佳静态脱色工艺:样品上样质量浓度15mg/mL、pH6、脱色温度50℃、脱色时间7h,在此条件下测得灵芝多糖粗提物脱色率可达到91.89%,多糖保留率75.28%;D303树脂最佳动态脱色工艺为上样流速3BV/h、每毫升树脂上样量150mg,在此条件下测得灵芝多糖粗提物脱色率可达到92.01%,多糖保留率71.85%。通过D303树脂的处理,达到了较满意的脱色效果和较高多糖保留率,同时颜色由褐色变成淡黄色。
目前,大孔树脂脱色工艺已经在生产和研究中得到大量的应用,如利用AB-8树脂对低分子质量灵芝多糖脱色,脱色率可达87.3%[10];采用AB-8树脂对桑叶粗多糖溶液脱色,脱色率可达82%[16];采用LSA-800B树脂对大枣多糖提取液的脱色,对色素的吸附率可达91.2%[17]。在中药新药的开发和中成药的生产上,一些企业也大量应用大孔树脂的脱色技术,用于改善产品的外观,提高有效成分的含量。灵芝多糖脱色工艺的研究改善了灵芝多糖产品的外观,为灵芝药物的研发提供一定参考。
[1]林志彬. 灵芝的现代研究[M]. 2版. 北京∶ 北京医科大学出版社, 2001∶1-5; 219-252.
[2]ZHANG Jingsong, TANG Qingjiu, ZIMMERMAN-KORDMANN M, et al. Activation of B lymphocytes by GLIS, a bioactive proteoglycan from Ganoderma lucidum[J]. Life Sci, 2002, 71(6)∶ 623-638.
[3]CHEN Xiaoping, CHEN Yan, LI Shuibing, et al. Free radical scavenging of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats[J]. Carbohydrate Polymers, 2009, 77(2)∶ 389-393.
[4]唐庆九, 张劲松, 潘迎捷, 等. 灵芝活性多糖GLIS对正常和荷瘤小鼠骨髓巨噬细胞的激活作用[J]. 现代免疫学, 2005, 25(1)∶ 49-55.
[5]张劲松, 唐庆九, ZIMMERMAN-KORDMANN M, 等. 灵芝中肿瘤细胞凋亡诱导剂的研究[J]. 食用菌学报, 2006, 13(2)∶ 15-21.
[6]ZHAO Liyan, DONG Yanhong, CHEN Guitang, et al. Extraction, purification, characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J]. Carbohydrate Polymers, 2010, 80(3)∶ 783-789.
[7]XIE Yizhen, LI Senzhu, YEE A, et al. Ganoderma lucidum inhibits tumour cell proliferation and induces tumour cell death[J]. Enzye Microbial Tech, 2006, 40(1)∶ 177-185.
[8]张璐璐, 庞秀炳, 尹登科, 等. 灵芝多糖对肾小球系膜细胞增殖的影响和体外抗氧化活性的研究[J]. 药物生物技术, 2008, 15(6)∶ 435-438.
[9]朱越雄, 孙海一, 曹广力. 野生糙皮侧耳子实体多糖的脱色素效果比较[J]. 光谱实验室, 2005, 22(5)∶ 1070-1073.
[10]袁红波, 张劲松, 贾薇, 等. 利用大孔树脂对低分子量灵芝多糖脱色的研究[J]. 食品工业科技, 2009, 30(3)∶ 204-206.
[11]李崇瑛, 王安, 杨涛, 等. 食用天然色素的纯化与研究进展[J]. 中国调味品, 2007, 32(9)∶ 18-22.
[12]王一敏, 任晓蕾. 大孔树脂的应用研究[J]. 中医药信息, 2008, 25(4)∶26-28.
[13]王永敏, 祝文兴, 安利国, 等. 蛹虫草胞外多糖的提取纯化及免疫活性研究[J]. 食品与药品, 2009, 11(3)∶ 8-11.
[14]沈学香, 杨焱, 张劲松, 等. 桑黄多糖的分离纯化及体外免疫活性的研究[J]. 食用菌学报, 2008, 15(2)∶ 31-36.
[15]张惟杰. 糖复合物生化研究技术[M]. 杭州∶ 浙江大学出版社, 1999∶10-12.
[16]夏玮, 吕庆, 张文清, 等. 大孔吸附树脂脱色桑叶多糖的研究[J]. 食品与发酵工业, 2007, 33(2)∶ 141-144.
[17]刘海霞, 牛鹏飞, 王峰, 等. 大孔吸附树脂对大枣多糖提取液的脱色条件研究[J]. 食品与发酵工业, 2007, 33(10)∶ 180-184.
Optimization of Decolorization Technology of Ganoderma lucidum Polysaccharides by Macroporous Resin Adsorption Method
LUO Xi1,2,3,TANG Qing-jiu1,*,ZHANG Jin-song1,ZHOU Shuai1,WU Di1,LIU Yan-fang1,WANG Qi1,2,QIAO Yan-ru1,YANG Yan1,ZHAO Ming-wen2
(1. National Engineering Research Center of Edible Fungi, Key Laboratory of Applied Mycological Resources and Utilization, Ministry of Agriculture, Shanghai Key Laboratory of Agricultural Genetics and Breeding, Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China;2. Department of Microbiology, College of Life Sciences, Nanjing Agricultural University, Nanjing 210095, China;3. Institute of Edible Fungi of Hebei Province, Shijiazhuang 050035, China)
The purpose of this study was to develop a macroporous resin adsorption method for the decolorization of Ganoderma lucidum polysaccharides. Ganoderma lucidum polysaccharides with a molecular weight between 10 kD and 500 kD were obtained by extracting Ganoderma lucidum fruiting bodies twice with boiling water, concentrating and ultrafiltrating with different MWCO (10 kD and 500 kD) membranes. Ten types of macroporous resin were compared for their effectiveness in decolorizing the polysaccharides. Based on decolorization rate and polysaccharide retention rate, type D303 macroporous resin had the best decolorization performance. Process parameter optimization for the decolorization of Ganoderma lucidum polysaccharides by static adsorption of type D303 macroporous resin were performed using one-factor-at-a-time combined with orthogonal array design method. The optimum conditions for static decoloration of resin D303 were as follows∶ sample concentration 15 mg/mL, pH 6, decoloration temperature 50 ℃, and decoloration time 7 h. Under the optimal conditions, a decoloration rate of 91.89% and a polysaccharide retention rate of 75.28% were obtained. The optimum conditions for dynamic decoloration of resin D303 were as follows∶ flow rate 3 BV/h (1 BV=10 mL), and sample loading amount 150 mg/mL resin, resulting in a decoloration rate of 92.01% and a polysaccharide retention rate of 71.85%. These findings collectively indicated that the resin D303 was more suitable for the decoloration of Ganoderma lucidum polysaccharides.
Ganoderma lucidum;polysaccharide;decoloration;resin
R284.2;TQ929.2
A
1002-6630(2011)16-0005-06
2010-10-13
国家“863”计划项目(2007AA10Z341)
罗玺(1985—),女,硕士研究生,研究方向为灵芝多糖的分离纯化工艺。E-mail:sjzlxcandy@163.com
*通信作者:唐庆九(1969—),女,副研究员,博士,研究方向为药用真菌活性成分及药理活性。E-mail:tangqingjiu2003@yahoo.com.cn
