双光子显微成像技术的新进展
2011-03-24夏伟强周源石明
夏伟强,周源,石明
1 北京航空航天大学 仪器科学与光电工程学院,北京,100191
2 河北承德实验中学,河北,承德,167101
双光子显微成像技术的新进展
【作 者】
夏伟强1,周源2*,石明2
1 北京航空航天大学 仪器科学与光电工程学院,北京,100191
2 河北承德实验中学,河北,承德,167101
双光子显微成像技术是近年发展起来的一种新型非线性光学成像方法,由于其优异的特性已广泛用于细胞生物活细胞、组织的长时间动态三维成像。文中首先介绍了双光子成像的原理和特点;在此基础上总结了双光子显微成像技术的研究热点;其次并分别就如何获得更低的细胞损害、更快的图像获取速度和更高的成像灵敏度三个方面作了论述;最后展望了双光子显微成像技术的发展前景。
双光子;全内反射;活细胞成像;三维成像;光致漂白
0 引言
1990年,Denk等将双光子激发用于荧光激发系统,制造出了世界上第一台双光子扫描显微镜,并应用于生物学观测[1]。1997年,美国伯乐公司首次制造出商业化的双光子显微镜。双光子激光扫描显微镜一经问世,由于其低细胞损伤,大成像深度和可用于活细胞长时间三维成像,很快被用于神经信号传导、生物代谢过程以及药物研究[2]。从此,荧光标记技术和光学显微镜技术的结合,使观察和研究活体细胞的动态生命过程成为很普通的事情[3-6]。
近年来,细胞内的信号转导逐渐成为细胞生物学的研究重点,而细胞中Ca2+是重要的第二信使,对于调节细胞的生理反应具有重要的作用。利用双光子荧光显微成像技术,可以无损地观察细胞内用荧光探针标记的Ca2+图像随时间和空间的变化,还可以观察细胞某一层面或局部的Ca2+荧光图像和变化。此有助于研究者更深人的研究和了解钙离子在细胞内的动态变化过程和生物调控机制,弄清各信号系统之间的相互关系,找出细胞内不同类型Ca2+是否能引起不同基因表达的原因,从而帮助生物学家及生理学家总结出Ca2+作为胞内第二信使在信号转导中的规律[7-9]。
双光子荧光成像技术,采用长波激发,能对组织深层次成像,且许多常用最佳激发波长位于800-900 nm,水、血液和固有组织发色团对这个波段的光吸收低,还有散射的激发光子不能激发样品,因此背景和光损伤小,所以适用于在体检测[10-11]。双光子荧光成像技术能准确确定细胞内微电极的位置,能够探测到胞体、树突甚至单个树突棘的活性。Mainen[12]用双光子显微镜观察了完整神经组织的高分辨荧光图像,可看到脑组织神经细胞单个树突棘中的钙分布。Eilers[13]用这一技术研究了神经元树突的信号整合。Masters[14]用双光子显微镜原位测量了人皮肤中NAD( P) H的自发荧光,以观察皮肤的代谢情况。
近些年,随着光学技术、荧光探针技术以及生物技术[15]的发展,双光子成像技术出现了新的特点和新的应用,大大推动了其在活体细胞及组织成像的应用。
1 双光子成像特点
双光子成像技术与传统的单光子成像相比有很多优点。可用单光子、双光子和二次谐波光子激发荧光的Jabonski能级示意图(图1)比较来说明荧光成像原理[16][17][18][19]。

图 1 光子激发荧光的Jablonski能级图比较Fig.1 Comparison of Jablonski Diagram of Two-photon Excitation
在图1中,S0、S1、S2表示光子能级,λ1、λ2、λ3是光子波长。其中,单光子显微镜(One-photon microscopy),在短波长光波(紫外光或紫蓝色光,其中λ1波长250~400nm)照射下,某些物质吸收光能,一个荧光团吸收一个光子,受到激发并释放出一种能量降级的较长的光波(蓝、绿、黄或红光,波长400~800 nm,>λ1),实现成像。单光子显微技术是最成熟的荧光显微技术[20],实现容易,结构简单,对成像硬件要求低。但由于此技术使用的激发光能量较大,会造成对荧光物质的漂白作用,光毒性严重,且由于激发波长较短,成像深度有限。当采用激光共焦扫描显微镜(图 2)时,由于共焦显微镜的孔径很小,实现样本三维成像要逐点扫描,成像速度慢,对样本损害大,很难用于长时间活细胞成像。当采用宽场显微镜时,能够很好地实现实时动态成像,光漂白小,因而在活细胞内的实时检测中应用较早。但宽场显微镜由于离焦信号的干扰,难于实现多维成像(图 3)。

图 2 共聚焦激光扫描显微术(LSCM)与双光子激发激光扫描显微术(TPELSM)Fig.2 Comparison of Confocal(LSCM) and Two-photon Microscope(TPELSM)

图 3 单光子和双光子成像特点Fig.3 Comparison of characteristics of one-photon excitation and two-photon excitation
双光子显微镜(Two-photon microscopy),是结合了共聚焦激光扫描显微镜和双光子激发技术的一种新技术[17-19](如图2)。它用fs(飞秒)激光器作为激发光源,利用极高的光子密度实现多光子非线性激发,即荧光分子同时吸收两个长波长的光子到激发态(如图 1中λ2), 在经过一个很短的所谓激发态寿命的时间后,发射出一个波长大于激发光波长一半的较短的光子,从而实现成像。多光子激发为非线性过程,其吸收截面(跃迁几率)较小,并与激发光光强的n次方成正比(n为荧光分子一次吸收的激发光光子数),因此多光子激发只有在焦点附近的极小区域内才能发生,无需共聚焦针孔便可实现三维高分辨成像,如图 2(b)所示。同时,激发光光子的能量减为单光子激发时的1/n,因此波长约为单光子激发波长的n倍,可采用近红外超快激光作为激发光源。长波长的近红外光比短波长的光对细胞毒性小,只有在焦平面上才有光漂白和光毒性。样本更深穿透(双光子>500 μm;单光子100 μm),双光子显微镜比单光子显微镜更适合用来观察厚标本,更适合用来观察活细胞甚至活组织的三维、四维实时观测(如图 3)[11-12]。但是,双光子显微镜不能用于可吸收红外样品,如色素等,分辨率低于标准共聚焦(低一半),短脉冲比长脉冲有更大细胞损害,在对焦面荧光漂白比标准单光子大[21],并且激光系统贵而复杂,只可应于荧光成像。
2 双光子成像技术研究热点
由于激光照射会导致细胞漂白和伤害细胞,所以使用光学显微镜观察活体细胞是获得高信噪比图像和观测中对细胞致损的平衡。没有哪个单独的显微系统能够满足一切要求,必须找到最佳折衷点。文献[22]给出了在设计成像系统之前,首先需要考虑检测灵敏度、捕获速度和样本的生存能力三个因素,以及在具体处理时的一些基本原则。另外,还强调在整个观测装置的设计中,保持细胞环境不变也是非常重要的,如在时间变化的实验中,一旦正在对样本进行成像,则焦平面必须保持稳定。选择合适的技术手段,对于整个观测装置的设计实现,具有很重要的指导意义。
2.1 减小细胞损害
对于活体成像和长时间成像,最重要的是要保证细胞的正常生长。荧光团受光照后产生的氧化物质与蛋白质、核酸和脂肪等物质发生反应,使荧光信号降低(光致退色),并降低活体细胞寿命(光线损伤)。在光照过程中氧化剂的产生,主要决定于荧光团的光化学性质和光照剂量,因此减少光照剂量成为解决上述问题的途径之一[21-22]。需要尽可能地减少激光照射时间和照明度。要移除不需要的波长的光,这不能仅仅依靠激励滤镜,而必须进行光源优化设计。减少氧气的级别也可以减小光漂白和自由基的产生,这需要控制细胞生长环境的氧气含量。减小酚红含量可以减小背景荧光。成像系统必须充分利用光线,所以必须选择大数值孔径的目镜,尽量减小光路的光学组件。CCD和光电倍增管等感光传感器的灵敏度也非常重要,因为灵敏度越高对于光强的要求越低,越有利于减小激发光强度。
当然,最重要的还是减少光照量。有文献[23]提出一种利用闭环控制技术实现优化光照剂量的细胞成像系统 (CLEM),在确保成像信噪比的同时降低了光致退色和光线损害。对于传统荧光细胞成像技术,视野中各像素点的光照剂量完全相同,所用光照剂量应确保使荧光团低浓度区成像的信噪比达到设计要求。这意味着荧光团高浓度区成像的信噪比将高于所需要指标,而对于背景区由于不存在荧光团,所以根本不需要激励光照。文献提出的成像系统对背景区、低荧光团浓度区和高荧光团浓度区施加不同的光照剂量,在保证信噪比的同时最大限度地减轻了光致退色和光线损伤。如图4(a)所示,可通过降低荧光团高浓度区和背景区光照剂量,减轻光致退色和光线损伤。将光照剂量空间分布和各像素点检出信号进行合成,获得最终图像。为实现上述目标,在传统成像系统中增加了声光调节器(AOM)和反馈回路(Feedback electronics),如(图4 (b)所示。声光调节器用于实现像素保持时间内激励光束的开启和关闭,反馈回路根据检出信号控制声光调节器开启和关闭时间,并由检出信号和激励光强分布合成最终图像。
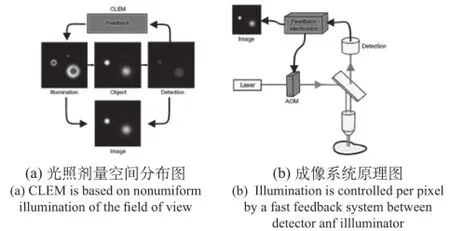
图 4 闭环的方法减小光损害Fig.4 Concept and Implementation of CLEM
当然,对于某些具有非中心对称结构的细胞或组织,如胶原蛋白、细胞外间质的筋膜和眼角膜等,可以利用双光子结合二次谐波成像技术(SHG)实现成像(原理如图 1)。二次谐波技术和双光子显微镜在装置上具有通用性,SHG信号收集不受前向发射性质的限制,可以背向收集信号, 因此很容易与双光子显微成像联合使用,进行成像比较,实现信号互补。SHG除了具有双光子荧光成像的优点外,还具有独特的一系列成像优势,二次谐波成像过程中不需要荧光染色,没有能量吸收,从根本上消除了对样品的光致毒和光损伤[24-25]。
2.2 提高成像灵敏度
成像灵敏度决定着最终成像的质量。更高的成像灵敏度决定着微弱荧光的检测和成像,实现更小的单细胞细节成像,从而获取更多的生物信息。当然,双光子显微技术比以往的荧光技术具有更高的灵敏度,但是也需要在此基础上进一步提高。
在双光子显微技术的基础上,利用入射光发生全内反射时产生的隐失波来激发样品中的荧光分子,实现宽场、非扫描全内反射双光子成像,可以提高成像的灵敏度。由于隐失波属于近场波,其传播距离仅为200 nm左右,深层区域的荧光分子不被激发,荧光检测背景大为降低,因而利用这种方法得到的图像信噪比和灵敏度均大为提高,在活细胞研究中可达到单个生物大分子水平。在既解决了双光子荧光显微镜低信噪比问题的同时,又保留了可以实时动态成像的特点,在单个活细胞分析及活细胞内生物单分子研究中具有独特优势。近年逐渐成熟的双光子全内反射技术,更是将这些优点发挥到了极致[26-28]。
生物学家通过新的荧光染料的设计[29][30],借助荧光分子的特性进行成像,提高成像的灵敏度。荧光共振能量转移[31-32]法,是指两个携带不同荧光基团的大分子之间,或同一分子的不同荧光团之间,通过电偶极相互作用所发生的非辐射能量转移,提供能量和接受能量的分子或者荧光团分别称为供体(donor,D)和受体(acceptor,A)。直观的表现是当供体荧光分子和受体荧光分子相互靠近到合适距离时,若激发供体分子,其发荧光的几率比其单独存在时要小得多,而受体分子发荧光的几率却大大提高,从而大大提高成像灵敏度。另外,荧光寿命成像,可通过测定单分子荧光的寿命来研究其所处细胞微环境或与其它分子的相互作用。荧光关联谱技术,可通过检测分子的扩散系数、化学反应速率等动力学参量来研究生物单分子的扩散、聚集和翻转等过程。光漂白后荧光恢复技术,可通过检测进入特定光漂白区域的未漂白荧光分子来研究生物单分子的扩散、转移或透膜等运动过程。光漂白中的荧光损失,可通过检测邻近重复光漂白区的特定区域内荧光的减少或消失来研究细胞膜或细胞内生物单分子的运动等。这些新技术有其独特的应用背景,都可提高成像的灵敏度。
同时,CCD的灵敏度也关系到成像灵敏度。CCD制冷技术有利于减小暗电流,提高信噪比,提高CCD的灵敏度。现在出现了可见光范围量子效率达45%以上和增益可达106的ICCD器件(像增强型电荷耦合器件),大大提高系统的灵敏度。
2.3 提高数据获取速度
数据获取速度是另外一项关键技术,特别是在对于多种荧光团同时成像或通过成像对于某种探针含量测量时。成像过程越短,光致漂白小,光毒性越小,则测量结果越准确,成像效果越好[22]。 激光器与滤镜切换或单光器输出会减慢数据获取速度。由于通过光纤传输,所以基于单色光的系统有利于加快激励波长的切换,提高系统的数据获取速度,但是会减小光照密度。滤光轮结构可以提高荧光产量,但是会减慢切换速度,从而降低数据获取速度。一般来说,对于小样本区域成像,常规共聚焦扫描激光显微镜的获取速度已经足够,但是对于某些化学物质活性成像,例如神经网络的活动,则需要借助光纤共振扫描探头进行扫描[33]。
对于CCD传感器,成像是对于整个视场一次成像,而扫描过程则是一个像素接着一个像素,所以另外对于数据获取速度的重要考虑是多焦点成像。此即是将激励光分成几份,同时激发样本,而通过CCD同时获取数据。尼普科夫圆盘共聚焦显微镜就是利用这个原理,可以实现每秒360帧成像速度[22]。CCD系统的读出速度也是非常关键的,根据每次成像特点,更好的光电匹配设计是必须的。
3 结论
自从早期生物学家借助光学显微技术研究细胞结构,当传统的光学显微镜不能满足人们的研究需要时,非线性光学显微镜以其独特的成像优势走上历史舞台。近年随着荧光标记技术的出现,fs(飞秒)激光器的发展,先进共聚焦激光扫描显微镜的发展,使借助双光子显微技术实现单细胞活体观察成为可能。但是,没有某种成像技术可以满足所有的要求,所以需要科学家的共同努力。首先,快速发展的活细胞显微成像需要提供新的荧光探针,以便于我们研究大量各式各样的蛋白质;需要提高显微系统和成像软件的性能,以便提高成像的质量; 技术上横向与其他成像技术结合发展,纵向朝更高性能方面提升,进行更细致、更精确的成像和处理。各种先进的商业显微镜,使很多非专业人员可以很容易使用双光子显微镜进行科学研究。但是,还需要在提高样本生存能力、提高数据获取速度及提高系统灵敏度三个方面进一步研究。一些新技术[22],例如自适应计算光学广泛用于天文学方面,可以用于厚样本荧光成像的缩进量校正;类似于原子显微镜的近场扫描显微镜可以和荧光技术相结合,用于样本表面成像,大大提高光学分辨率。同时,一些制药和生物技术公司需要大规模细胞内部细节自动分析和动态控制,这也为双光子显微技术提供了机会,大大扩展了双光子荧光成像技术的应用。可以预见,双光子显微成像技术必将得到更大的发展,并且必将给生物技术和生命科学带来一场强有力的革命。
[1] W. Denk, J. H. Strieker, W. W. Webb. Two-photon Laser Scanning Fluorescence Microscopy[J]. Science, 1990, 248: 73-76.
[2] F. Helmchen, W. Denk. Deep tissue two-photon microscopy[J]. Nature Methods, 2005, 2: 932-940.
[3] R. N. Germai, M. J. Miller, M. L. Dustin, et al. Dynamic imaging of the immune system: Progress, Pitfalls and Promise [J]. Nature Reviews. Immunology. 2006, 6: 497-507.
[4] Vasilis Ntziachristos, Ching-Hsuan Tung, et al. Fluorescence molecular tomography resolves protease activity in vivo [J]. Nature Medicine. 2002, 8(7):757-760.
[5] Yaron Shav-Tal, Robert H. Singer, Xavier Darzacq. Imaging gene expression in single Living cells [J]. Nature Reviews. Molecular Cell Biology. 2004, 5: 856-862.
[6] D. M. McDonald, P. L. Choyke. Imaging of angiogenesis: from microscope to clinic [J]. Nature Medicine. 2003, 9(6): 713-725
[7] M. N. Teruel, W. Chen, A. Persechini, et al. Differential codes for free Ca2+Calmodulin Signals in Nucleus and Cytosol [J]. Curr Biol. 2000, 10: 86-94.
[8] A. Takahashi, O. P. Camach, J. D. Lechleiter, et al. Measurement of Intracellular Calcium [J]. Physiol Rev, 1999, 79: 1089-1125.
[9] 于力方, 廖杰, 张国庆. 荧光显微数字成像系统对神经元内游离钙的动态测量[J]. 中国激光医学杂志. 2005,14(3): 154-156.
[10] Richard Wingate, Marius Kwint. Imagining the brain cell: the neuron in visual culture [J]. Nature Reviews. Neuroscience. 2006, 7: 745-752.
[11] M. Oheim, E. Beaurepaire, E. Chaigneau, et al. Two-photon microscopy in brain tissue: parameters influencing the imagingdepth [J]. Journal of Neuroscience Methods, 2001, 111: 29-37.
[12] Z. F. Mainen, S. M. Maletic, S. H. Shi, et al. Two-photon imaging in living brain slices. methods, 1999, 18(2): 231-239.
[13] J. Eilers, A. Konnerth. Dendritic signal integration. curr opin Neurobiol, 1997, 7(3): 385.
[14] B. R. Masters, P. T. So, E. Gratton, et al. Multiphoton excitation microscopy of in vivo human skin. Ann NY Acad Sci. 1998, 838: 58.
[15] Qianru Yu, A. A. Heikal. Two-photon autofluorescence dynamics imaging reveals sensitivity of intracellular nadh concentration and conformation to cell physiology at the single-celllevel [J]. Journal of Photochemistry and Photobiology B: Biology, 2009, 95:46-57.
[16] M. Oheim, D. J. Michael, M. Geisbauer, et al. Principles of twophoton excitation fluorescence microscopy and other nonlinear imaging approaches [J]. Advanced Drug Delivery Reviews, 2006, 58:788-808.
[17] A. Diaspro, M. Robello. Two-photon excitation of fluorescence for three-dimensional optical imaging of biological structures [J]. Journal of Photochemistry and Photobiology B: Biology, 2000, 55(1): 1-8.
[18] G. E. Stutzmann, I. Parker. Dynamic multiphoton imaging: a live view from cells to systems [J]. Physiology, 2005, 20(2):15-21.
[19] V. Nikolenko, B. Nemet, and R. Yuste. A two-photon and secondharmonic microscope [J]. Methods, 2003, 30: 3-15.
[20] S. M. Potter. Vital Imaging: Two photons are better than one. current biol, 1996, 6: 1596-1598.
[21] Alexander Hopt, Erwin Neher. Highly nonlinear photodamage in two-photon fluorescence microscopy[J]. Biophysical Journal, 2001, 80(4): 2029-2036
[22] D. J. Stephens, V. J. Allan. Light microscopy techniques for live cell imaging [J]. Science, 2003, 300(5616): 82-87.
[23] R. A. Hoebe, C. H. Van Oven, T. W. J. Gadella Jr, et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology, 2007, 25(2): 249-253
[24] P. J. Campagnola, H. A. Clark, W. A. Mohler. Second-harmonic imaging microscopy of living Cells [J]. Journal of Biomedical Optics, 2001, 6(3): 277-286.
[25] P. J. Campagnola, L. M Loew. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms [J]. Nature Biotechnology, 2003, 21(11): 1356-1360.
[26] 王琛, 王桂英, 徐至展. 全内反射荧光显微术[J]. 物理学进展, 2002. 22(4): 406-415.
[27] F. Schapper, J. T. Gonslves, M. Oheim. Fluorescence imaging with two-photon evanescent wave excitation [J]. European Biophysics Journal, 2003, 32: 635-643.
[28] I. Gryczynski, Z. Gryczynski, J. R. Lakowicz. Two-photon excitation by the evanescent wave from total internal reflection [J]. Analytical Biochemistry, 1997, 247: 69-76.
[29] Haibo Xiao, Hui Li, Minjuan Chen, et al. A water-soluble D-π-A chromophore based on dipicolinic acid: synthesis, ph-dependent spectral properties and two-photon fluorescence cell imaging[J]. Dyes and Pigments, 2009, 83: 334-338.
[30] Kim O-K, Lee K-S, Woo HY, et al. New class of two-photonabsorbing chromophores based on dithienothiophene[J]. Chem Mater, 2000, 12: 284-286.
[31] 林丹樱. 单个活细胞多功能高灵敏实时荧光显微成像研究[D].清华大学博士学位论文, 2008.
[32] K. Kikuchi. Small molecule-based FRET sensors which enable ratiometric imaging of living cells [J]. Bioimages, 2004, 12(2-4): 55-60
[33] R. Salomé, Y. Kremer, S. Dieudonné, et al. Ultrafast random-access scanning in two-photon microscopy[J]. Journal of Neuroscience Methods, 2006, 154: 161-174.
Advances in Two-photon Imaging Technology
【 Writers 】
Xia Weiqiang1, ZhouYuan2, Shi1 Ming2
1 School of Instrumentation Science and Optoelectronics Engineering, Beijing University of Aeronautics and Astronautics, Beijing, 100191, China
2 Hebei Chengde Experiment Middle School, Chengde, Hebei, 167101, China
【 Abstract 】As a new kind of advanced nonlinear imaging approach, two-photon fluorescence microscopy technology is wildly used in the field of live cell and tissue imaging,especially focusing on long-term dynamic three-dimensional cell imaging. This paper firstly presents the principle and characteristic of two-photon fluorescence microscopy. Then, the paper focuses on the three key aspects of the viability of the specimen, sensitivity of detection, as well as the speed of acquisition. In the end, the future prospect of development and application of two-phonon imaging technology are predicted
two-photon imaging, total Internal reflection imaging, live cell imaging, 3-D cell imaging, photo bleaching
Q693
A
10.3969/j.issn.1671-7104.2011.03.011
1671-7104(2011)03-0204-05
2011-1-17
周源,E-mail:zhouyuanlulu@haotmail.com
