抗稻瘟病几丁质酶产生菌的筛选及产酶条件的研究
2011-03-16唐勇军卢向阳
唐勇军,卢向阳,邹 俊,田 云
(1.湖南工程学院化学化工学院,湘潭 411104;2.湖南农业大学生化与发酵工程室,长沙 410128;)
抗稻瘟病几丁质酶产生菌的筛选及产酶条件的研究
唐勇军2,卢向阳1,邹 俊2,田 云1
(1.湖南工程学院化学化工学院,湘潭 411104;2.湖南农业大学生化与发酵工程室,长沙 410128;)
稻瘟病具有传染快、危害大等特点,其微生物防治具有良好的发展前景.本实验采用以稻瘟病细胞壁为筛选培养基来筛选抗稻瘟病的几丁质酶产生菌,并对筛选到的优良菌株进行产酶条件优化.实验结果表明,从不同来源的土壤和植物器官中分离得到16株能检测到几丁质酶活性的几丁质酶产生菌,其中以H3和H9的产酶能力最强,具有良好的开发价值.
几丁质酶产生菌;筛选;产酶条件;稻瘟病
稻瘟病是水稻三大病害之一,被称为水稻"癌症",有传染快、危害大及防治难的特点,可以引起水稻大幅减产,严重时可以达到40%~50%,甚至绝收.虽然部分化学农药对稻瘟病的防治有一定的效果,但是由于环境污染严重不宜过量施用,而且化学农药容易引起病菌的抗药性而导致病菌失控,因此生物农药和生物防治是未来发展的主要方向.几丁质(chitin),也称为甲壳素、甲壳质等.它在自然界中分布广泛,储量非常丰富.几丁质酶(chitinase,EC3.4.1.14)可催化水解几丁质的β-1,4糖苷键生成几丁聚糖和几丁寡糖[1].由于许多的病原微生物和有害昆虫体内含有几丁质,因此几丁质酶作为几丁质的降解酶,它在植物病虫害防治,尤其在真菌病害的防治中有很重要的应用价值.研究证明,几丁质的降解产物-几丁寡糖能诱导启动植物的防御系统,刺激植物生长发育[2].几丁质酶产生菌是一类能够利用几丁质为碳源而生长的微生物,其共同特征就是能够分泌几丁质酶,并通过这些酶的作用将几丁质降解为几丁质寡糖和几丁质单糖[3].自从Benecke首次报道分离到几丁质酶产生菌以来,发现在微生物中很多细菌、放线菌、真菌、酵母及某些病毒能够产生几丁质酶.尽管国内研究工作者在几丁质酶产生菌筛选方面做了大量工作,但以稻瘟病细胞壁为筛选基质来筛选抗稻瘟病几丁质酶产生菌方面的文献尚未见报道.本实验利用改良的筛选方法从自然界中分离筛选得到了两种产几丁质酶和降解稻瘟病细胞壁能力较强的几丁质酶产生菌,并对这两株菌株进行了产酶条件的研究.
1 实验部分
1.1 细粉几丁质的制备
把条状几丁质置在烘箱中80℃下烘烤2d,用粉碎机粉碎再过60目筛.
1.2 胶体几丁质的制备
参照中国科学院上海植物生理研究所和上海市植物生理学会主编的《现代植物生理学实验指南》[4].
1.3 稻瘟病病原菌细胞壁悬浮物制备及菌株筛选
用PDA培养基培养稻瘟病病原菌,20℃振荡培养3~4天后收集菌体,将菌块剪碎,加液氮冷冻后充分碾磨,破碎细胞,然后用水洗去细胞内容物制成细胞壁悬浮物[5].
1.4 几丁质酶活性测定
取在产酶培养基中培养3d后的培养液,在2500×g下离心 15 min.取上清夜 1 mL,加入 0.1 mol/L,pH7.0的磷酸缓冲液(含1%胶体几丁质)1 mL,在 37 ℃下保温1小时,加DNS试剂2 mL,在沸水浴中保温10 min.冷至室温后,在1500×g下离心8 min.在OD530比色,计算NAG的量.
酶活力定义:在上述条件下,每小时释放1000 μ g NAG的酶量为一个酶活力单位[6].
1.5 菌种最适产酶条件的研究方法
以分离培养基为基础培养基,在不同的培养时间、培养温度、培养pH、培养氮源、培养碳源条件下摇床培养H3和H9菌株,检测几丁质酶活性[8].
2 结果与分析
2.1 几丁质酶产生菌菌种的筛选
将各种土壤(棉田土、稻田土、桔园土、菜园土、池塘底泥、水产养殖场的泥土等)和植物器官(根、茎、叶)中样品,在以几丁质为唯一碳源的分离培养基中培养.得到16个能在上述分离培养基中生长的菌株.编号分别为H1-H16.将 H1-H16菌株继续培养,根据产生透明圈的大小选出7个较好的菌株,分别为 H2、H3、H5 、H7、H9、H12 、H13.其中 ,图1所示为H3菌株和H9菌株在平板培养基上的生长情况.
上述7个菌株都能在以含有稻瘟病病原菌细胞壁成分的培养基上生长,均能检测得到几丁质酶活性(见图2),其中菌株 H3和 H9的酶活性最高,分别是3.4 U/mL和2.9 U/mL.
2.2 菌落形态观察
2.2.1 H3菌落的观察
培养1d后,观察生长的单个菌落,菌落形态为不规则形、呈灰白色、不透明、表面光滑、湿润,菌落边缘整齐且不易刮下(见图1).


2.2.2 H9菌落的观察
如图1所示,H9菌株的菌落直径约为0.5~0.8cm,呈轮状同心圆形,菌落突出,较干燥,且容易刮落.菌株培养早期菌落呈淡红色,后转呈淡青色.光学显微镜下观察发现,H9菌丝为轮枝状,无隔核,无色.顶端有孢子囊,孢子囊呈球状.培养4天后,有大量孢子产生.初步认为H9菌株可能是青霉菌.
2.3 菌种产酶条件的研究
2.3.1 最适培养时间

图3 菌株产酶活力时间进程曲线
取在LB培养基中培养2d的H3菌株和H9菌株种子培养液按2%接种量接入液体的分离培养基中,25℃,120 r/min下震荡培养.从36 h开始,每隔12 h检测一次几丁质酶活力.结果如图3所示,H3菌株从60 h开始产酶活力增长加快,到72 h时达到最高值.72 h后酶活性逐渐下降.这可能是随着时间的延长,培养液中产生大量芽孢,营养体生成减少,导致产酶能力下降.H9菌株酶活力增长比较平缓,至84 h时酶活力达到最高,之后缓慢下降.
2.3.2 最适温度条件
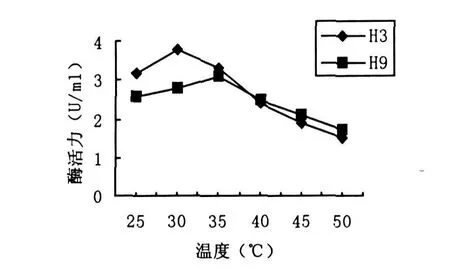
图4 温度对菌株产酶活力的影响
取在LB培养液中培养2d的H3和H9菌株种子培养液,按2%接种量接入分离培养基中,分别在不同的温度(25℃,30℃,35℃,40℃,45℃,50℃)下培养72 h和84 h,检测酶活.结果如图4所示,H3菌株在30℃时酶活力最高,达到3.82 U/mL.H9菌株在35℃时达到最佳产酶水平,酶活力为3.08 U/mL.
2.3.3 最适pH
将产酶培养基调至不同的pH,H3菌株在30℃下培养72 h,H9菌株在35℃下培养84 h,测得几丁质酶酶活性如图5所示.H3菌株在pH6.5之前几丁质酶酶活力增长平缓,pH6.5以后酶活力显著增长,在pH7.2时酶活力最高,达3.9 U/mL.H9菌株在pH6.9左右到达最高值.H3和H9最适pH均接近中性,按邱立友方法分类[9],它们分泌的几丁质酶均属于中性几丁质酶.
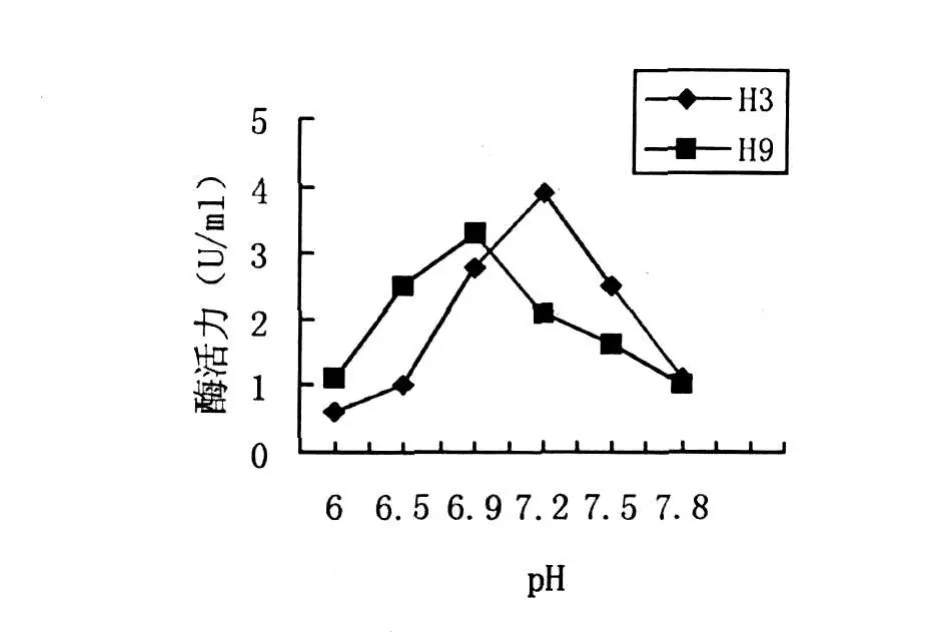
图5 pH对菌株产酶活力的影响
2.3.4 最适氮源

图6 氮源对菌株产酶活力的影响
以细粉几丁质为唯一碳源,分别在产酶培养基中添加酵母粉、蛋白胨、牛肉膏、硫酸铵和硝酸铵为氮源,H3菌株在30℃、pH7.2下培养72 h,H9菌株在35℃、pH6.9下培养84 h.发现酵母膏和蛋白胨等有机氮源是H3比较适合的氮源,其中以酵母粉为最佳(图6).在以酵母粉为氮源的处理中,几丁质酶活性比两种无机氮源的处理提高近一倍.同样H9也是在有机氮源时达到较理想的产酶水平.这可能是因为几丁质酶产生菌大都是寄生在含有几丁质的一些有机物上面,通过降解有机物而生存,因此能更好的利用有机氮源.
2.3.5 最适碳源
以酵母粉为氮源,用不同的碳源(细粉几丁质、胶体几丁质、葡萄糖、淀粉、蔗糖)进行产酶实验,H3菌株在30℃、pH7.2下培养72 h,H9菌株在35℃、pH6.9下培养84 h.从图7可以看出,细粉几丁质和胶体几丁质能明显的提高H3和H9的产酶活力,说明H3和H9产生的几丁质酶是一种底物诱导酶,而细粉几丁质诱导作用稍优于胶体几丁质.
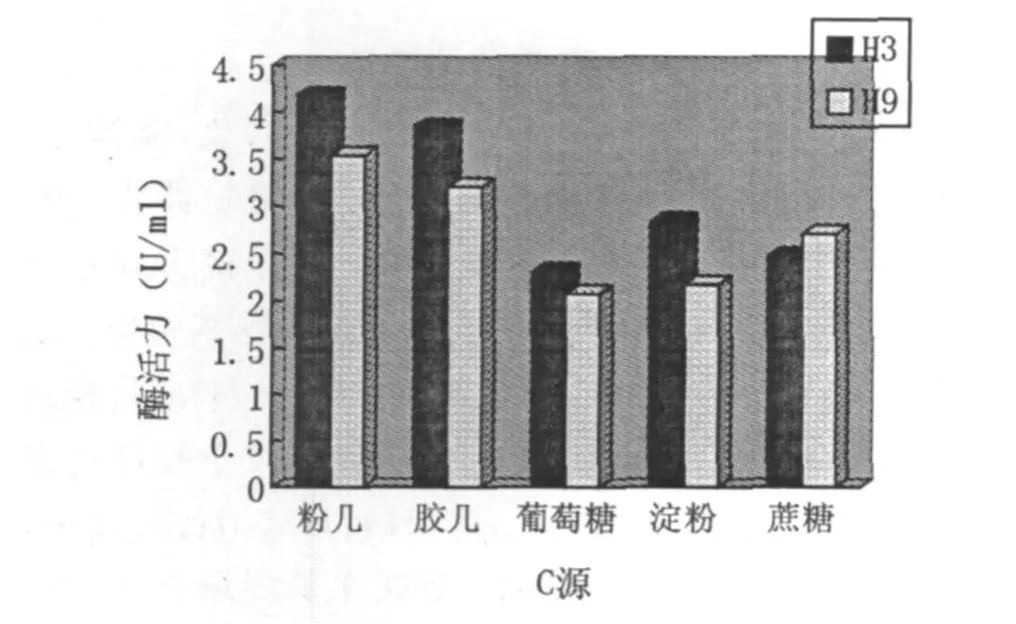
图7 碳源对菌株产酶活力的影响
3 讨 论
几丁质是最主要的天然聚合物之一,它广泛存在于自然界中,它也是多种微生物生长的有效碳源.本试验通过以几丁质为唯一碳源的培养基筛选产几丁质酶的菌株,发现在自然界中存在许多能以几丁质为碳源而生长的微生物.邱立友等[9]从黄淮地区的部分土壤中检测到大量的几丁质酶产生菌,但自然筛选出的菌株只有少数产酶活力较高.所以说要选择出产几丁质酶活力强的优良菌株,必须经过长期的不懈努力去自然界中筛选,并应对筛选的菌种进行人工诱变,以选育出产酶活性更高的菌株.本实验室从长沙地区的一些土壤和植物器官中筛选出16株几丁质酶产生菌.其中H3菌株和H9菌株具有较高的产酶活力.微生物产生的酶有组成型和诱导型之分.许多研究资料表明,一些大分子物质,对微生物具有诱导作用,诱导微生物产生相应的酶来降解它们.本实验分离得到的两株几丁质酶产生菌在细粉几丁质和胶体几丁质诱导下能产生较高活性的几丁质酶,而以其它物质为碳源时,几丁质酶活性大大降低.因此可以推断,H3菌株和H9菌株是诱导型的几丁质酶产生菌,这一研究结果与国内外报道的许多研究结果一致,具有良好的研究价值.成功获得优良菌株只是第一步,尽管实验证明了这两株菌株具有良好的产酶表现,接下来还需要进一步对菌株改良、鉴定、以及基因分析,并对其抗稻瘟病特性进行鉴定,以获得能在实践中应用的产品.
[1]陈三凤,李季伦.几丁质酶研究历史和发展前景[J].微生物学通报,1993,20(3):156-160.
[2]HR Schlaman,AA Gisel,NE Quaedvlieg,et al.Chitin oligosaccharides Can Induce Cortical Cell division in Ro-ots of Vicia sativa when delivered by ballistic microtargeting[J].Development,1997,124:4887-4895.
[3]郑志成,周美英,姚丙新.海洋链霉菌几丁质酶的研究[J].厦门大学学报(自然科学版),1992,31(5):543-547.
[4]中国科学院上海植物研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999.
[5]王焰玲,秦 敏.抑制稻瘟病菌生长的几丁酶产生菌的分离和鉴定[J].植物保护学报,1998,25(4):289-294.
[6]Ace M.Baty III,Callie C,et al.Differentiation of Chitinase-Active and Non-Chitinase-Active Subpopulations of a Marine Bacterium during Chitin Degradation[J].Appl.Envir.Microbiol.,2000,66:3566(8)-3573.
[7]李 力,黄胜元,关 雄.产几丁质酶的苏云金杆菌菌株筛选及酶合成条件研究[J].中国病毒学(杀虫微生物专刊),2000,15:94-97.
[8]谢慧敏,张红缨.长白山天池中一株产海藻糖菌种的鉴定[J].吉林大学自然科学学报,1999,(3):77-80.
[9]邱立友,贾新成,朱义彬,等.黄淮地区部分土壤中几丁质降解微生物及土壤几丁质酶活性[J].土壤肥料,1994,(6):37-39.
Studies on Screening and Enzyme-producing Conditions of Chitinase-producing Strain of Anti-rice Blast
TANG Yong-jun2,LU Xiang-yang1,ZOU Jun2,TIAN Yun1
(1.College of Chemistry and Chemical Eng.,Hunan Institute of Engineering,Xiangtan 411104,China;2.Lab of Biochemistry&Fermentation Engineering,Hunan Agricultural University,Changsha 410128,China)
Rice blast has the characteristics of fast infection and great harm,and it's microbial control has good prospects.Chitinase producing strains are screened by selective medium which contains rice blast walls.The premium fermentation is selected by optimization experiment.The results show that sixteen chitinase producing strains are screened from soil and plant organs which can detect chitinase activity.H3 and H9 have stronger ability of producing chitinase in all of this strains,and therefore have good value of research and application prospect in the future.
chitinase producing strains;screening;enzyme-producing conditions;rice blast
Q939.9
A
1671-119X(2011)01-0074-04
2010-09-06
湖南省教育厅科研资助项目(06C239)
唐勇军(1976-),男,硕士,讲师,研究方向:天然产物开发.
卢向阳(1962-),男,教授,博士生导师,研究方向:农业生物技术.
