高糖饮食导致大鼠肝脏脂代谢紊乱实验研究
2011-03-06卢贤荣程万里
卢贤荣 程万里
高糖饮食导致大鼠肝脏脂代谢紊乱实验研究
卢贤荣 程万里
目的探讨高糖饮食对大鼠肝脏过氧化物酶体脂肪酸β-氧化的影响。方法 用高糖饮食饲养大鼠24周,观察体重,血清总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(FFA),肝脏过氧化氢酶、脂酰CoA氧化酶和过氧化物酶体脂肪酸β-氧化活性的变化。结果 试验组TG、TC、FFA与对照组相比有不同程度升高(P<0.01)。试验组大鼠肝脏的过氧化氢酶、过氧化物酶体脂肪酸β-氧化、脂酰CoA氧化酶活性较正常对照组明显升高(P<0.05)。结论 高糖饮食长期摄入可导致大鼠脂质代谢紊乱,肝脏中的过氧化氢酶、脂酰CoA氧化酶和过氧化物酶体脂肪酸β-氧化的活性升高。
糖;过氧化物酶体;脂肪酸β-氧化
碳水化合物(糖)是人和动物生命活动的重要能量来源。除此之外,体内合成脂肪的脂肪酸和甘油也主要是由糖代谢而来。真核生物体内完成脂肪酸β-氧化的器官有线粒体和过氧化物酶体。线粒体中脂肪酸β-氧化的情况已经比较明确。随着研究的不断深入,过氧化物酶体脂肪酸β-氧化在脂代谢中的作用渐受重视。我们前期的研究表明,链脲佐菌素诱导的糖尿病大鼠出现脂代谢紊乱的同时,过氧化物酶体脂肪酸β-氧化增强,过氧化氢酶、脂酰CoA氧化酶活性升高[1]。有关食物对过氧化物酶体脂肪酸β-氧化的影响,以往报道多着重于短期饮食中添加某种特定类型脂肪酸的研究,而长期高糖饮食对过氧化物酶体脂肪酸β-氧化的影响研究甚少。本研究旨在观察高糖饮食对老年大鼠机体代谢的影响,重点是其肝脏过氧化物酶体脂肪酸β-氧化及参与此途径的多种酶活性的影响。
1 材料与方法
1.1 主要仪器与试剂 H-7500透射电镜,BeckmanDU640蛋白核酸分析仪(美国产),日立UV-330紫外-可见分光光度仪、JA3003精密天平(日本产),RBP-1B鼠尾血压测定仪(北京产),760-紫外可见光分光光度仪、Advantage血糖仪、BeckmanX20全自动生化分析仪、930-荧光分光光度仪(上海产),WZS-50F双通道微量注射泵(浙江产)。棕榈酰CoA、辅酶A、黄素酰嘌呤二核苷酸、7-羟基-6-甲氧基香豆素、牛血清白蛋白(BSA)(美国Sigma公司);菸酰胺酰嘌呤二核苷酸(Biomol公司);过氧化物酶(Biozyme公司);盐酸苯甲脒、苯甲基磺酰氟(Amresco公司)。
1.2 动物模型与取材
1.2.1 动物模型:清洁级近交系雄性Wistar大鼠20只,5月龄,体重250~300 g(购于河北医科大学实验动物中心)。基础饲料喂养1周,随机分为正常对照组(NC组)、高糖组(HS),每组10只,各用相应饲料喂养。自由摄食、饮水,室温18~24℃,相对湿度40% ~70%,每日12 h光照维持,昼夜循环。基础饲料中碳水化合物、脂肪及蛋白质热量各占65.5%、10.3%及24.2%;高糖饲料是在基础饲料中添加20%蔗糖使碳水化合物热卡占76.5%,脂肪热卡占7%,蛋白质热卡占16.5%。饲料由河北医科大学实验动物中心配制。
1.2.2 标本采集:24周后,空腹10%水合氯醛麻醉,心脏采血,用于生化指标的测定,剪取部分肝脏迅速放入4%戊二醛中,15 min内切成1×1×1 mm3组织块固定,透射电镜观察;另取肝脏,在冰浴中匀浆,离心后取上清,用于过氧化氢酶、过氧化物酶体脂酰CoA氧化酶、过氧化物酶体脂肪酸β-氧化活性的分析测定。
1.3 血浆生化指标及肝组织酶活性的测定 血清总胆固醇(TC)和三酰甘油(TG)用氧化酶法,采用Beckman X20全自动生化分析仪测定;用铜显色法测定血清游离脂肪酸(FFA)含量;过氧化氢酶的测定参考文献[2];过氧化物酶体脂肪酸β-氧化的测定参考文献[3];过氧化物酶体脂酰CoA氧化酶的测定参考文献[4];蛋白含量测定参考文献[5]。
1.4统计学分析应用SPSS 10.0统计软件,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.12组基础指标比较 体重(BW)的变化:在24周时HS组大鼠BW增加,但差异无统计学意义(P>0.05)。血脂的变化:HS组TC和TG在24周时较NC组显著升高(P<0.01);FFA的变化:12及24周时,HS组FFA水平较NC组明显升高(P <0.05)。见表1。2.2 肝脏中脂肪酸β-氧化中各酶活性的变化 HS组过氧化氢酶、过氧化物酶体脂酰CoA氧化酶、过氧化物酶体脂肪酸β-氧化活性分别在24周时较NC组明显升高(P<0.05)。见表2。
表1 2组大鼠以不同饮食喂养后各阶段血清生化资料变化比较n=10,±s
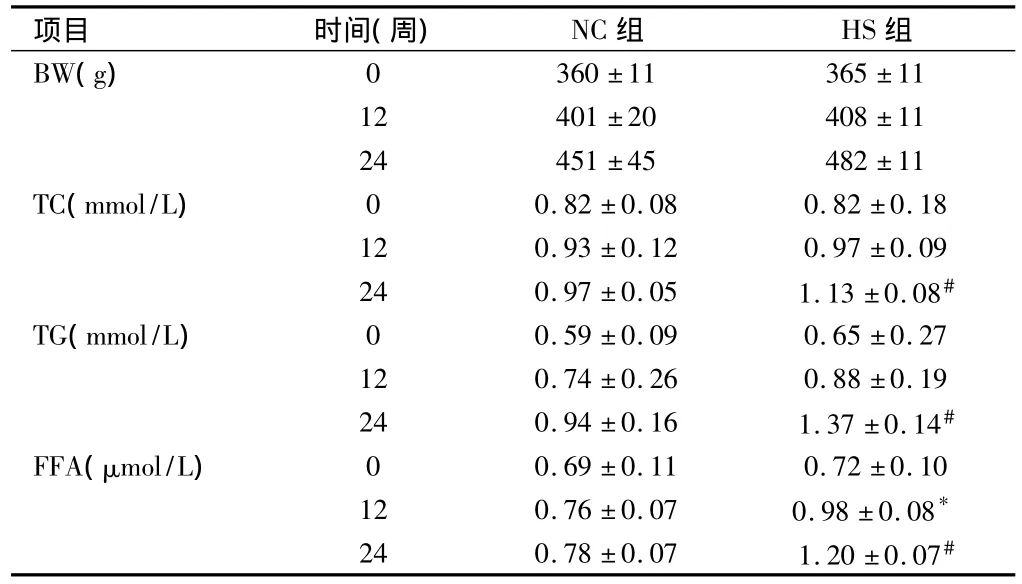
表1 2组大鼠以不同饮食喂养后各阶段血清生化资料变化比较n=10,±s
注:与NC组比较,*P <0.05,#P <0.01
项目 时间(周) NC组 HS组BW(g)360±11 365±11 12 401±20 408±11 24 451±45 482±11 TC(mmol/L) 0 0.82±0.08 0.82±0.18 12 0.93±0.12 0.97±0.09 24 0.97±0.05 1.13±0.08#TG(mmol/L) 0 0.59±0.09 0.65±0.27 12 0.74±0.26 0.88±0.19 24 0.94±0.16 1.37±0.14#FFA(μmol/L) 0 0.69±0.11 0.72±0.10 12 0.76±0.07 0.98±0.08*24 0.78±0.07 1.20±0.07 0#
表2 2组大鼠24周时肝脏中过氧化物酶体脂肪酸β-氧化的相关酶活性的变化n=10,±s

表2 2组大鼠24周时肝脏中过氧化物酶体脂肪酸β-氧化的相关酶活性的变化n=10,±s
*P <0.05#P <0.01注:与NC组比较,,
项目 HS组 NC组过氧化氢酶(U/mg) 407.00±38.72*274.17±35.45过氧化物酶体脂肪酸β-氧化活性(mU/mg) 1.38±0.07* 0.0105±0.0009过氧化物酶体脂酰CoA氧化酶(mU/mg) 0.374±0.003#0.0170±0.0027
2.3 透射电镜所见 与NS组相比,HS组肝细胞内有数量不等的脂滴储积。
3 讨论
3.1 碳水化合物对生物体的影响 糖是人类和大多数动物食物的主要成分,提高能量是糖的主要生理功能。此外,糖还是机体重要的碳源,糖代谢的中间产物可转变成其他的含碳化合物,如脂肪酸、氨基酸等。糖也是组成机体组织结构的重要成分。体内还有一些具有特殊生理功能的糖蛋白。
糖通过有氧氧化和无氧酵解为机体提供能量,正常情况
下,体内仅有少量糖原储存,过多的糖类转化为脂肪酸,脂肪酸与甘油合成TG储藏起来。合成TG的脂肪酸及甘油主要由糖代谢提供。从我们的实验结果可以看到,饲养到12周时,高糖试验组大鼠BW、血清TC和FFA均高于对照组,到24周的,上述指标进一步升高,同时TG也有较大幅度升高,与对照组相比,有统计学意义,出现了明显的脂代谢紊乱。这说明长期大量摄入糖类会造成细胞内脂肪酸代谢平衡的破坏,出现BW、血清TC、TG和FFA升高。研究表明,肥胖,TC、TG和FAA升高是高血压、胰岛素抵抗、2型糖尿病、动脉粥样硬化等疾病的重要危险因素,最新的IDF代谢综合征的定义中中心性肥胖是必备的指标,高TG血症是重要指标之一,由此可见,由高糖饮食造成的脂代谢紊乱同高脂饮食一样严重威胁着人体健康。
3.2 高糖饮食与过氧化物酶体的脂肪酸β-氧化 过氧化物酶体脂肪酸β-氧化酶系实际上是一个缩短碳链的反应体系。饱和的长链和极长链脂肪酸、多不饱和脂肪酸、2-甲基支链脂肪酸及胆汁酸合成代谢中间产物先进入过氧化物酶体氧化成中短链脂肪酸,再转入线粒体彻底氧化分解,提供能量。此外,啮齿类动物过氧化物酶体还可被一类称为过氧化物酶体增殖剂的物质诱导增殖,过氧化物酶体β-氧化途径中的酶活性也同时被诱导增加。这种增殖是通过过氧化物酶体增殖物激活受体(PPARs)介导实现的。Ishii等[6]发现饮食中的高脂成分刺激参与过氧化物酶体脂肪酸β-氧化的酶的合成,导致过氧化物酶体脂肪酸β-氧化增强和过氧化物酶体增殖。过氧化物酶体的这种变化与PPARα高效配体氯贝特喂养的大鼠极为相似。高糖摄入导致细胞内脂肪酸增加,脂肪酸及其衍生物是PPARα的天然配体。PPARα活化后调节参与过氧化物酶体脂肪酸代谢基因的表达,导致肝脏过氧化物酶体增殖[7],脂肪酸β-氧化增加,以恢复细胞内脂肪酸的代谢平衡。这种脂肪酸氧化的增强是机体对高热量饮食的适应性反应,本试验中肝细胞电镜观察结果显示,试验组大鼠的肝细胞内有数量不等的脂滴储积,同时大体标本表现为程度不等的脂肪肝,这提示此适应性反应对于清除体内过多的脂肪来说还是不充分的。
1 李静,宋光耀,姜玲玲,等.实验性糖尿病大鼠肝过氧化物酶体脂肪酸氧化及D-双功能蛋白活性变化的初步研究.生物化学与生物物理进展,2004,31:1024-1029.
2 Aebi H.Catalase.In:Bergmeyer,HU ed.Method of enzymatic analysis.New York:Academic Press,1974:673.
3 Paul B,Duve de C.A fatty acyl-CoA oxidizing system in rat liver peroxisomes;enhancement by clofibrate,a hypolipidemic drug.Proc.Natl.Acad.Sci.USA,1976,73:2043-2046.
4 Walusimbi-Kisitu M,Harrisom HE.Fluorometric assay for rat liver peroxisomal fatty acyl-coenzyme a oxidase activity.Journal of Lipid Research,1983,24:1077-1084.
5 Markwell MAK,Haos SM,Bieber LL,et al.A modification of the Lowry procedure to simplify protein determination in membrane and lipoprotein samples.Anal Biochem,1978,87:206-210.
6 Ishii H,Horie S,Suga T.Physiological role of peroxisomal beta-oxidation in liver of fasted rats.Biochem.(Tokyo),Jun,1980,87:1855-1858.
7 Debeet LJ,Mannaetts GF.The mitochondrial and peroxisomal pathway of fatty acid oxidation in rat liver.Diabete Metabol,1983,9:134-140.
Experimental study of lipid metabolic disorder in the livers of rats fed with high glucose diet
LU Xianrong* ,CHENG Wanli.Shijiazhugng Mechical Insurance management centre,Shijiazhuang 050000,China
ObjectiveTo investigate the effect of high glucose diet on the activity of peroxisomal fatty acidβ-oxidation in the livers of rats.MethodsThe rats were fed with high glucose diet(experiment group)or normal diet(control group)respectively for 24 weeks.The changes of total cholesterol(TC),triglyceride(TG)and free fatty acid(FFA)were observed,and the changes of the activities of peroxisomal fatty acidβ-oxidation,hydrogen peroxidase and acyl-CoA oxidase in the livers were detected.ResultsThe levels of TC,TG,FFA in experiment group were increased at different degrees,as compared with those in control group(P <0.01).The activities of hydrogen peroxidase,peroxisomal fatty acidβ-oxidation and acyl-CoA oxidase in experiment group were significantly increased,as compared with those in control group(P <0.05).ConclusionThe long-term taking of high glucose can result in the lipid metabolic disorder in rats,as a result,the activities of hydrogen peroxidase,acyl-CoA oxidase and peroxisomal fatty acidβoxidation are increased.
glucose;peroxisome;fatty acid β-oxidation
R 587.1
A
1002-7386(2011)09-1307-02
10.3969/j.issn.1002-7386.2011.09.009
050000 河北省石家庄市医疗保险管理中心(卢贤荣);中船重工第718研究所(程万里)
2011-02-02)
·论著·
