黄芪注射液对内毒素诱导大鼠肠系膜微循环障碍改善作用的实验研究
2011-03-06杨淼刘玉玉李淑娟
杨淼 刘玉玉 李淑娟
黄芪注射液对内毒素诱导大鼠肠系膜微循环障碍改善作用的实验研究
杨淼 刘玉玉 李淑娟
目的探讨静脉给予黄芪注射液对内毒素血症肠系膜微循环障碍的改善作用。方法Wistar大鼠30只为对照组、模型组、治疗组,每组10只。采用静脉注入脂多糖(LPS)(5 mg·kg-1·h-1)复制内毒素血症模型,治疗组给予静脉注射黄芪注射液(5 ml·kg-1·h-1),用微循环观察系统每20分钟动态观察细静脉粘附白细胞,细静脉血管壁过氧化物的动态变化。在100 min观察结束后,计数肠系膜间质内肥大细胞脱颗粒率。取外周血,用流式细胞仪测定粒细胞粘附分子CD 11b和CD18的表达。结果 模型组在LPS滴注20 min后,黏附于大鼠肠系膜细静脉壁上的白细胞数和管壁过氧化物依存的DHR的荧光强度显著增加,100 min时计数肠系膜间质内肥大细胞脱颗粒率显著地增加(P<0.05)。流式细胞仪测定外周血粒细胞黏附分子CD11b和CD18的表达明显增加(P<0.05)。治疗组白细胞与肠系膜细静脉的血管壁黏附;细静脉壁过氧化物依存的DHR荧光强度的增加,肠系膜间质内肥大细胞脱颗粒率,外周血粒细胞黏附分子CD11b和CD18的表达明显受到抑制(P<0.01)。结论 黄芪注射液对内毒素血症肠系膜微循环障碍有改善作用。可能其抑制粒细胞黏附分子CD11b和CD18表达及肥大细胞脱颗粒相关。
黄芪注射液;脂多糖;微循环障碍;白细胞黏附;肥大细胞脱颗粒;黏附分子
重症感染引发的脓毒症及多脏器功能不全仍是目前ICU患者的主要死亡原因之一[1]。目前临床上对脓毒性休克的治疗措施包括抗生素的早期应用,充分的液体容量复苏,血管活性药物的应用,恰当的输血,皮质激素的应用,血糖的控制等一系列综合方案[2]。尽管如此,脓毒性休克的病死率仍为30%~50%[3,4],原因在于复苏过程中只强调全身的氧代谢及血流动力学的恢复,而忽略对微循环的复苏,事实上在脓毒症病理生理学过程中,不同时期、不同器官血流灌注程度不一,会出现区域性血流分布不均匀现象[5]。Ince[6]研究表明即使全身性的氧供恢复正常,局部组织细胞仍存在缺氧及氧摄取障碍,如果这种情况持续不缓解,将会造成线粒体的损伤,发生微循环及线粒体窘迫综合征(microcirculatory and mitochondrial distress syndrome,MMDS)。因此脓毒症的发病机制及环节非常复杂,微循环障碍是脓毒症时的重要病理生理基础,改善微循环的治疗必将对脓毒症的预后有重要影响。本实验旨在应用脂多糖(LPS)复制内毒素血症大鼠肠系膜微循环障碍模型,并应用黄芪注射液给予治疗,观察黄芪注射液对肠系膜微循环障碍的影响,并对机制进行探讨。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器:倒置生物显微镜(Nikon BCLIPSE Ti-u,Japan);CCD彩色摄像机(Nikon BCLIPSE Ti-u,Japan);监视器(J2118A,TCL,China);CD 录像机(DVR-R25,Malata,China);流式细胞仪(FACS Aria,B.D.Co,USA);时间记录器(Video Timer VTG-55B,FOR-A,Japan)。
1.1.2 试剂:LPS购于上海前尘生物有限公司(Sigma公司生产,美国),用前以0.9%氯化钠溶液溶解为10 mg/ml;黄芪注射液由哈尔滨圣泰制药股份有限公司(批号:223020822)提供,0.9%氯化钠溶液由北京双鹤药业有限公司提供(批号:20080223),抗体:FITC-标记的抗 CD18抗体,FITC-标记的抗-CD11抗体,购于BD biosciences Pharmingen(USA);溶血素:购于美科美(北京)生物医学科技中心(BD biosciences Immunocytometer Systems生产,USA);甲苯胺蓝,二氢罗达明均购于北京华美生科生物技术有限公司(Sigma Chemical Co生产,St Louis,MO,USA)。
1.2 实验动物 Wistar大鼠30只,雄性,体重320~250 g,由河北北方学院动物中心提供,实验前禁食给水12 h,以乌拉坦肌肉麻醉(1.25 g/kg)。麻醉充分后,分别经左侧颈静脉及股静脉置入3Fr静脉置管用于给药[10]。随机分为3组:正常组(n=10):0 min开始经由股静脉连续滴注0.9%氯化钠溶液(1 ml/h),20 min后经左颈静脉连续注射0.9%氯化钠溶液(5 ml·kg-1·h-1),每 20分钟动态观察微循环状态至100 min。模型组(n=10):0 min开始经由股静脉连续滴注LPS(5 mg·kg-1·h-1),20 min后经左颈静脉连续0.9%氯化钠溶液(5 ml·kg-1·h-1),每20分钟动态观察微循环状态至100 min[7]。治疗组(n=10):0 min开始经由股静脉连续滴注LPS(5 mg·kg-1·h-1),20 min后经左颈静脉连续注射黄芪注射液(5 ml·kg-1·h-1),每20分钟动观察微循环状态至100 min。
1.3 体内微循环观察方法 剪去腹部毛发沿腹部正中作2~3 cm的切口,暴露小肠。将大鼠仰卧在观察板上,轻轻提出小肠(回盲部向口侧10~15 cm),并将小肠展开放在有观察孔的观察板上,在表面连续滴加37℃ 0.9%氯化钠溶液保持温度和湿度,用配有37℃恒温装置的倒置生物显微镜进行观察。通过连接在显微镜上的CCD彩色摄像机在显示屏上观察,用CD录像机连续记录微循环的变化。在10 min基础观察结束后,开始推注药物,并将时间记录器设定为0 min,并记录图像即为初始状态,此后每隔20 min为观察点,记录血管图像至100 min[8]。
1.4 图像分析 选直径30~50 μm,长200 μm无分支、无明显弯曲的肠系膜细静脉。
1.4.1 黏附于细静脉壁白细胞数的计数:在回放的CD录像上,以停留在细静脉同一位置超过10 s的白细胞视为黏附的白细胞,分别计数给药前0~100 min,黏附于选定的大鼠肠系膜细静脉壁上的白细胞数,用黏附白细胞数(个)/200 μm细静脉表示[8]。
1.4.2 细静脉壁DHR荧光强度的测定:在所观察的大鼠肠系膜表面连续滴加感受H2O2的荧光探针DHR(10 μmol/L),检测血管壁氧化应激的反应4。用倒置荧光显微镜观察,455 nm激发光,汞灯作为发射光源(100 W)27。用CD录像机分别记录3组给药前0~100 min时的图象,用Image-Pro Plus 5.0软件测定细静脉管壁及血管外间质的荧光强度。用0 min时细静脉管壁与血管外间质的差为基础值,计算各时间点数值与0 min的比值,用以表示大鼠肠系膜细静脉管壁DHR荧光强度的变化率[8]。
1.4.3 肥大细胞脱颗粒率的计数:100 min观察结束后,将0.1%甲苯胺蓝滴加在所观察的视野1 min,用0.9%氯化钠溶液冲洗后,在×20物镜下,沿细静脉观察5个视野,计算未脱颗粒和脱颗粒的肥大细胞的百分率[8]。
1.4.4 体内外周血粒细胞黏附分子CD11b和CD18表达的测定:3组大鼠连续微循环观察结束后,腹主动脉取血,肝素抗凝(20 U/ml全血)。加入 1 μg FITC-标记的抗 CD18抗体或抗CD11b的抗体,室温避光孵育20 min。以溶血素破碎红细胞,用PBS洗涤细胞2次。流式细胞仪检测平均荧光强度。分选5 000个外周血粒细胞细胞,计算各组CD11b和CD18的平均荧光强度[9]。
1.5统计学分析应用SPSS 11.0统计软件,计量资料以±s表示,采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 黄芪注射液对黏附于大鼠肠系膜细静脉白细胞数的影响正常组在100 min观察结束时仅有少量的白细胞黏附于大鼠肠系膜细静脉。模型组在观察20 min时,黏附于大鼠肠系膜细静脉白细胞数为(5.7±1.0)个/200 μm,明显高与正常对照组。治疗组在40 min时,显著地抑制了白细胞与于大鼠肠系膜细静脉壁的黏附。见表1。
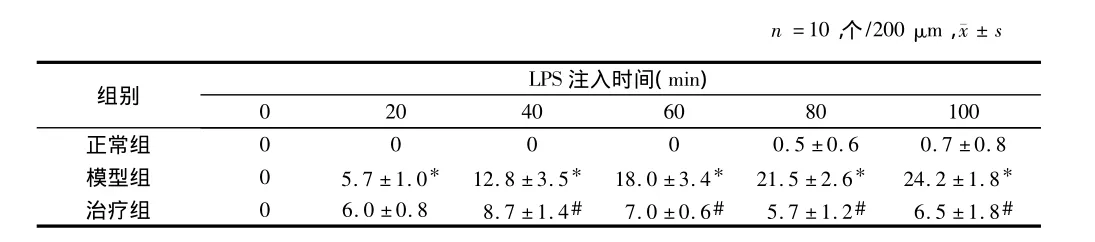
表1 黄芪注射液对黏附于大鼠肠系膜细静脉白细胞数的影响
2.2 黄芪注射液对大鼠肠系膜细静脉管壁DHR荧光强度变化的影响 正常组在100 min观察结束时,大鼠肠系膜细静脉管壁仅有小量的DHR荧光强度的增强,而模型组LPS连续滴加20 min时,大鼠肠系膜细静脉管壁DHR荧光强度显著地增强,并随着LPS连续滴加进一步增强。而治疗组大鼠在40 min时肠系膜细静脉管壁DHR荧光强度显著下降。见表2。
2.3 黄芪注射液对大鼠肠系膜间质内肥大细胞脱颗粒率的影
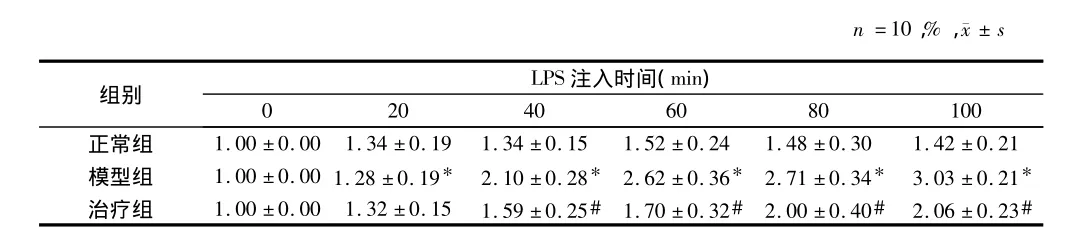
表2 黄芪注射液对大鼠肠系膜细静脉管壁DHR荧光强度变化的影响
响
正常组观察100 min结束时,大鼠肠系膜细静脉周围间质内肥大细胞脱颗粒率为(24±5)%,模型组的大鼠肠系膜细静脉周围间质内肥大细胞脱颗粒率为(51±6)%,高于正常组(P<0.05)。治疗组的大鼠肠系膜细静脉周围间质内肥大细胞脱颗粒率为(24±6)%,低于模型组(P<0.05)。见表3。
2.4 黄芪注射液对大鼠外周血粒细胞黏附分子CD18和CD11b表达的影响 正常组的外周血粒细胞黏附分子CD18和CD11b的平均荧光强度分别为(44.3±4.1)和(27.4±2.3),LPS组的外周血粒细胞黏附分子CD18和CD11b的平均荧光强度上升至(75.8±4.1)和(55.0±4.1),高于正常组(P <0.05)。见表3。

表3 黄芪注射液对大鼠大鼠外周血粒细胞黏附分子表达的影响
3 讨论
实验研究利用LPS可复制出经典的脓毒症和脓毒性休克的微循环障碍模型[10],LPS是存在于革兰氏阴性菌外膜的一类物质,是内毒素的主要成分。LPS诱导的白细胞沿细静脉壁滚动、与内皮黏附、过氧化物的产生,血管外周肥大细胞脱颗粒等是LPS引起组织损伤和多器官功能衰竭的重要环节之一[11]。黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,是临床应用广泛的中药。始载于《神龙本草经》,主要功效为补气固表、利尿脱毒、排脓、敛疮生肌,广泛应用心、脑血管疾病及糖尿病相关并发症等疾病的辅助治疗[12]。但是有关黄芪对于内毒素血症时微循环障碍的研究却罕见报道。
本研究证明了内毒素血症大鼠肠系膜微循环可观察到白细胞与肠系膜细静脉的黏附、血管壁过氧化物产生增加等变化,上述改变与时间呈线性关系,且与正常组差异有统计学意义。此外本试验还发现,在实验结束后,肥大细胞脱颗粒率、外周血粒细胞CD11b/CD18的表达表达明显增加,黄芪注射液可以显著抑制LPS引起白细胞与肠系膜细静脉的黏附、血管壁过氧化物产生、肥大细胞脱颗粒、外周血粒细胞CD11b/CD18的表达。证明了黄芪注射液对LPS引发的微循环障碍具有一定的改善作用。
内毒素血症可造成严重的脓毒症,由于脓毒症引发的低血压可导致微循环灌注的下降,后者与脏器功能不全及多脏器功能衰竭的发生有关[13],因此改善脓毒性休克时脏器微循环障碍是治疗脓毒性休克及防治多脏器功能综合征发生的关键[14]。
LPS可诱导粒细胞黏附分子CD11b/CD18的表达增强,其与配体血管内皮黏附因子-1(ICAM-1)的结合,在白细胞与内皮细胞黏附以及游出过程中起着决定性的作用[15],白细胞-内皮细胞相互作用产生的过氧化物和释放的炎性介质可以损伤血管内皮和血管基底膜,导致血浆白蛋白的漏出[16]。此外,LPS还可与肥大细胞TLR-4结合,依赖性地释放肿瘤坏死因子-α的,白介素-1β,白介素-6,干扰素等炎性因子[17],攻击血管壁,促进内皮细胞VCAM-1和E-selectin的表达[18],从而促进白细胞在血管内皮滚动和黏附。本研究证明了黄芪注射液对LPS体内诱导的白细胞-内皮细胞相互作用具有抑制作用,其机理可能与抑制细胞黏附分子CD11b/CD18的表达有关。
DHR是罗达明的前体,与H2O2等过氧化物反应后转化成可发荧光的罗达明,并结合在细胞的线立体膜上[19]。用荧光显微镜可连续地观察到DHR转化成罗达明的发光部位和荧光强度,借以判断过氧化物的动态产生[20]。本研究证明了黄芪注射液对LPS引起的大鼠肠系膜细静脉血管壁过氧化物依存性发光的DHR荧光强度有明显抑制作用。
总之,黄芪注射液可以通过抑制LPS诱导白细胞与血管壁的黏附,抑制粒细胞黏附分子CD11b/CD18的表达,抑制过氧化物的产生等多环节、多靶点改善微循环障碍,为临床治疗脓毒症提供一些新的思路。
1 Cross AS,Opal SM.A new paradigm for the treatment of sepsis:is it time to consider combination therapy.Ann Intern Med,2003,138:502-505.
2 Dellinger RP,Carlet JM,Masur H,et al.Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock.Crit Care Med,2004,32:858-873.
3 Engel C,Brunkhorst FM,Bone HG,et al.Epidemiology of sepsis in Germany:results from a national prospective multicenter study.Intensive Care Med,2007,33:606-618.
4 Harrison DA,Welch CA,Eddleston JM.The epidemiology of severe sepsis in England,Wales and Northern Ireland,1996 to 2004:secondary analysis of a high quality clinical database,the ICNARC Case Mix Programme Database.Crit Care,2006,10:R42.
5 Spronk PE,Ince C,Gardien MJ,et al.Microcircualtion in distress:A new resuscitation end point?Crit Care Med,2004,32:1963-1964.
6 Ince C.The microcirculation is the motor of sepsis.Crit Care,2005,9:S13-S19.
7 Yuan Q,Liu YY,Sun K,et al.Improving effect of pretreatment with yiqifumai on LPS-induced microcirculatory disturbance in rat mesentery.Shock,2009,32:310-316.
8 Sun K,Wang CS,Guo J,et al.Effect of Astragalus Injections on lipopolysaccharide-induced adhesion of leukocytes in rat mesenteric venules.Clin Hemorheol Microcirc,2006;34:103-108.
9 Fujita Y,Habazettl H,Corso CO,et al.Comparative effects of hypotension due to isoflurane,nitroglycerin,and adenosine on subendocardial microcirculation:observation of the in situ beating swine heart under critical stenosis.Anesthesiology,1997,87:343-353.
10 张秋金,李银平,黎檀实.肺泡上皮细胞功能特性与内毒素急性肺损伤.中国危重病急救医学,2005,17:382-384.
11 Wu X,Yoshida A,Sasano T,et al.Histamine production via mast cell-independent induction of histidine decarboxylase in response to lipopolysaccharide and interleukin-1.Int Immunopharmacol,2004,4:513-520.
12 国家药典委员会主编.中华人民共和国药典(一部).北京:化学工业出版社,2000.249-250.
13 Darley-Usmar V,Halliwell B.Blood radicals:reactive nitrogen species,reactive oxygen species,transition metal ions,and the vascular system.Pharm Res,1996,13:649-662.
14 Cutrn JC,Perrelli MG,Cavalieri B,et al.Microvascular dysfunction induced by reperfusion injury and protective effect of ischemic precondi-tioning.Free Radic Biol Med,2002,33:1200-1208.
15 原庆,张淑文,罗国燕.脓毒症引发的微循环障碍及中西药的改善作用.中国中西医结合急救杂志,2008,15:313-315.
16 Ikeda T,Funaba M.Altered function of murine mast cells in response to lipopolysaccharide and peptidoglycan.Immunol Lett,2003,88:21-26.
17 Mc Curdy JD,Lin TJ,Marshall JS.Toll-like receptor 4-mediated activation of murine mast cells.J Leukoc Biol,2001:977-984.
18 Darley-Usmar V,Halliwell B.Blood radicals:reactive nitrogen species,reactive oxygen species,transition metal ions,and the vascular system.Pharm Res,1996,13:649-662.
19 Hempel SL,Buettne GR,O'Malley YQ,et al.Dihydrofluorescein diacetate is superior for detecting intracellular oxidants:comparison with 2',7'-dichlorodihydrofluorescein diacetate,5(and 6)-carboxy-2',7'-dichlorodihydrofluorescein diacetate,and dihydrorhodamine 123.Free Rad Biol Med,1999,27:146-159.
Experimental study on the improvement effect of Astragalus injection on the endotoxin-induced mesentery
microcirculatory disturbance in rats
YANG Miao* ,LIU Yuyu,LI Shujuan.*Emergency Department,The First Hospital Affiliated to Hebei North College,Hebei,Zhangjiakou 075000,China
ObjectiveTo observe the improvement effect of Astragalus injection on the endotoxin-induced mesentery microcirculatory disturbance in rats with endotoxemia.Methods30 Wistar rats were randomly divided into control group,model group,treatment group,10 rats in each group.The endotoxemia models were established by intravenous injection with lipopolysaccharide(LPS)(5 mg·kg-1·h-1),then the rats in treatment group were given Astragalus injection intravenously(5 ml·kg-1·h-1),and the Microcirculationobservation system was used to observe the number of adherent leukocytes on minute veins and the changes of superoxide on the venular wall at an interval of 20min.After 100-minute observation,the mastocyte degranulation rate in mesenterium was calculated.The expression of CD11b and CD18 in peripheral blood was detected by flow cytometry.ResultsThe number of leukocytes adherent to venular wall,the intensity of hrdrogen peroxide(H2O2)dependent dihydrorhodamine 123(DHR)fluorescence in the venular walls were increased significantly after 20min of LPS infusion,and the mastocyte degranulation rate was increased significantly after 100min(P <0.05).The expression of CD11b/CD18 was obviously increased(P<0.05).However the parameters as mentioned above in treatment group were significantly inhibited(P<0.01).ConclusionAstragalus injection has the improvement effect on the mesentery microcirculatory disturbance in rats with endotoxemia,which may be correlated with its inhibition effect on the expression of CD11b/CD18 and the mastocyte degranulation.
Astragalus injection;lipopolysaccharide;microcirculatory disturbance;leukocyte adhesion;mastocyte degranulation;leukocyte adhesion molecules
R 255.7
A
1002-7386(2011)09-1290-04
10.3969/j.issn.1002-7386.2011.09.003
075000 河北省张家口市,河北北方学院附属第一医院急诊科(杨淼),心电图室(刘玉玉);河北北方学院药理教研室(李淑娟)
2010-12-08)
·论著·
