孕酮对缺氧缺血性脑损伤新生大鼠血脑屏障通透性及脑水肿的影响
2011-02-27李新娟李东亮
李新娟,李 爽,李东亮
(新乡医学院生理学与神经生物学教研室,河南新乡 453003)
缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是导致新生儿死亡及神经系统后遗症的主要原因,此病的治疗尚无长足进步,目前仍以综合支持治疗为主[1]。近年来研究发现孕酮(progesterone,PROG)除调节生殖功能外,还可作用于中枢神经系统[2-3]。PROG 对脑缺氧缺血的保护作用,也引起人们的极大关注[4]。本课题前期研究发现,PROG预处理可提高缺氧缺血(hypoxic-ischemic,HI)新生大鼠脑组织中超氧化物歧化酶和谷胱甘肽过氧化物酶的活性[5]。本实验通过观察PROG对HI新生大鼠血脑屏障(blood brain barrier,BBB)通透性、脑含水量和脑皮质水孔通道蛋白4(aquaporins-4,AQP4)表达的影响,来探讨PROG脑保护作用的可能机制,为更好预防与治疗新生儿HIE提供理论和实验依据。
1 材料与方法
1.1 主要试剂PROG(Sigma公司),伊文思蓝(evans blue,EB,Serva公司),兔抗鼠 AQP4 多克隆抗体、SABC免疫组化试剂盒(武汉博士德生物工程公司)。
1.2 动物分组与给药方法7 d Sprague-Dawley(SD)大鼠96只,♂♀不限,体质量11~16 g,由新乡医学院实验动物中心提供,随机分成4组:正常组、假手术组、HI组和PROG组。各组随机分为3个亚组(n=8),分别用于BBB通透性、脑含水量的测定和免疫组织化学法观察AQP4的表达。PROG组于建模型前30 min按8 mg·kg-1腹腔注射PROG芝麻油液,其余各组注射等容积芝麻油。
1.3 动物模型的制备[6]新生大鼠经乙醚麻醉后,背位固定于手术台,体积分数为0.75乙醇消毒,颈部正中切开皮肤,分离皮下肌肉,于胸锁乳突肌内侧深部分离右颈总动脉,并于近端和远端结扎右颈总动脉,在中间剪断,消毒缝合,立即将动物置于37℃,80 ml·L-1氧气和 920 ml·L-1氮气的低氧箱内2 h,而后继续母乳喂养。假手术组仅在颈部正中切开皮肤、分离右侧颈总动脉,不结扎,不予缺氧。HI后24 h作以下检测。
1.4 BBB通透性测定[7]经大鼠心腔注射20 g·L-1EB生理盐水溶液(20 mg·kg-1)1 h后,数秒钟后可见大鼠眼睛皮肤变成蓝色。1 h后,处死大鼠,迅速断头取脑,将右侧脑组织称重,加入2倍体积甲酰胺,50℃水浴中孵育72 h,取上清,用分光光度计,635 μmol·L-1处检测吸光度,绘制标准曲线。根据标准曲线计算出待测样品的EB含量,结果以每克湿重脑组织中所含EB的微克数(μg·g-1)表示。
1.5 脑含水量测定新生大鼠经乙醚麻醉后,断头取脑,分析天平称湿重后置于110℃恒温干燥箱内干燥24 h至恒重,称dry wt后按Elliot公式计算脑含水量:脑含水量/%=(wet wt-dry wt)/wet wt×100%
1.6 大鼠大脑皮质AQP4蛋白的表达新生大鼠经乙醚麻醉后,断头取脑,将右侧脑组织置于40 g·L-1多聚甲醛磷酸盐缓冲液(pH 7.4)中4℃固定过夜,常规梯度乙醇脱水、二甲苯透明、浸腊、包埋、5 μm厚连续冠状切片。免疫组织化学SABC法观察大脑皮质AQP4的表达。每只动物取3张脑组织切片,400倍光镜下随机观察皮质2个不同视野,数码相机拍照,HMIAS-200彩色图像分析系统对染色结果进行分析,计算其平均光密度值(mean optic density,MOD)。
1.7 统计学处理实验数据用±s表示,以SPSS13.0软件进行方差分析。
2 结果
2.1 孕酮对缺氧缺血性脑损伤新生大鼠BBB通透性的影响正常组和假手术组BBB通透性差异无显著性(P>0.05);与假手术组相比,HI组BBB通透性明显升高(P<0.01);与HI组相比,PROG组脑组织BBB通透性明显降低(P<0.05),结果见Tab 1。
2.2 孕酮对缺氧缺血性脑损伤新生大鼠脑含水量的影响正常组和假手术组脑含水量差异无显著性(P>0.05);HI组脑含水量明显高于假手术组(P<0.01);PROG组脑含水量明显低于HI组(P<0.05),结果见 Tab 1。
Tab 1 Effects of PROG on BBB permeability,BWC and expression of AQP4 in cerebral cortex after hypoxic-ischemic brain damage in newborn rats(±s,n=8)

Tab 1 Effects of PROG on BBB permeability,BWC and expression of AQP4 in cerebral cortex after hypoxic-ischemic brain damage in newborn rats(±s,n=8)
**P<0.01 vs sham operated;△P<0.05 vs HI
Group EB contents/μg·g-1 BWC/%AQP4(MOD)Normal 13.11 ±2.28 87.606 ±1.254 0.293 ±0.045 Sham operated 16.33 ±2.40 87.877 ±1.021 0.289 ±0.051 HI 146.73 ±10.34**92.317 ±1.035** 0.452 ±0.053**PROG 8 mg·kg-1 133.78 ±8.20△ 89.233 ±1.091△ 0.375 ±0.056△
2.3 孕酮对缺氧缺血性脑损伤新生大鼠脑皮质AQP4表达的影响免疫组化图片显示,AQP4主要表达于微血管周围星形胶质细胞,阳性细胞呈圆形、椭圆形,胞膜着色,胞质、胞核不着色。正常组脑皮质AQP4的表达和假手术组相比差异无显著性(P>0.05);HI组脑皮质AQP4的表达明显高于假手术组(P<0.01);PROG组脑皮质AQP4的表达明显低于 HI组(P <0.05),结果见 Tab 1,Fig 1。
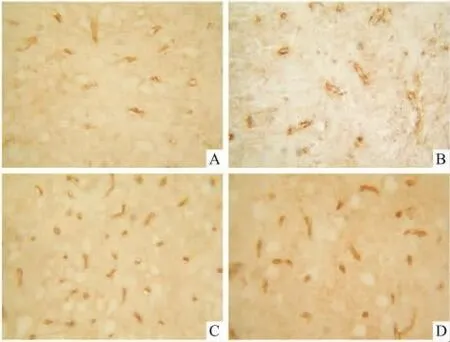
Fig 1 Effects of PROG on expression of AQP4 in cerebral cortex after hypoxic-ischemic brain damage in newborn rats(ABC×400)
3 讨论
BBB的破坏是缺血性脑损伤的重要病理生理机制之一[8]。脑损伤脑水肿是一种混合性水肿,与BBB通透性的增加密切相关[9]。本实验发现,假手术组脑组织EB含量和脑含水量与正常组相比较差异无显著性,提示单纯手术并未影响BBB通透性和脑含水量;而HI组脑组织EB含量和脑含水量明显高于假手术组,说明HI后BBB结构破坏、通透性增加,引起脑水肿;孕酮组脑组织EB含量和脑含水量明显低于HI组,说明孕酮确实具有脑保护作用,然而孕酮对脑保护作用的分子机制和途径尚不清楚。
水通道蛋白(aquaporin,AQP)是一组与水通透有关的细胞膜转运蛋白,在介导水跨胞膜的流动中起关键作用,其中AQP4是介导脑组织中水分子流动的主要水通道蛋白。有研究表明[10]AQP4可能构成BBB的第2道隔膜,起调节水运输的作用;另有研究表明[11]脑损伤后脑内微环境改变导致AQP4表达上调,使细胞膜结构改变,BBB通透性增加,对水的通透性增强,本实验也证实,HI组脑皮质AQP4蛋白表达上调,脑水肿明显。这些实验结果强烈提示HIBD后可能通过上调AQP4表达而使BBB通透性增加,进而发生脑水肿。
Yamad[12]已证实抑制AQP4的表达可减缓脑水肿的形成,从而降低神经系统疾病的病死率和致残率;Verkman等[13]也证明AQP4基因敲除可使由急性水中毒或缺血中风引起的脑肿胀明显减轻,说明抑制AQP4的表达,可抑制或减轻AQP4引起的脑水肿。因此如何抑制AQP4的表达,成为减轻脑损伤后脑水肿的关键。本实验发现,给予外源性PROG,HIBD新生大鼠BBB通透性和脑含水量明显低于HI组,且给予外源性PROG可明显抑制脑皮质AQP4的表达,提示PROG可能通过下调HIBD新生大鼠脑皮质AQP4的表达而减轻BBB损伤,缓解脑水肿。这可能是PROG对HIBD的保护作用机制之一,以上结果为临床新生儿HIE的治疗提供了一定的理论和实验依据。
[1] 朱长连,徐发林.新生儿缺氧缺血性脑病的治疗进展[J].实用儿科临床杂志,2008,23(14):1062-4.
[1] Zhu C L,Xu F L.Progress in treatment of neonatal hypoxic-ischemic encephalopathy[J].J Appl Clin Pediatr,2008,23(14):1062-4.
[2] 于震动,侯艳宁.孕酮对吗啡条件性位置偏爱大鼠相关脑区中枢多巴胺D2受体水平的影响[J].中国药理学通报,2010,26(10):1304-8.
[2] Yu Z D,Hou Y N.Effects of progesterone on morphine-induced conditioned place preference and expression levels of D2-receptor in related regions of rat brain[J].Chin Pharmacol Bull,2010,26(10):1304-8.
[3] 于震动,侯艳宁.孕酮对吗啡精神依赖大鼠海马和纹状体中阿片受体水平的影响[J].中国药理学通报,2009,25(5):642-5.
[3] Yu Z D,Hou Y N.Effects of progesterone on morphine-induced conditioned place preference and levels of μ-receptoRin hippocampus and striatum[J].Chin Pharmacol Bull,2009,25(5):642 -5.
[4] Brinton R D,Thompson R F,Foy M R,et al.Progesterone receptors:form and function in brain[J].Front Neuroendocrinol,2008,29(2):313-39.
[5] 李东亮,王小引,韩 华,赵红岗.孕酮对缺氧缺血新生大鼠脑组织SOD和GSH-Px活性的影响[J].中国药理学通报,2007,23(2):276-7.
[5] Li D L,Wang X Y,Han H,Zhao H G.Effect of progesterone on the activity of SOD and GSH-Px in brain tissue with hypoxic-ischemic encepholopathy in newborn rats[J].Chin Pharmacol Bull,2007,23(2):276 -7.
[6] 李 爽,徐春阳,姜洪波,李东亮.孕酮对缺氧缺血性脑损伤新生大鼠脑组织超氧化物歧化酶和基质金属蛋白酶3表达的影响[J].实用儿科临床杂志,2010,25(14):1065-7.
[6] Li S,Xu C Y,Jiang H B,Li D L.Effect of progesterone on the expression of superoxide dismutase and matrix metalloproteinase-3 in the brain tissues of neonatal rats with hypoxic-ischemia brain damage[J].J Appl Clin Pediatr,2010,25(14):1065 -7.
[7] del Valle J,Camins A,Pallàs M,et al.A new method for determining blood-brain barrier integrity based on intracardiac perfusion of an Evans Blue-Hoechst cocktail[J].J Neurosci Methods,2008,174(1):42-9.
[8] 雷军荣,秦 军,张 晶,等.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响[J].中国药理学通报,2010,26(1):120-3.
[8] Lei J R,Qin J,Zhang J,et al.Effects of curcumin on inflammatory reaction and blood-brain barrier permeability in rats following cerebral ischemic injury[J].Chin Pharmacol Bull,2010,26(1):120-3.
[9] Unterberg A W,Stover J,Kress B,et al.Edema and brain trauma[J].Neuroscience,2004,129(4):1021 -9.
[10] Manley GT,Fujimura M,Ma T,et al.Aquaporin-4 deletion in mice reduces brain edema after actue water intoxication and ischemic stroke[J].Nat Med,2000,6(2):159 - 63.
[11]余 涓,许 琳,林艳婷,叶 薇.局灶性脑缺血再灌注致血脑屏障破坏与zileuton的保护作用[J].中国病理生理杂志,2009,25(7):1342 -7.
[11] Yu J,Xu L,Lin Y T,Ye W.Effects of 5-ipoxygenase inhibitor zileuton on destruction of blood-brain barrier permeability induced by focal cerebral ischemia-reperfusion injury in rats[J].Chin J Pathophysiol,2009,25(7):1342 - 7.
[12] Yamada K.Brain edema and aquaporin[J].Nihon Shinkei Seishin Yakurigaku Zasshi,2005,25(5):235 - 8.
[13] Verkman A S,Yang B,Song Y,et al.Role of water channels in fluid transport studied by phenotype analysis of aquaporin knockout mice[J].Exp Physiol,2000,85(Spec No):233S - 41S.
