食用菌酯酶同工酶电泳技术方法改进
2011-02-08姚璐晔丁海洋倪歆晨孙凤丹
姚璐晔,丁海洋,倪歆晨,朱 婧,孙凤丹,冀 宏
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
“同工酶”一词首先由Moller和Markert于1959年提出[1].同工酶结构的相似性反映了生物间的亲缘关系,因此同工酶分析可用于种和种以下的分类,酶谱资料可作为鉴定物种,研究分类、进化、遗传与变异的重要指标[2-5].目前在食用菌研究中应用较多的同工酶是酯酶同工酶和过氧化物同工酶.其中关于酯酶同工酶技术的研究已屡有报道[6-11].
在研究中发现,一般按照中华人民共和国农业行业标准《食用菌菌种真实性鉴定酯酶同工酶电泳法》进行制胶、样品处理、电泳等操作,发现在现有实验室条件下其实验结果并不理想,如胶长时间不凝、平行实验电泳时间差异大、染色效果差等.为此,本文以杏鲍菇为对象,针对凝胶配制、样品处理、电泳等环节进行方法改进,摸索出适合实验教学的食用菌酯酶同工酶电泳技术.
1 材料与方法
1.1 实验菌种
杏鲍菇:江苏昆山正兴食用菌有限公司提供的光滑(R)型和粗糙(S)型两种杏鲍菇,由实验人员将其组织分离后接种于斜面.
1.2 培养基[12]
固体培养基(马铃薯葡萄糖琼脂(PDA)培养基):马铃薯20%,葡萄糖2%,琼脂2%,水1L.
液体培养基:葡萄糖2%,玉米粉1%,豆粕1%,磷酸二氢钾0.1%,硫酸镁0.1%,牛肉膏0.5%,硫胺素200~400mg,水1L.
1.3 主要试剂
(1)样品提取液(pH7.5):称取6.02g磷酸氢二钠,0.5g磷酸二氢钠,溶于水,稀释至100mL.
(2)过硫酸铵溶液:1.4g/L过硫酸铵溶于水中,并稀释至100mL,用时现配.
(3)40%(W/V)的蔗糖溶液:称取40g蔗糖,溶于水中,定容至100mL.
(4)分离胶缓冲液(pH8.9):36.6g三羟甲基甲烷(Tris),48mL 1mol/L的盐酸,加TEMED 0.23mL,加蒸馏水定容至100mL,4℃贮藏.
(5)浓缩胶缓冲液(pH6.7):5.98g Tris,48mL 1mol/L的盐酸,加TEMED 0.46mL,加蒸馏水定容至100mL,4℃贮藏.
(6)分离胶母液(7%):28.0g丙烯酰胺(Acr),0.735g甲叉双丙烯酰胺(Bis),溶于水中,并稀释至100mL,用棕色瓶4℃贮藏.
(7)浓缩胶母液(2.5%):10.0g Acr,2.5g Bis,溶于水中,并稀释至100mL,用棕色瓶4℃贮藏.(8)电极缓冲液(pH8.3):6.0g Tris,28.8g甘氨酸,溶于水,稀释至1L,用时稀释10倍.
(9)磷酸缓冲液(pH6.5):称取2.26g磷酸氢二钠,2.14g磷酸二氢钠溶于水中,稀释至100mL.
(10)染色液:称取50mg乙酸-1-奈酯,50mg乙酸-2-萘酯,100mg固蓝RR盐,用5mL丙酮溶解,再加入磷酸缓冲液(pH6.5)150mL,过滤.
(11)乙酸溶液(70mL/L):量取14mL乙酸加到适量水中,稀释至200mL.
(12)溴酚蓝指示剂:称取溴酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.0mL使之溶解,用水稀释至100mL.
1.4 实验方法
(1)液体摇瓶培养[12]
采用液体培养基,灭菌,无菌条件下接种3~4块0.5cm3的菌块至液体培养基中,28℃静置培养24h后置于恒温振荡摇床上,28℃150rpm培养7d.
(2)样品制备[8]
收集液体深层发酵产生的菌丝球,称取0.5g菌丝球,置于研钵,加0.5g石英砂,1mL样品提取液,冰浴研磨,将样品收集于1.5mL离心管中,4℃,10000rpm离心5min,取上清液.将上清液、蔗糖溶液、溴酚蓝溶液按(V:V:V)5:1:1的比例混合,混合液即为电泳样品.
(3)凝胶制备[8]
分离胶:将分离胶缓冲液、分离胶母液、蒸馏水、过硫酸铵按体积比为1:2:1:4混合,搅拌均匀,加入电泳槽中直至距短板3cm处,封上适量蒸馏水,待凝.
浓缩胶:待分离胶凝固后,弃去上部的蒸馏水,将浓缩胶缓冲液、浓缩胶母液、核黄素、蔗糖溶液按照体积比为1:2:1:4的比例混合,搅拌均匀,灌入胶室,立即插好样品梳,日光或灯光下聚合.
(4)加样
浓缩胶聚合后,小心抽出样品梳,吸取加样孔中多余的水分,在电泳槽中加入电极缓冲液,用微量进样器吸取适量样品加入样品孔中.
(5)染色
将取出的凝胶浸没于染色液中,37℃染色15~30min,用蒸馏水冲洗数次后置于乙酸溶液中固定.
2 结果与分析
2.1 浓缩胶配方的优化
根据《中华人民共和国农业行业标准》中食用菌菌种真实性鉴定酯酶同工酶电泳法中分离胶、浓缩胶的配方制胶,该配方浓度为7%,适于食用菌酯酶的分子量.预实验结果表明,将分离胶灌入胶室,水封后,将制胶器放入60℃烘箱中,可加速分离胶的凝固,且制成的胶柔韧性和刚性较好;分离胶的凝固时间约为70min.
原配方的浓缩胶采用光聚合催化,不易凝固.为此,将光聚合改为化学聚合,即将浓缩胶中的核黄素改成过硫酸铵溶液(AP),并引进了四甲基乙二胺(TEMED).
如表1所示,对照组即原始配方,放置过夜不凝,可能光照强度不够,以致没有足够的自由基参与胶的凝固.实验组均采用化学聚合的催化方法,引进AP和TEMED,胶得以凝固;随着两者量的逐步递增,在不影响浓缩胶质量的前提下,胶的凝固时间控制在80min左右,达到了预期目标.
浓缩胶初始配方的胶浓度是2.5%,胶浓度很低,凝胶孔径大,刚性差,当加样梳拔去时,加样孔变形,无法加样.针对此问题,采用提高蔗糖量的方法解决.实验结果表明,当蔗糖的量提高到5mL时,胶的刚性有了显著改变,继续提高蔗糖的量,浓缩胶不凝,这是因为加大蔗糖量的同时,也加大了浓缩胶的总体积,浓缩胶母液的比例在逐渐降低,因此当再加大蔗糖量时,浓缩胶因其胶浓度低而无法凝固.
通过上述实验,最终确定浓缩胶的配方为:浓缩胶缓冲液1mL,浓缩胶母液2mL,过硫酸铵溶液(AP)2mL,蔗糖溶液5mL,四甲基乙二胺(TEMED)50uL.
因为浓缩胶的胶浓度较低,分离胶上部及梳子带有的少量水都能影响到浓缩胶的凝固,使浓缩胶的凝固时间不固定,随机性很大.为此,通过变换不同的实验方法,最终采用在分离胶凝固之后,用浓缩胶缓冲液润洗分离胶上部,梳子在使用前烘干的措施,以减少水分的带入,使浓缩胶的凝固时间基本稳定为80min.
同灌注分离胶类似,当浓缩胶灌注结束,插入加样梳后,同样将制胶器放入60℃的烘箱中,为了防止浓缩胶中水分的蒸发,导致上层浓缩胶凝固后不平整,故在放入烘箱前用保鲜膜将其顶部裹住.

表1 浓缩胶配方改进方案
2.2 电泳时间考察
根据优化后的凝胶配方制成相应的分离胶及浓缩胶,在浓缩胶聚合后,加样,电泳.样品在浓缩胶中耗时75min~90min;进入分离胶时,所有样品都压缩成极细的条带,浓缩效应显著;样品从进入分离胶,至溴酚蓝指示剂下移至距胶底约1cm时停止电泳,耗时150min~180min;整个过程耗时近四小时.经取胶染色后发现,酶带均分布在分离胶的上部,且离浓缩胶较近;由于浓缩胶比较软,在取胶时,浓缩胶已破坏,所以分布在分离胶上端的酶带容易在取胶时被破坏.因此,将停止电泳的时间再延长半小时,即溴酚蓝指示剂下移至距胶底约1cm时再通电半小时.结果如图1所示,各酶带间的相互距离不发生变化,仅使所有条带均往下移动,条带更清晰,电泳图更美观;且移动最快的酶带也未移出凝胶.若涉及到迁移率的计算,应将公式中溴酚蓝的迁移距离改为分离胶的长度,此项变动不会影响酶带迁移率的分析.
2.3 样品处理
本实验采用的是冰浴研磨法,根据资料处理样品,进行电泳,结果发现酶带颜色较浅,说明在本实验中的液体培养基进行菌丝培养,最终菌丝球中含有的酯酶酶量少.在此基础上,考察了不同菌丝体及样品提取液的配比:分别用1mL样品提取液处理0.5g菌丝、1g菌丝、1.5g菌丝及2g菌丝.随着处理菌丝量的增加,加入石英砂的量也相应增加,以保证研磨彻底.实验结果表明,在同一电泳条件下,用1mL样品提取液处理1.5g菌丝,此时酶带较清晰.尽管在此基础上增加菌丝的量,酶带清晰度会有小幅度的提高,但考虑到后续实验中菌丝的生成量,故最终将两者的配比定为1.5g菌丝体用1mL样品提取液处理.
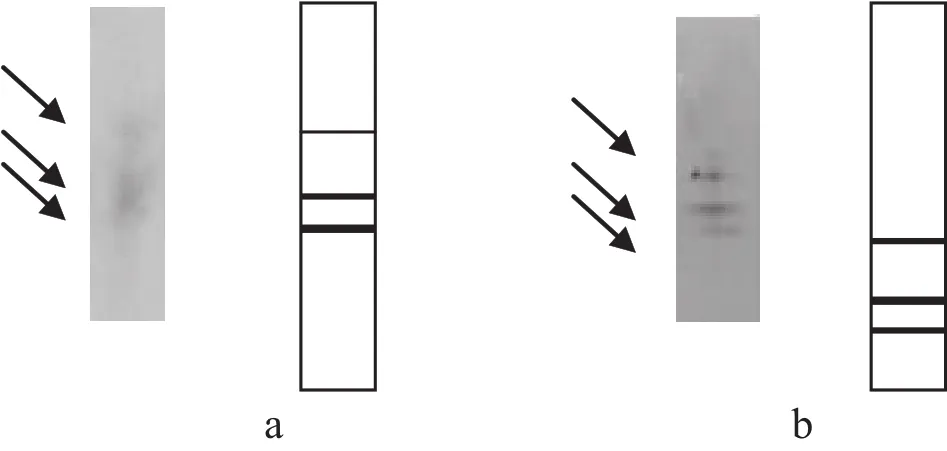
图1 不同电泳时间下酶带的分布位置(a图为指示剂移至距胶底1cm时停止电泳,b图为在a图上再延长半小时)
其次,样品离心后的上清液与蔗糖溶液、溴酚蓝指示剂的比例也由原来的5:1:1改为8:3:1,总体积1.2mL不发生变化,这样,同样的样品加样量中所含的酯酶同工酶的量就得以提高,蔗糖溶液含量几乎未变,而溴酚蓝指示剂含量的变低,仅仅表现在指示剂颜色变浅,对整个实验结果没有影响.

图2 杏鲍菇酯酶同工酶不同加样量电泳图(a、b、c图分别为1mL样品液处理0.5g菌丝、1g菌丝和1.5g菌丝)
2.4 电泳
在上述实验的基础上,对实验菌株进行电泳.
分离胶配方(7%):分离胶缓冲液3mL,分离胶母液6mL,水3mL,过硫酸铵溶液12mL.
浓缩胶配方(2.5%):浓缩胶缓冲液1mL,浓缩胶母液2mL,过硫酸铵溶液2mL,蔗糖溶液5mL,四甲基乙二铵50uL.
样品处理:1mL样品提取液加至含有1.5g菌丝球及石英砂的研钵,冰浴研磨,离心;离心上清液与蔗糖溶液、溴酚蓝指示剂的比例为8:3:1.
电泳:稳流电泳.样品在浓缩胶的电流为10mA,进入分离胶后升至15mA,溴酚蓝指示剂距胶底1cm处时再通电30min后停止电泳.
结果见图3,从图中可以看出,样品(杏鲍菇)酶带清晰,且实验的重复性好;胶两侧与中间的样品条带区别不大,几乎没有烧胶等现象.
为了进一步验证实验所得酯酶同工酶电泳技术在本实验室条件下的应用,对不同培养时间的杏鲍菇样品进行电泳,结果如图4(S型)和图5(R型).从图中可以看出,电泳的酶带清晰,结果明显,利于分析;杏鲍菇S型的电泳酶带有6条,R型的酶带有4条;随着培养时间的延长,酶带颜色逐渐加深,说明菌丝体培养时间越长,生成的酯酶同工酶的酶量越多[9].

图3 杏鲍菇酯酶同工酶电泳图

图4 杏鲍菇(S型)酯酶同工酶电泳图从图的右侧往左侧菌丝体培养时间依次延长24h,最右边的样品培养时间为2d,最左边的样品培养时间为10d.
3 结论
通过实验确定了适合本实验室条件的食用菌酯酶同工酶电泳技术,其电泳结果中酶带清晰,宜于分析.具体如下:分离胶配方(7%):分离胶缓冲液3mL,分离胶母液6mL,水3mL,过硫酸铵溶液12mL.浓缩胶配方(2.5%):浓缩胶缓冲液1mL,浓缩胶母液2mL,过硫酸铵溶液2mL,蔗糖溶液5mL,四甲基乙二铵50uL.样品处理:1mL样品提取液加至含有1.5g菌丝球及石英砂的研钵,冰浴研磨,离心;离心上清液与蔗糖溶液、溴酚蓝指示剂的比例为8:3:1.电泳:稳流电泳.样品在浓缩胶的电流为10mA,进入分离胶后升至15mA,溴酚蓝指示剂距胶底1cm处时再通电30min后停止电泳.

图5 杏鲍菇(R型)酯酶同工酶电泳图从图的左侧往右侧菌丝体培养时间依次延长24h,从左至右,第一个样品培养时间为2d,最后一个样品培养时间为10d.
将已确定的电泳技术分析实验菌株杏鲍菇S型和R型的不同培养周期的酯酶同工酶条带,结果表明,在培养的10d时间内,S型共出现6条条带,R型出现了4条;随着培养周期的延长,酶带颜色逐步加深,表明酶量增加,但酶带的数目并无变化.本实验对食用菌酯酶同工酶的相关研究具有一定的参考价值.
[1]周劲宋.同工酶在果树研究中的应用[J].果树学报,1988,(3):12.
[2]叶明,王和平,潘迎捷.利用酯酶同工酶技术检测香菇双单杂交后代[J].生物学杂志,1999,16(5):21-22.
[3]DANIEL J,ROYSE.香菇细胞品系鉴别及品系的遗传关系[J].国外食用菌,1985,(2):1-3.
[4]陈东升,潘学仁.香菇四种酶的同工酶组织特异性[J].食用菌,1994,(6):2-3.
[5]张原铿,孙慧丽,舒娅玲.用酯酶同工酶检测香菇杂种[J].中国食用菌,1986,(2):7-8.
[6]宋爱荣,崔明英,牟其芸,等.双孢蘑菇F56不同发育期的酯酶同工酶研究[J].食用菌,1997,19(5):7.
[7]杨立红,黄清荣,辛晓林,等.食用菌菌种选育中酯酶同工酶的应用研究[J].食用菌,2005,(6):12-14.
[8]中华人民共和国农业部.NY/T 1097-2006食用菌菌种真实性鉴定酯酶同工酶电泳法[S].北京:中国农业出版社,2006.
[9]刘庆,徐兴华.电泳法分析食用菌酯酶同工酶方法的优化[J].生命科学仪器,2008,6(5):42-43.
[10]王贤樵,王泽生.双孢蘑菇同工酶标记筛选研究[J].中国食用菌,1989,(6):7-11.
[11]丁凤珍,金建康.猴丰1号金菌株的选育及其酯酶同工酶分析[J].食用菌学报,1996,3(2):5-8.
[12]刘慧铭.不同配方培养基对杏鲍菇菌丝生长的影响[J].中国瓜菜,2007,(3):10-12.
