复合益生菌的研制及应用
2011-01-29杨智敏刘爱玲赵风琴
杨智敏 刘爱玲 赵风琴
(河南省洛阳市洛龙区动物疫病预防控制中心,洛阳 471022)
复合益生菌的研制及应用
杨智敏 刘爱玲 赵风琴
(河南省洛阳市洛龙区动物疫病预防控制中心,洛阳 471022)
选择30只50日龄、体重在0.5~0.75 kg的断奶肉仔兔,设1个试验组,1个对照组,完全随机分组,试验期为60 d。试验组基础日粮中添加一定剂量本实验室培养的复合益生菌,对照组按常规方法饲养,测定日增重、增重率、日耗料、料肉比及机体免疫状况等指标。试验期结束,对试验兔心脏采血,以玫瑰花环试验检测兔血液中T淋巴细胞的玫瑰花环形成率和酯酶染色试验检测血液中T淋巴细胞的数目。以试管凝集反应检测大肠杆菌抗体含量。试验结果表明:试验组平均增重(1.01 kg)高于对照组(0.74 kg)(P<0.05),试验组的增重率(2.76%)比对照组(2.20%)升高0.56%。试验组断奶仔兔血液中T淋巴细胞的玫瑰花环形成率在85.10%,远高于对照组的玫瑰花环形成率69.06%。试验组断奶仔兔血液循环中T淋巴细胞数目(397个)比对照组(329个)高出20.67%。试验组兔体内抗大肠杆菌抗体比对照组高出400倍。由以上结果可知在断奶仔兔的日粮中添加复合益生菌能够显著的提高生产性能、增强机体免疫力,对促进生长、降低料肉比、提高饲料利用率等指标有较好的效果。
复合益生菌 断奶仔兔 免疫力 日增重 饲料利用率
1 材料与方法
1.1 材料
1.1.1 培养基 蛋白胨,酵母浸膏,NaCl,牛肉提取物,葡萄糖,乙酸钠,柠檬酸二胺,吐温-80,磷酸氢二钾,七水硫酸镁,一水硫酸锰,碳酸钙,琼脂。
1.1.2 染色液 革兰氏染色液:草酸铵结晶紫染色液、碘液、95%酒精、碱性美兰。
1.1.3 生化反应管 均购自杭州微生物试剂有限公司。
1.1.4 主要仪器设备 电热恒温培养箱;超净工作台;高压蒸汽消毒器;电动离心机;光学显微镜;电子天平;接种环;试管;平皿;冰箱等。
1.1.5 实验动物 家兔30只购于洛阳市白马寺。
1.2 方法
1.2.1 枯草芽孢杆菌的分离与鉴定
1.2.1.1 产芽孢菌的筛选 在无菌条件下,取5 g枯草加入到盛有45 ml无菌生理盐水的三角瓶中,振荡混匀,悬浮液于80℃下保持10 min,以杀死非芽孢的菌体。取5 ml悬浮液接入到装有45 ml种子培养基的三角瓶内,于37 ℃富集培养20 h。取富集培养后的菌液,用无菌生理盐水适当稀释,取一定量涂布于平板,在37 ℃下培养20 h。挑选生长良好、菌落较大的单菌落接种于斜面保藏培养基中,冰箱4 ℃保藏。
1.2.1.2 产芽孢菌的初步鉴定 样品经过上述处理后,筛选出1株产芽孢菌,37 ℃下培养20 h,通过格兰氏染色、镜检对其进行初步鉴定。
1.2.2 其他菌的分离与鉴定 植物乳杆菌、戊糖片球菌、地衣芽孢杆菌菌种来自于河南科技大学动物科技学院微生物实验室。先分别将三种菌接种于MRS液体培养基复活,置于37℃恒温箱中培养24 h后,分别取少量放于平皿上,格兰氏染色镜检,观察细菌的活性、形态及是否有杂菌。
1.2.3 复合益生菌的培养 在确定4种菌存活及生长良好后,分别将其接种于MRS固体培养基上,置于37 ℃恒温箱中培养24 h后,观察菌落形态及是否有杂菌生长。之后,分别将其接种于MRS液体培养基中增菌培养。
1.2.4 复合益生菌的鉴定 对4种菌先进行形态观察,之后进行染色特性,菌落特性鉴定,最后通过生化反应结果并依据《常见细菌系统鉴定手册》来确定细菌。生化反应包括:V-P测定、接触酶反应、水解反应、糖发酵实验、硝酸盐还原、吲哚反应、柠檬酸反应等。
1.2.5 复合益生菌的增菌 将培养好的复合益生菌用MRS液体培养基增菌。
1.2.6 饲粮配方 试验所用的基础日粮配方:豆柏,菜籽柏,棉籽柏,鱼粉,草粉,饲料级磷酸氢钙,食盐,饲料级蛋氨酸,赖氨酸,饲料级维生素(VA、VD3、VE、VK3、VC、VB2、VB12),氯化胆碱等。复合益生菌内含有4种益生菌包括植物乳杆菌、戊糖片球菌、地衣芽孢杆菌和枯草芽孢杆菌,有效的菌群数保证>10亿个/g左右。
1.2.7 饲喂方法
1.2.7.1 实验动物分组 选择日龄,体重相近的断奶肉仔兔共30只,随机2组(不分公母),对照组10只,试验组20只。
1.2.7.2 饲养管理 试验兔室内笼养,兔笼为单个式。每笼面积0.35 m2(0.5×0.7),对照组笼中10只,试验组笼中20只。兔舍自然通风,每天定时打扫卫生和清理粪便一次,碗式饮水器,料槽,自由饮水和自由采食颗粒饲料(计量)。试验前按常规疫苗程序进行免疫,试验期间每7天称1次体重(空腹),最后计算日增重率和饲料消化率等指标。
1.2.7.3 测定项目及分析方法 试验始、末重,实验期间每周称1次体重,每天记录净采食量,观察记录兔群腹泻发病,死亡情况。使用Excel处理文章重出现的数据。
1.2.7.4 饲喂方法 试验组兔子基础日粮与对照组相同,在饲喂复合益生菌时我们采取了以下方法:
饮水饲喂:控制好细菌的饲喂量,直接用增菌的MRS液体培养基让其饮水。
拌料饲喂:将增菌的MRS液体培养基以3000转∕min的速度离心8 min,取沉淀物拌于饲料中饲喂。
1.3 实验动物机体免疫状况检测
1.3.1 玫瑰花环形成试验
1.3.1.1 试剂配制
① Hanks液:
原液甲:氯化钠160.0 g,氯化钾8.0 g,7水合硫酸镁2.0 g,6水合氯化镁2.0 g,溶于800 ml双蒸馏水中;氯化钙2.0 g,溶于100 ml双蒸馏水中。将上述2液混合后,加蒸馏水至1000 ml,用滤纸过滤,加入2.0 ml氯仿作为防腐剂,保存于4 ℃。
原液乙:12水合磷酸氢二钠3.04 g,磷酸二氢钾1.2 g,葡萄糖20.0 g溶于800 ml双蒸馏水中;称取0.4 g苯酚红于研钵中,渐渐加入0.1N氢氧化钠并不断研磨,直至所有颗粒完全溶解,所加入氢氧化钠的量为11.28 ml,最后加蒸馏水至100 ml。
将上述2液混合,加双蒸馏水至1 000 ml用滤纸过滤,加氯仿2.0 ml,保存4 ℃冰箱。使用时,取原液甲、乙各25 ml,加蒸馏水至500 ml充分混合,以9磅10 min高压灭菌。用前用5%的碳酸氢钠溶液pH值于7.0。
②0.5%的乳白蛋白水解物的配制(乳汉液):
称1 g乳白蛋白水解物,溶于200 ml Hanks液中,9磅10 min高压灭菌,保存于4 ℃冰箱备用。
③抗菌素配制(简称SP液或双抗液):
取水剂青霉素100万单位,链霉素1.0 g,溶于100 ml Hanks液中,低温冰箱保存备用。
④5%的碳酸氢钠溶液配制:
称取碳酸氢钠5 g,溶于100 ml蒸馏水中,瓶口用胶塞塞紧,防止漏气,10磅10 min高压灭菌,保存于4 ℃冰箱备用。
⑤3.8%枸橼酸纳溶液的配制:
称取枸橼酸纳1.9 g,溶于蒸馏水50 ml,10磅10 min高压灭菌,保存于4 ℃冰箱。
⑥红细胞保存液(阿氏液)的配制:
称取葡萄糖2.46 g,2水合柠檬酸钠0.96 g,氯化钠0.504 g,蒸馏水100 ml,各成分在蒸馏水中溶解后,加入5%柠檬酸钠约12 ml,调pH值于6.1,10磅10 min高压灭菌,保存于4 ℃冰箱备用。
⑦ 细胞营养液的配制:
用0.5%的乳汉液18 ml,临用时加20%的犊牛血清,再加入双抗0.3 ml,用5%的碳酸氢钠溶液调pH值至7.0。
1.3.1.2 玫瑰花环的检查方法 绵羊红细胞的配制:自绵羊静脉采血,储存于等量阿氏液中,置4 ℃冰箱中可保存1个月,临用时吸取保存液底部的红细胞放入离心管中,用生理盐水或Hanks液洗涤3次(室温1500转/分离心10 min),最后用细胞营养液配成1%~5%红细胞悬液。
①用1个试管,先加入3 ml 淋巴细胞分层液(分层液由商品供应)。
②在此分层液液面上轻轻加入4~5 ml肉兔抗凝血(千万不要打破2液间的液面)。
③用1500~2000转/分离心10~20 min,此时可见液面分4层:上层为血浆,第2层为淋巴细胞,第3层为淋巴细胞分层液,最后为红细胞粒细胞。
④用吸管直插入淋巴细胞层吸取淋巴细胞放入含有Hanks液4~5 ml的试管中,充分混匀1500~2000转/分离心5~10 min(洗两次)。弃去上清液,即获得纯淋巴细胞。
⑤吸取上述淋巴细胞悬液0.1 ml,加入犊牛血清0.1 ml及5%绵羊红细胞悬液0.2 ml,混匀后置于37 ℃温箱中5 min,其间摇动2~3次。500转/分离心5 min,4 ℃置于冰箱2个小时或过夜。
⑥取出标本轻轻旋转混匀(注意不可甩动,以免花环脱落),沿管壁加入0.8%戊二醛一滴,再轻轻旋转混匀,置4 ℃冰箱20 min。500转/分离心5 min,弃上清液,将沉淀物混匀后推片。滴加瑞士颜色液(或革兰氏染液)1~2滴,在再加pH6.4的磷酸缓冲液,染5 min。
1.3.1.3 结果观察 用油镜或高倍镜检查,凡淋巴细胞表面粘贴4个以上的绵羊红细胞为阳性花环形成细胞,检查300个以上淋巴细胞,计算出花环细胞占淋巴细胞的百分比。

1.3.2 酯酶染色法
1.3.2.1 试剂配制
① 固定液:(福尔马林—丙酮酸缓冲液)
磷酸氢二钠20 mg,磷酸二氢钾100 mg,双蒸馏水30 ml,丙酮40 ml,40%的甲醛25 ml,充分混匀后溶解过滤,置4 ℃冰箱备用。
②染色液
⑴染色液副品红溶液:副品红4 g加入2N盐酸100 ml 溶解过滤。
⑵1.6%的亚硝酸钠溶液:4%的亚硝酸钠1 g,加蒸馏水2.5 ml,临用当天配制。
⑶2% a-醋酸萘酯溶液:称取a-醋酸萘酯2 g,加入乙二醇甲醚100 ml,放有色试剂瓶中,置4 ℃冰箱中保存备用。
⑷M/15 pH7.6磷酸盐缓冲液:
甲液:磷酸二氢钾9.08 g,加蒸馏水至1000 ml。
乙液:磷酸氢二钾23.88 g,加蒸馏水至1000 ml。
取甲液13 ml,乙液87 ml,混合后即成。
⑸酯酶染色液的配制:吸取副品红液3 ml于瓶中,再吸取4%亚硝酸钠溶液3 ml,徐徐加入M/15 pH 7.6磷酸盐缓冲液89 ml,用玻璃棒搅匀,再慢慢滴入加2% a-醋酸萘酯溶液2.5 ml,边加边搅拌,使颜色由乳白色变为淡茄花色混浊样溶液。调pH 为5.8。
⑹1%甲基绿液:称取甲基绿液1 g于量瓶中加蒸馏水至100 ml。
1.3.2.2 酯酶染色操作方法
①采血:兔子静脉采血,作全血涂片、晾干、血片厚薄适宜。
②固定:将血片浸于福尔马林-丙酮缓冲液中固定1 min,取出用自来水冲洗3 min,再经蒸馏水洗后,干燥。(也可以不固定)。
③染色:将血片浸染于酯酶染色液中,37 ℃浸染1~3 h,取出后流水冲洗,晾至半干。
④复染:将血片标本浸于1%甲基绿溶液中染色1 min,取出流水冲洗后,干燥。
⑤镜检:在油镜下观察,可见淋巴细胞质中有褐红色颗粒为T细胞,没有褐红色颗粒为B细胞,红细胞呈淡黄色,单核细胞为粉红色。
2.3.3 试管凝集反应
①每份血清用6支试管(1 cm×8 cm)另取对照管3支,如待检血清不多时,只设1份对照组。
②按表1用0.5%石碳酸生理盐水,将被检血清稀释呈6个稀释度,第7管中不加血清,设抗原对照。
③各管中加入用0.5%石碳酸生理盐水稀释20倍的大肠杆菌抗原0.5 ml(每升含升细菌8亿个)。
④各管中加抗原后,充分混匀,放于37 ℃温箱中4~10 h,取出后室温放置18~24 h,然后观察并记录结果。见表1。
判断结果时用“+”表示反应强度:

表1 大肠杆菌凝集反应
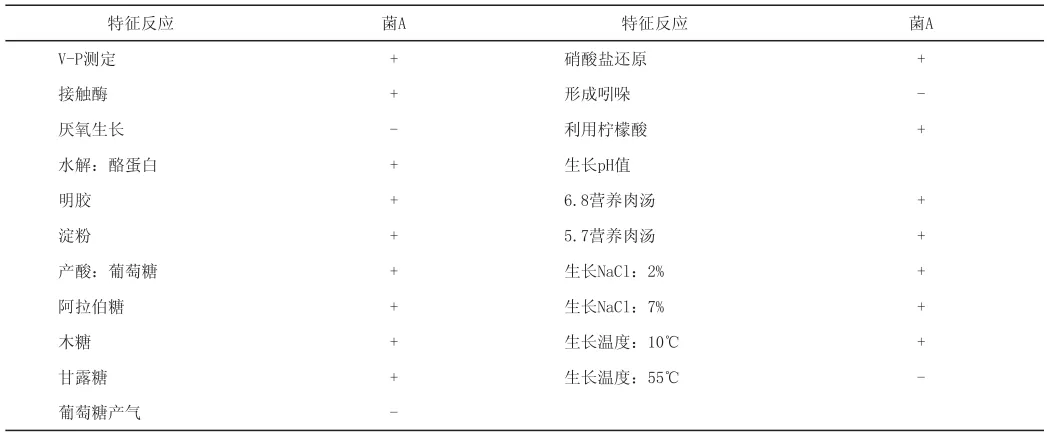
表2 枯草芽孢杆菌的主要生理生化特征
++++:液体完全透明,菌体完全被凝集呈伞状沉于管底,振荡时,沉淀物呈片状(即100%的菌体被凝集)。
+++:液体略混浊,菌体大部分被凝于管底,振荡时呈片状颗粒状(75%菌体被凝集)。
++:液体不透明,管底有明显凝集片,振荡时有块状或小片絮状物(50%菌体被凝集)。
+:液体不透明,仅管底有少许凝集,其余无显著的凝块(25%菌体被凝集)。
-:液体混浊,管底无凝集,菌体不被凝集,但由于菌体自然下沉,在管底中央可见圆点状沉淀,振荡后立即散开呈均匀混浊。
判定血清凝集价:出现“++”以上凝集现象的最高血清稀释度为凝集价。
2 结果
2.1 枯草芽孢杆菌的分离鉴定结果
2.1.1 枯草芽孢杆菌的初步鉴定结果 样品经过上述处理后,筛选出1株产芽孢菌,对其进行初步鉴定。37 ℃下培养20 h后,显微镜下观察,革兰氏染色阳性,长杆状,以链状排列,运动,芽孢中生或近中生,无荚膜,孢子囊不膨大。菌落圆形,直径4~7 mm,表面皱褶,灰白色或微带黄色,无光泽,放射状,边缘不整齐,叶状,带有鳞片,不透明。
2.1.2 枯草芽孢杆菌的生理生化鉴定结果(见表2)
2.2 地衣芽孢杆菌的分离培养结果
2.2.1 地衣芽孢杆菌的初步鉴定结果 样品经过上述处理后,37 ℃下培养24 h后镜检,革兰氏染色反应为阳性,菌体呈杆状,侧面平行,两端钝圆,长约1.7~2 μm,宽约0.7~0.9 μm,芽孢椭圆形、近中生,芽孢囊不明显膨大。
在MRS固体培养基上生长,菌落圆形,直径2.8~4 mm,浅灰色、较薄、干燥、不透明、表面粗糙皱褶、边缘较厚呈环状隆起。菌落与培养基紧贴,不易挑取,挑入水滴时保持膜状。
2.2.2 地衣芽孢杆菌的生理生化特性结果(见表3)
2.3 植物乳杆菌的分离培养结果
将复活的植物乳杆菌接种于MRS固体培养基可见到灰白色、不透明、圆形、光滑、湿润的大菌落。镜检看到革兰氏染色呈阳性,菌种呈短杆状,宽0.9~1.2 μm,长2~6 μm,有时成对或成链状,不产芽胞。其生化特性见表4。

表3 地衣芽孢杆菌的主要生理生化特征

表4 植物乳杆菌的生理生化特性

表5 戊糖片球菌的生理生化特性
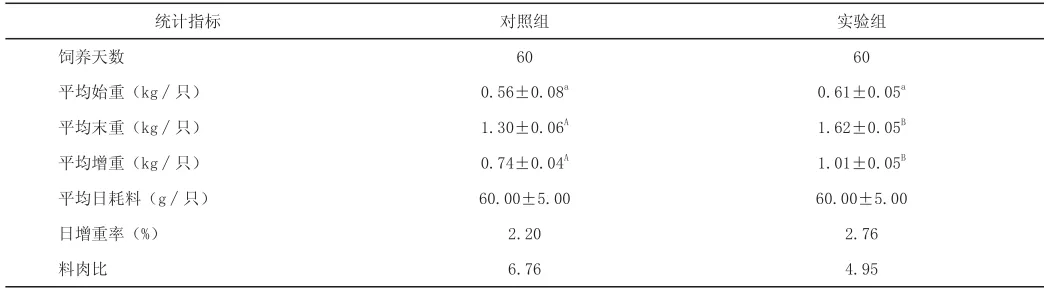
表6 饲喂复合益生菌对肉兔生长性能的影响

表7 复合益生菌对实验兔玫瑰花环形成率的影响

表8 复合益生菌对试验兔酯酶染色结果的影响
2.4 戊糖片球菌的分离培养结果
将复活的戊糖片球菌接种于MRS固体培养基,在30 ℃条件下培养2 d后可见到,其生长良好,菌落四周有明显的透明圈,菌落斜嵌于培养基内的呈菱形,生长在表面的呈规则的圆形,白色扁平。镜检看到菌株革兰氏染色阳性,经亚甲蓝单染色后与光学显微镜(1600×)下观察,细胞球状,四联或成片状排列,细胞直径约1μm。其生化特性见表5。
2.5 复合益生菌对断奶肉仔兔生产性能的影响(见表6)
由表可知:60 d试验期后,试验组的平均增重高于对照组,差异显著(P>0.05),试验组的日增重率比对照组高0.56%,试验组的料肉比低于对照组,说明复合益生菌对促进生长、降低料肉比、提高饲料利用率等指标有较好的效果。
2.6 玫瑰花环实验的结果(见表7)
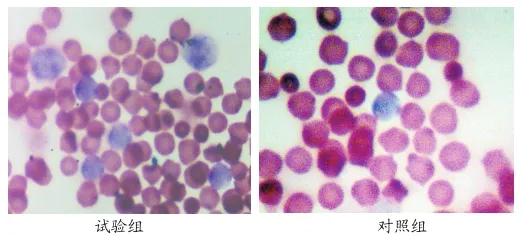
图1 玫瑰花环形成图
由图1和表7可知:试验组对T淋巴细胞玫瑰花环形成率高于对照组,说明复合益生菌可以显著的提高机体免疫力,能够刺激肠道粘膜上的免疫细胞,从而增强肠道内的免疫活力。
2.7 酯酶染色法的结果(见表8)
由表8及图2可知:试验组的T细胞所占例比对照组提高了20.67%,T细胞明显比对照组增多,从而可以增强和调节机体细胞免疫功能,说明复合益生菌能够有效地提高免疫力。
2.8 试管凝集反应的结果(见表9)
通过试管凝集反应检测出兔血清中的抗大肠杆菌抗体比对照组高出400倍。说明复合益生菌在兔消化道粘膜上能够刺激肠道内B淋巴细胞转化率,增强抗病原微生物的功能。
3 讨论与分析
3.1 培养条件对复合益生菌的影响
在益生菌生产的整个过程中,都要考虑到益生菌活性这一重要标准,以便达到并保持高活性。据报道,在发酵液中添加吐温80或是钙对冷冻过程中菌的存活有促进作用。本实验中通过改善培养条件来影响益生菌菌种的活力,在MRS培养基中添加碳酸钙和吐温80以促进菌种的存活。
3.2 复合益生菌的安全性
对于新筛选出的益生菌菌株进行安全性检测是非常必要的,只有经过验证,确定其为安全性较高的菌株才可以用于生产使用。本实验的4种菌为地衣芽孢杆菌、植物乳杆菌、戊糖片球菌及枯草芽孢杆菌均为美国食品药物管理局认为安全的益生菌,能够确保其安全性。
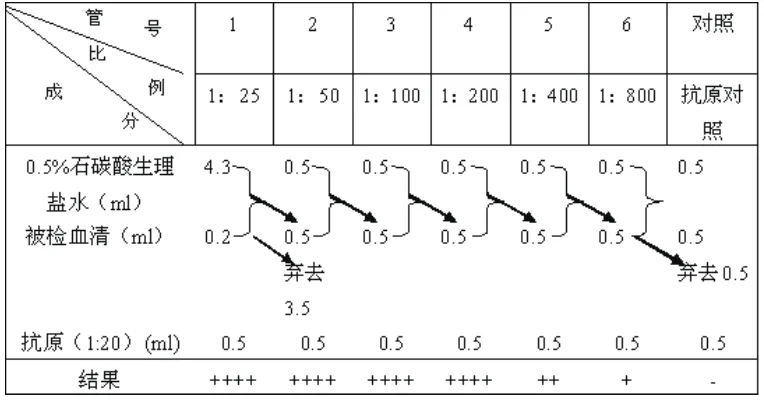
表9 试管凝集反应的结果
3.3 复合益生菌的使用剂量
益生菌的益生作用是通过有益微生物在动物体内一系列生理活动来实现的,其最终效果同使用的益生菌数量密切相关。若数量不够,在体内不能形成菌群优势,难以起到益生作用。曹建民等试验表明,如果一种细菌在盲肠内容物的浓度低于107个/g,则该菌产生的酶及代谢产物不足以影响宿主;若数量过多,超出占据肠内附着点和形成优势菌群所需的数量,非但功效不会增加,反而造成浪费。目前,益生菌用于特定养殖动物所需的菌群数量尚无统一的规定。瑞典规定乳酸菌制剂活菌数要达到2×1011个/g。我国正式批准生产的制剂中,对含菌数量与用量的规定是:芽孢杆菌含量≥5×108个/g,乳酸杆菌≥107个/g,益生素的一般含量106~107个/g。本实验中饲喂时保证了有效的菌群数>10亿个/g左右,能够达到有效饲喂量。
3.4 复合益生菌的使用方法
本实验采取2种方法发现由于益生菌的难闻气味,兔子会拒绝饮水,而离心后拌入饲料中的方法兔子更易于接受。除此还可以将复合益生菌装入胶囊中以2粒∕天的形式饲喂,总之每种方法都有弊有利,我们在选择时应根据实际条件去应用。
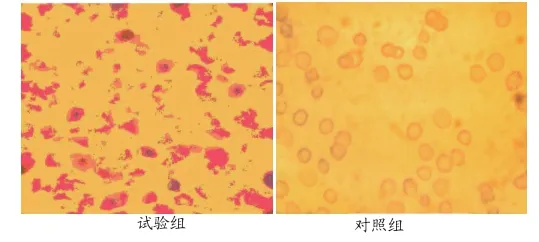
图2 酯酶染色结果
3.5 复合益生菌可以提高动物生产性能
实验中观察到,添加益生菌后的饲料适口性好,可刺激食欲,提高采食量。张红军等用2 000只蛋鸡进行了多株菌种的发酵饲料饲喂试验,试验组料蛋比显著低于对照组;试验组产蛋率极显著高于对照组;试验组蛋重极显著高于对照组,并且使用发酵饲料降低了饲料成本。
3.6 复合益生菌可以改善环境
益生菌可以明显降低饲养环境的氨气、硫化氢、臭氧等有害气体浓度.减少环境因素中的疫病诱因。益生菌的应用可太大缩短病原菌在体内的停留时间。鸡在长期摄入抗生素时,可以延长粪便中沙门氏菌的排出过程,利用小鼠作的实验也证明了这一点,这是因为抗生素抑制了正常菌群,使沙门氏菌能得以在较长时间内存活繁殖。现在有许多研究证明,一些益生菌制剂可以明显减少环境中病原微生物的数量,减轻臭味等,这为创造一个清洁的环境提供了可行的方法。
4 结论
本实验是对断奶仔兔添加复合益生菌后生产性能及免疫力效果的研究。结果证明,复合益生菌可以在动物体内发挥作用,促进动物生长,优化动物的健康状况,从而提高生产性能。除此它还可以加快断奶仔兔T淋巴细胞的生长发育和成熟,刺激机体免疫功能,减少死亡率,提高养殖效益。本实验结果让人们对复合益生菌的应用效果又有了一个全面认识,为复合益生菌的研究推广与应用提供了理论基础。
[1] 王旭明,陈宗泽,袁毅. 益生菌作用机理的研究进展[J].吉林农业科学,2002,27(01):50~53
[2] 胡学智. 益生元的生理功能、制造和应用(一)[J].江苏调味副食品,2007,24(06):1~7
[3] 郝生宏,杨荣芳. 国内外益生生产应用现状[J].2004(06):19~21
[4] 陈有容,郑小平,方继东,等. 益生菌的健康功效及其应用[J].上海水产大学学报,2001,10(3):269~275
[5] 潘金寿. 益生菌、益生素及合生剂的作用机理和相互关系[J].中国饲料,2000,15:12~15
[6] 胡学智. 益生菌、益生原及其保健功能和安全性[J].上海医药,2001,22(8):356~358
[7] 陈萍,张灿权,张春. 益生菌的应用及其发展前景[J].江西农业学报,2008,20(9):118~120
