地木耳多糖的提取与纯化研究
2011-01-24张唐伟柳青海李天才
张唐伟,柳青海,李天才
(1.中国科学院西北高原生物研究所,青海西宁 810008;2.中国科学院研究生院,北京 100049)
地木耳 (Nostoc comm uneVauch)俗称地皮菜、地耳、鼻涕肉、地踏菜、地软、地衣、地捡皮等,为藻类蓝藻纲念珠藻科 (Nostocaceae)念珠藻属植物念珠藻(Nostoc comm uneVauch)的藻体。它与发菜 (N.flagellifor m e)、葛仙米 (Nostoc sphaeroidesKutzing)为同属植物[1]。自然生长的地木耳为草绿色,粘球状,植物体常集合形成肉眼可以看见有胶状球形或不规则的扩展群。地木耳不耐干旱,在干旱脱水后,藻体呈叶状薄片,易碎裂,潮湿吸水后又呈不规则形的隆起,裂叶状扩展,深绿色。地木耳的藻丝在胶鞘内无规则地排列,在藻体的繁殖发育期有异形胞存在[2]。地木耳是世界广生种,主要分布在石灰石区和喀斯特岩溶地带。在我国几乎都有分布,资源丰富,并且生命力极强,即使休眠几十年,一遇水又马上恢复生机。地木耳一般在夏秋季雨后采收,去杂质洗净,鲜用或晒干[3]。据研究地木耳含有丰富的蛋白质、多糖、维生素、钙、磷、铁等 ,《本草纲目 》记载:地木耳气味甘、平、无毒,主治明目益气,补肾。《中国药典》记载:野生地木耳对补充维生素、蛋白质、清热解毒、凉血明目、夜盲、皮疹赤热等有明显滋补食疗效果。目前对地木耳多糖的研究较少,本实验对地木耳多糖的提取、分离、纯化及纯度鉴定进行了研究,旨在为地木耳的进一步开发利用提供基础数据。
1 材料与方法
1.1 材料与试剂
地木耳于 2009年采自青海省西宁市西山。采回后自来水洗净泥沙,然后用蒸馏水清洗,自然晾干 ,粉碎。
DEAE-52 What man公司;透析袋 (截留量为3000)Whatman公司;无水乙醇、丙酮、石油醚、氯仿、正丁醇、浓硫酸、苯酚、甲苯胺蓝、琼脂糖及巴比妥钠等。
1.2 仪器与设备
DYY-12型电脑三恒多用电泳仪 (水平电泳槽),北京六一仪器厂;721可见光分光光度计,上海仪器厂;电子天平,美国派布洛克公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;循环水式多用真空泵 SHB-III,陕西太康生物科技有限公司。
1.3 方法
1.3.1 地木耳多糖的提取
称取 100 g干燥的粉碎过筛的地木耳粉末,用800 mL 80%乙醇浸泡 24 h去脂[4],用双层纱布过滤。滤渣风干后用 60倍蒸馏水 90℃水浴浸提 5次,每次 3 h,合并提取液,旋转蒸发浓缩,用 Sevage法[5]多次脱蛋白至蛋白质除尽为止,透析,旋转蒸发浓缩,加入 95%乙醇使醇浓度达到 70%,于 4℃冰箱中醇沉过夜,离心,沉淀物依次用无水乙醇,丙酮和石油醚洗涤,在烘箱中 60℃干燥得白色的地木耳精制多糖,备用。
1.3.2 地木耳多糖的分离与纯化
将地木耳精制多糖用蒸馏水配成 3 mg/mL的溶液,5 000 r/min离心 10 min后,取 150 mL进行DEAE-52纤维素阴离子交换色谱层析,用蒸馏水、0.1~0.5 mol/L的 NaCl以 1 mL/min的流速洗脱,每 10 min收集一管,用苯酚 -硫酸法[6]在 490 nm波长处逐管检测。
1.3.3 纯化多糖的纯度鉴定
1.3.3.1 纸层析法[7]新华 2号滤纸,点样量为0.5%纯化多糖水溶液 20μL;展层剂为正丁醇∶浓氨水 ∶水 (40∶50∶5),饱和 2 h,上行层析 ,室温展层6 h,取出后吹干,染色液 0.1%甲苯胺蓝,95%乙醇漂洗至背景褪色,吹干。
1.3.3.2 琼脂糖凝胶电泳[8]胶浓度 0.6%,厚 3 mm;上样液:纯多糖溶液 20μL(10 mg/mL),10%甘油 5μL。指示剂:溴酚蓝。电泳缓冲液:0.075 mol/L巴比妥缓冲液 (pH8.6);电压:110 V,电泳 2 h,染色液 0.1%甲苯胺蓝;脱色液为乙醇∶水∶醋酸=5∶5∶0.1。
1.3.4 地木耳多糖的理化性质
观察地木耳多糖的颜色、状态和溶解情况,并进行化学性质实验,如茚三酮反应,Molish反应、碘 -碘化钾反应、苯酚 -硫酸反应。
1.3.4.1 茚三酮反应 取 1.0 mL多糖水解液(1.0 mg/mL)于试管中,加茚三酮试剂 1.0 mL,在沸水中加热 20 min,冷却后观察。分别取蒸馏水和小牛血清溶液(1.0 mg/mL)1 mL作为对照。
1.3.4.2 Molish反应 取 1.0 mL样品溶液 (1.0 mg/mL)于试管中,然后加 2滴 Molish试剂 (α-萘酚),摇匀。倾斜试管,沿管壁加入约 1 mL浓硫酸,小心竖直后,仔细观察两层液面交界处的颜色变化。以蒸馏水和淀粉(1.0 mg/mL)作为对照。
1.3.4.3 碘 -碘化钾反应 在白瓷板的凹孔中加入 200μL多糖样品溶液 (1.0 mg/mL),滴加碘 -碘化钾溶液 50μL观察颜色的变化。以蒸馏水为阴性对照,0.5%的淀粉指示液为阳性对照。
1.3.4.4 苯酚 -硫酸反应 取 1.0 mL多糖样品溶液 (1.0 mg/mL)置试管中,加 5%的苯酚 -硫酸 600 μL,再加入浓硫酸 625μL,振荡,观察颜色的变化。以蒸馏水为阴性对照。
2 结果与分析
2.1 地木耳多糖的提取
100 g地木耳干粉水提经 7次 Sevage法除蛋白后可得到 13.75 g粗多糖,多糖得率为 13.75%,Sevage法脱蛋白 7次可脱除 94%的蛋白质。
2.2 地木耳多糖的分离与纯化
用DEAE-52纤维素阴离子交换色谱将地木耳多糖不同组分分离:粗多糖溶解上样后,分别用蒸馏水、0.1~0.5 mol/L NaCl梯度洗脱,用苯酚 -硫酸法跟踪检测,洗脱曲线如图1所示。可见,分离效果较好,有明显的 10个洗脱峰,且峰形比较对称,分别代表10个组分 NCP1-10。根据峰面积大小,确定收集含量较多的组分 NCP3、NCP4、NCP5、NCP7,将这些组分合并浓缩,干燥待用。
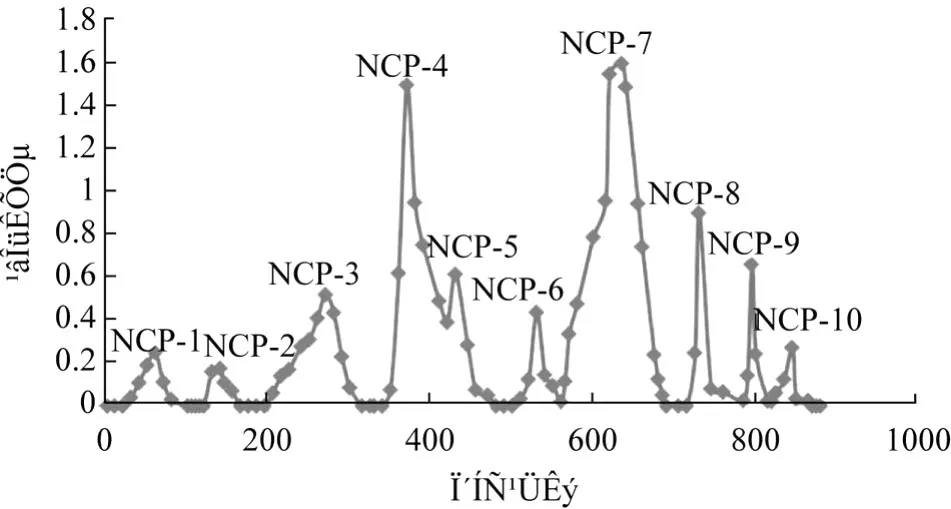
图1 洗脱曲线
2.3 地木耳多糖的纯度鉴定
地木耳多糖洗脱组分经过纸色谱后得到单一斑点,琼脂糖电泳后是单一的条带,而且不同的多糖之间的迁移率不同,从而说明分离纯化的多糖是单一的多糖,而且是不同的多糖。
2.4 理化性质分析
结果显示,Molish反应呈阳性,硫酸 -蒽酮反应呈阳性,说明提取物为多糖;碘 -碘化钾反应呈阴性,说明为非淀粉多糖;茚三酮反应呈阴性,说明样品不含蛋白、多肽或氨基酸。
3 讨 论
(1)多糖广泛存在于植物、动物、微生物 (细菌和真菌)中,来源广泛,其中研究较早的是从细菌中得到的各种荚膜多糖,它在医药上主要用于疫苗生产。近几十年来,人们发现从植物中,特别是具有中国特色的中草药中提取的多糖具有非常重要与特殊的生理活性,这些多糖参与了细胞的各种活动,具有多种多样的生物学功能,如参与生物体的免疫调节功能、降血糖、降血脂、抗炎抗疲劳、抗衰老等[9]。但对于藻类多糖提取、分离纯化及生物活性的研究,国内目前较少报道。
(2)地木耳粉末经过 60倍蒸馏水 90℃热水每次 3 h浸提 5次后,经过 Sevage法脱蛋白后多糖得率为 13.75,这比范群艳[10]等提取地木耳多糖的得率高,究其原因可能是地木耳采自于西北干旱地区,生存环境恶劣,为了抵抗恶劣的生活环境其体内的多糖含量增加;另外,提取次数增多、提取时间延长都能够增加多糖的得率。
(3)多糖脱蛋白的方法有 Sevage法、三氯三氟乙烷法、三氯乙酸法、酶法等。Sevage法条件温和,缺点是效率不高,一次只能去除少量蛋白质,必须重复多次操作 (一般要重复 5~7次左右),才可去除蛋白质,多糖因此而大量损失:三氯三氟乙烷法效率较高,但沸点较低,易挥发,不宜大量使用;三氯乙酸法较为剧烈,往往会引起某些多糖的降解;酶法效率较高,但易使多糖 -蛋白质的复合物分解,造成某些多糖 -蛋白质复合物特有的生理活性降低[11]。本研究选用 Sevage法脱蛋白,实验结果显示,随着脱蛋白次数的增加,地木耳多糖和蛋白质的吸光值均有不同程度的下降,但是随着脱蛋白次数的增加蛋白质的含量逐渐平稳,因此本研究脱蛋白 7次,脱蛋白后,蛋白含量为脱蛋白之前的 6%,多糖损失为脱蛋白前的 86%,基本达到了脱蛋白的目的,如果再进一步脱蛋白多糖损失会加大。
离子交换色谱是通过载体表面带电基团与样品离子和淋洗离子进行可逆交换、离子偶极作用和离子吸附实现色谱分离。不同的多糖在一定 pH条件下,所带电荷不同,则可根据各多糖上电荷的差异而达分离目的,DEAE-纤维素常用作离子交换色谱的柱填充材料,对多糖进行分离纯化。本研究以 DEAE-纤维素为柱填充材料,对提取的地木耳多糖进行纯化,用蒸馏水、0.1~0.5 mol/L NaCl为洗脱剂洗脱后得到 10种洗脱组分,通过纸色谱和琼脂糖凝胶电泳鉴定洗脱组分为单一的多糖组分,从而说明通过离子交换色谱可以对地木耳多糖达到很好的分离效果。
4 结 论
(1)采用水提醇沉法提取地木耳多糖,在用 60倍蒸馏水 90℃水浴浸提 5次,每次 3 h,得率为13.75%,提取液使用 Sevage法脱蛋白 7次可脱除94%的蛋白质,这样可以减少多糖的损失。
(2)在地木耳多糖的分离纯化过程中应选择较为温和的条件,用水和不同浓度 NaC1溶液为洗脱剂,避免剧烈的条件使多糖发生降解。DEAE-52纤维素柱层析柱洗脱后得到 10种多糖组分,各个组分经过纸色谱和琼脂糖凝胶电泳纯度鉴别后均为单一的多糖组分。
[1] 朱浩然.中国淡水藻志:第九卷[M].北京:科学出版社,2007:253.
[2] Potts M,Whitton B A.The Ecology of Cyanobatacteria[M].Netherlands:Kluwer Academic Pubishers,2000:465-504.
[3] 范群艳,吴向阳,仰榴青,等.地木耳的研究进展 [J].常熟理工学院学报,2007,21(4):55-59.
[4] 杨 超,李景恩,邱增辉,等.香薷多糖的提取与纯化研究[J].食品科学,2009,30(18):99-101.
[5] 吴东儒.糖类的生物化学[M].北京:高等教育出版社,1993.
[6] 钟 岩,潘浦群,王艳红,等.苯酚 -硫酸法测定鲜人参中多糖含量[J].时珍国医国药,2008,19(8):1957-1958.
[7] 吕 燕,陈 颢,汪水娟,等.坛紫菜多糖分离纯化和结构分析[J].南京大学学报,2001,37(2):240-245.
[8] 张德华.夏枯草多糖的提取、分离与纯化技术研究[J].生物学杂志,2006,23(3):39-41.
[9] 谭周进,谢达平.多糖的研究进展[J].食品科技,2002(3):10-12.
[10] 范群艳,吴向阳,仰榴青.响应面分析法优化地木耳多糖提取工艺的研究[J].江苏大学学报,2007,17:3:236-240.
[11] 毛 燕,王学利.毛竹叶枝多糖提取的对比研究[J].林产化工通讯,2001,35(2):11-13.
