贵州省3株钩端螺旋体分离株PFGE分型与基因种鉴定*
2011-01-24李世军张翠彩李秀文唐光鹏田克成蔡星和聂一新蒋秀高
李世军,张翠彩,李秀文,唐光鹏,田克成,刘 英,蔡星和,于 春,聂一新,蒋秀高
贵州省3株钩端螺旋体分离株PFGE分型与基因种鉴定*
李世军1,张翠彩2,李秀文2,唐光鹏1,田克成1,刘 英1,蔡星和1,于 春1,聂一新2,蒋秀高2
目的 应用脉冲场电泳(PFGE)分型技术和16S rRNA基因测序分析技术分别对贵州省3株动物宿主钩端螺旋体分离菌株进行分子分型和基因种鉴定,了解贵州省钩端螺旋体的分子流行病学特征。方法应用DNA限制性内切酶No t I对钩端螺旋体染色体DNA酶切后,用PFGE将DNA片段分离,采用BionumericsV 4.0将3株钩体菌株 PFGE图谱与中国15群15型参考菌株进行聚类分析;同时,应用PCR扩增几乎全长的钩体16S rRNA基因片段,并将扩增产物进行双向序列测定,并与 GenBank数据库已注册的核酸序列进行同源性比对、确定基因种、分析亲缘进化关系。结果来自贵州省的3株动物宿主分离钩体菌株PFGE带型命名为LepNo t I 002和LepNo t I 003,经聚类分析,3株菌株与黄疸出血群黄疸出血型赖株的相似性大于95%。16S rRNA基因测序和分析表明,3株贵州分离钩体菌株之间的同源性为100%,与致病性钩体问号钩端螺旋体种(L.interrogans)不同血清型参考菌株的同源性达100%。结论3株贵州动物分离钩体菌株经 PFGE分型鉴定与黄疸出血群赖型赖株的相似性大于95%,经16S rRNA基因测序分析鉴定为L.interrogans种,上述两种方法对贵州省钩体分离菌株的鉴定结果一致,有助于贵州省钩端螺旋体病的主动监测、暴发调查和传染源追踪。
钩端螺旋体;PFGE;16S rRNA;序列分析;同源性;基因种
钩端螺旋体病是一种流行范围十分广泛的自然疫源性疾病,其病原钩端螺旋体(简称钩体)菌型复杂,抗原性各异[1-2]。传统的显微凝集试验(microscopic agglutination test,M A T)和交叉凝集吸收试验(cross-agglutinin absorp tion test,CAA T)常用来鉴定钩体分离菌株,而上述传统鉴定方法局限于对菌株表型进行分析、耗时耗力、且需要收集200多株参考菌株和制备相应的免疫血清[2]。随着研究的不断深入,各种分子生物学技术对病原菌进行分子分型已得到了广泛的应用。PFGE分型技术具有重复性好、分辨力强、易标准化等优点,在发现传染源和预防控制疾病传播方面发挥了重要作用,已有不少学者将PFGE分型技术应用于钩端螺旋体的分型,并取得与传统方法一致的分型鉴定结果[3-7]。此外,细菌的 16S核糖体 RNA(ribosome RNA,rRNA)以其在进化上的特征性序列,现已被广泛用于细菌分类和鉴定的分子指标。其具体操作是,以聚合酶链式反应(PCR)扩增细菌样本中的16S rRNA的基因片段,通过克隆、测序或酶切、探针杂交获得其序列信息,再与16S rRNA数据库中的序列进行比较,确定其在进化中的位置,从而鉴定样本中可能存在的微生物种类[8-9]。Mo rey RE[10]等于2006年将16SrRNA基因测序分析技术应用于钩体基因种的鉴定并证明该方法用于鉴定钩体分离菌株具有可行性。本研究应用PFGE方法对贵州省动物宿主分离的钩体菌株进行了PFGE分型研究,同时,采用16S rRNA基因测序分析技术对3株分离菌株进行了基因种的鉴定,为贵州省钩体分子流行病学研究和钩体病的预防控制提供科学依据。
1 材料与方法
1.1 菌株来源及培养 选择本实验室2007-2009年分离保存的致病性钩体3株,分离自贵州省榕江县监测点斯氏家鼠肾脏。采用 EMJH培养基培养[11],PFGE用分子质量标准参考株为全球通用的沙门菌Braenderup血清型 H9812株,由中国疾病预防控制中心钩体室提供。
1.2 主要试剂 限制性核酸内切酶 N ot I为大连宝生物工程公司(TaKaRa)产品,蛋白 K为德国Merck公司产品,琼脂糖(SeaKem Gold)为美国BMA公司产品,溴化乙锭为美国Sigma公司产品,钩体 EMJH培养基为美国BD公司产品,DNA Marker为经标准化方法提取和 Xba I酶酶切后的沙门菌 H9812株DNA产物,其它试剂均使用分析纯试剂。PCR PreM ix 20(l反应体系为北京赛百盛基因技术有限公司产品;100 bp DNA Marker为天根生物工程公司产品;硅胶膜型TM基因组DNA提纯试剂盒为北京赛百盛基因技术有限公司产品;实验中所用引物由上海生工生物工程技术服务有限公司合成。
1.3 主要仪器 冷冻离心机为 KR 22i型(JOUAN,法国),比浊管为 REF352054 型(BD,美国),水浴摇床为OLS2000型(Grant,英国),细菌浊度仪为Densimat型(BioMérieux,法国),脉冲场凝胶电泳仪为CHEF DR Ⅲsystem型(Bio-Rad,美国),凝胶成像系统为 Gel Doc 2000型(Bio-Rad,美国)。PCR仪为SENS U EST梯度 PCR仪(德国)。
1.4 PFGE分型分析方法 PFGE操作方法依据参考文献[5]。
1.5 16S rRNA基因序列分析方法
1.5.1 钩体DNA提取 采用DNA提取试剂盒。按照说明书操作。
1.5.2 引物合成 参照参考文献[10]提供的引物序列,引物序列由大连宝生物公司合成,上、下游引物序 列 如 下:fD1:5’-CCGAA TTCGTCGACAACAGAGTTTGA TCCTGGCTCAG-3’; rP2:5’-CCCGGGA TCCAAGCTTACGGCTACCTTG TTACGACTT-3’。
1.5.3 PCR反应体系 各 PCR反应体积为50 μL,内含 1ng/μL 的 DNA 模板 8μL、5μmol/L 引物各4μL、dN TP 4μL、TaKaRa TaqTMDNA 聚合酶1μL、10 ×buffer 5μL、H2O 24μL。
1.5.4 PCR反应参数 94℃预变性 5 min;94℃15 s、50℃5 s、72℃90 s,共 35 个循环;72℃延伸5 min。
1.5.5 PCR产物检测 取5μL产物采用1.2%琼脂糖凝胶85 V电泳30 min后凝胶成像系统拍照。1.5.6 DNA序列的测定与分析 将PCR产物委托北京擎科新业生物技术有限公司进行双向测序,测序序列文件的拼接、编辑使用Contig、DNAStar软件;序列同源性比对在 GenBank数据库中进行。
2 结 果
2.1 钩体菌株PFGE型 3株钩体菌株经限制性内切酶 N ot l酶切及 PFGE后,产生不同条带的PFGE带型的图谱,共分为2个 PFGE型,其中 G30和 G31菌株的PFGE图谱产生12条带,属于Lep-Not I 003型。G32菌株产生13条带,属LepNot I 002(见图 1)。
2.2 钩体菌株PFGE谱型聚类分析 以相似性>75%作为同类株的判断标准,3株钩体菌株 PFGE带型与PulseNet China数据库中国流行的15群15型钩体参考菌株的PFGE图谱进行聚类分析,G30和G31菌株与中国主要流行的黄疸出血群赖型赖株(中国编号为56601)PFGE谱型相似性为100%,G32菌株与中国主要流行的黄疸出血群赖型赖株相似性约为95%(如图2)。
2.3 钩体菌株16S rRNA基因PCR扩增结果 经PCR扩增,3株钩体分离菌株16SrRNA基因均扩增出预期1 432 bp大小的片段,结果见图3。

图1 贵州省钩体分离株PFGE图Fig.1 PFGE maps of Leptospira strains isolated in Guizhou Province M:DNA Marker;1:G30(LepNot I.003);2:G31(LepNot I.003):3:G32(LepNot I.002)
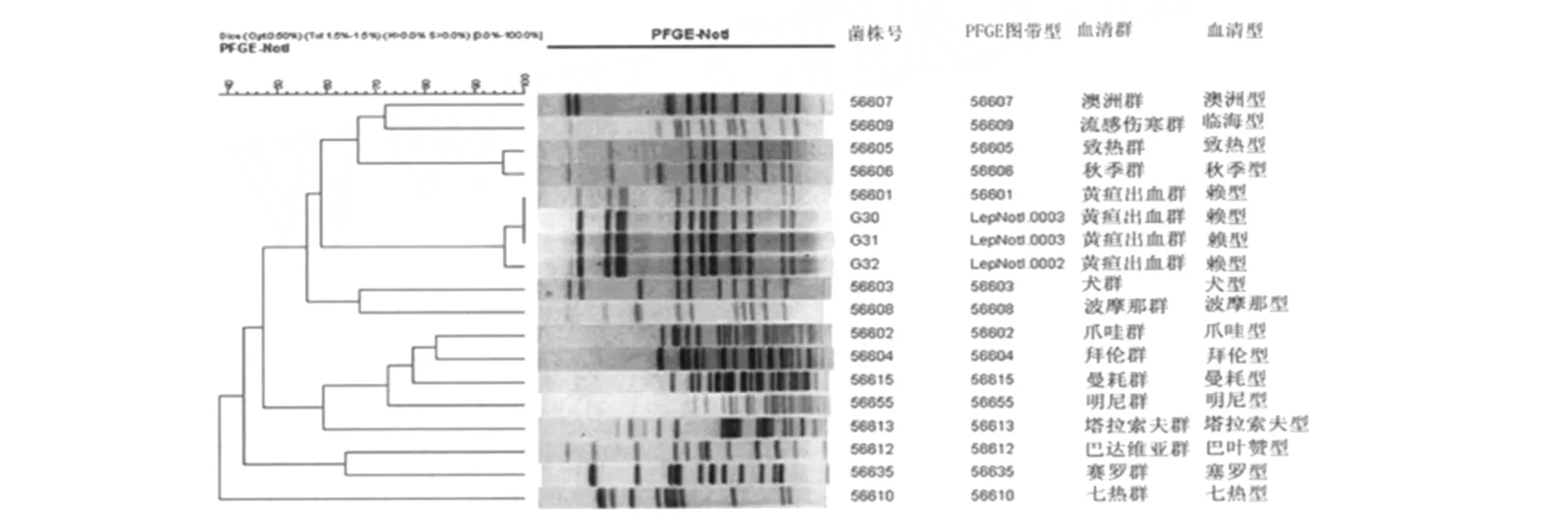
图2 贵州省钩体分离菌株与问号钩体代表菌株聚类分析图Fig.2 Dentrogram of PFGE profiles of isolated Leptospira strains from Guizhou Province and reference strains belonging to 15 serovar 15 serogroups of L.interrogans

图3 贵州省钩体分离菌株16S rRNA基因PCR检测结果Fig.3 PCR detection resultsof 16S r RNA gene of Lep tospira strains isolated from Guizhou province M:DNA Marker;1:G30(LepNot I.003);2:G31(LepNot I.003);3:G32(LepNot I.002);4 Serovar-groups Icterohaemo rrhagiae Serovar Lai strain Lai(strain 56601)
2.4 钩体菌株16S rRNA基因序列分析 3株钩体分离菌株16S rRNA基因扩增产物经测序获得的序列与GenBank数据库收录的钩体16S rRNA基因序列比对,结果3株钩体16S rRNA基因的扩增序列与致病性钩端螺旋体分支下属的问号钩端螺旋体种(Lep tospira interrogans)所包含血清型(如Lep tospira interrogans serovar Icterohaemorrhagiae,Leptospira interrogans serovar Australis,Lep tospira interrogans serovar Autum nalis,Leptospira interrogans serovar Bulgarica,Leptospira interrogans serovar Canicola,Lep tospira interrogans serovar,Leptospira interrogans serovar,Lep tospira interrogans serovar Copenhageni,Leptospira interrogans serovar Hardjo,Leptospira interrogans serovar Pomona,Lep tospira interrogans serovar Pyrogenes等)代表菌株的16S rRNA基因核苷酸序列同源性为100%,而与其它种如 Lep tospira alexanderi,Lep tospira borgpetersenii和Leptospira noguchii等基因种代表菌株16S rRNA核苷酸序列同源性为99%,根据Morey RE等[10]的研究结果判断,上述3株钩体分离菌株均属L.interrogans种。
3 讨 论
钩体病是一种全世界广泛流行的人畜共患的传染病,至今我国已发现致病性钩体有18个血清群76个血清型。钩体常用的分类法为血清学分类法和基因分类法。血清学分类法是以O抗原为主要靶抗原的分类法,通过交叉凝集吸收试验将钩体分成不同血清型。然而,交叉凝集吸收试验需要多种抗血清,操作繁琐、耗时且难以实现标准化。随着分子生物学技术的发展和微生物基因组测序工作的进展,近年国际上在细菌分类学中出现以基因序列为基础的分型方法,PFGE图谱分析和16S rRNA基因分析是较为常用的方法[7-8]。
Herrmann等[13]于1992年将 PFGE用于钩体分型,结果显示钩体菌株PFGE图谱分析与血清学分型结果具有一致性。蒋秀高等[14]于2001年采用PFGE法检测了中国15群15型15株钩体参考菌株,发现各参考菌株PFGE图谱各具特征性。Galloway和Lever[4]于2008年用改进的PFGE法检测206株钩体,也证明了钩体菌株的 PFGE分类与血清学分类结果一致。
此外,不同血清群可显示不同的PFGE带型特点,同一血清群钩体 PFGE谱型相似性则明显较高。辛晓芳等[15]于2001年发现,PFGE图谱能有效分辨中国流感伤寒群不同血清型钩体参考株。秦进才等[16]证明传统的血清学分类法与 PFGE法鉴定新血清型钩体的结果完全一致。上述资料表明,PFGE用于钩体分型有较高特异性,其分型结果不仅能与血清学分类相吻合,还可体现钩体基因的多态性并有利于遗传分类学鉴定。本研究中的3株贵州钩体分离株经 PFGE分析分为LepNot I 002和LepNot I 003 PFGE型,经与国内钩体15群15型参考菌株聚类分析,LepNot I003 PFGE型(G30和G31株)与黄疸出血群赖型赖株(国内编号56601)的相似性为100%,LepNot I002 PFGE型(G32株)与黄疸出血群赖型赖株(国内编号56601)的相似性约为95%,以相似度大于75%的标准[7]判定,G30、G31和G32 3株分离菌株同属黄疸出血群赖型。此次检测中,虽检测样本有限,且按75%的相似度判定同为黄疸出血群赖型,但3株菌株由于条带差异却属于两个不同的PFGE型,这体现了PFGE具有高分辨率的特点。
贵州省黔东南地区是钩体病的老疫源地,该地区每年均有数例钩体病例发生,本研究中的钩体菌株分离自该地区榕江县监测点的鼠肾,我们参考张艳,蒋秀高等建立的钩体PFGE实验程序对所分离3株钩体菌株进行PFGE分型鉴定,PFGE图谱与我国15群15型参考菌株的聚类分析结果表明3株分离株与黄疸出血群赖型赖株的相似性最高(>95%),提示钩体黄疸出血群赖型可能是该地区的流行菌型。
传统的血清学分类方法将钩端螺旋体分为致病性的问号钩端螺旋体(L.interrogans)和双曲钩端螺旋体(L.bif lexa)[1-2]。16S rRNA为原核生物核糖体中的一种核糖体RNA,以该基因为基础建立的分子分类方法目前已被国际学术界广泛认可,而以基于该基因的DNA-DNA杂交技术为基础的分类方法将钩端螺旋体属分为17个基因种[17-18],其中的某些基因种包括致病与非致病的血清型,这与传统的血清学分类方法有所不同。Morey RE等采用16S rRNA全长基因测序技术结合系统进化分析鉴别涵盖17个种的钩端螺旋体菌株,将钩端螺旋体分为致病性、非致病性和未知致病性的3大分支(即pathogenic,nonpathogenic,intermediate clade),其中致病性的包括8个种,非致病性的包括6个种,未知致病性的包括3个种。根据Morey RE的研究结果,同一种内不同血清型菌株之间16S rRNA基因序列的平均差别碱基对数目仅为0.2对(测序长度约为1 430个碱基),同一分支内不同种的钩体菌株16S rRNA基因序列的差别碱基对数目为几个至十几个,来自不同分支内的种间差别碱基对数目为几十至几百之间[10]。本研究的 G30,G31和 G32菌株16S rRNA基因序列的测序长度分别为1413,1360,1349,3株菌株16S rRNA基因序列的同源性为100%,根据Mo rey RE的结果,与致病性钩体分支内L.interrogans种内的不同血清型代表菌株16S rRNA基因序列的同源性为100%,而与该分支内的其他种的同源性为99%,即与该分支内的其它种的差别碱基对数目相差为1%(G30,G31和 G32菌株的差别碱基数分别为14.13,13.60,13.49个),上述资料提示,本研究中3株钩体分离菌株属于L.interrogans种。
本研究从分子生物学角度对贵州省钩体分离菌株进行PFGE分型,结果显示所分离的3株钩体菌株属于黄疸出血群赖型赖株。基于16S rRNA基因测序技术的分析对分离菌株进行种的鉴定结果显示为致病性钩体分支的问号钩体种(L.interrogans),这将为贵州省钩体病的分子流行病学研究提供依据,有利于今后钩体分离菌株的比对和分析。然而,由于分离菌株数量有限,要更深入地阐述贵州省钩体菌型分布与流行特征还需要更进一步研究。
[1]严杰,戴保民,于恩庶.钩端螺旋体病学[M].3版.北京:人民卫生出版社,2006:20.
[2]Bharti AR,Nally JE,Ricaldi JN,et al.Leptospirosis:a zoonotic disease of global importance[J].Lancet Infect Dis,2003,3(12):757-771.
[3]Romero EC,Blanco RM,Galloway RL.Application of pulsedfield gel electrophoresis for the discrimination of leptospiral isolates in Brazil[J].Lett Appl Microbiol.2009,48(5):623-627.
[4]Gallow ay RL,Levett PN.Evaluation of a modified pulsed-field gel electropho resis app roach for the identification of Lep tospira serovars[J].Am J Trop M ed Hyg,2008,78(4):628-632.
[5]张艳,郭宗琪,李秀文,等.钩端螺旋体脉冲场凝胶电泳标准化技术的建立及谱型特征初步分析[J].中华流行病学杂志.2007,28(8):772-775.
[6]郭宗琪,黄自英,陈娜,等.四川省致病性钩端螺旋体脉冲场电泳分型分析[J].预防医学情报杂志.2007,23(6):644-646.
[7]徐建民,蒋秀高,李秀文,等.江西省钩端螺旋体分离株脉冲场凝胶电泳分型和分析[J].中华流行病学杂志,2010,4(31):434-437.
[8]刘文强,贾玉萍,赵宏坤.16S rRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006,27(11):15-18.
[9]Woo PC,Lau SK,Teng JL,et al.Then and now:use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laborato ries[J].Clin Microbiol Infect,2008,14(10):908-934.
[10]Morey RE,Galloway RL,Bragg SL,et al.Species-specific identification of Lep tospiraceae by 16S rRNA gene sequencing[J].J Clin Microbiol,2006,44(10):3510-3516.
[11]Merien F,Baranton G,Perolat P.Invasion of vero cellsand induction of apoptosis in macrophages by pathogenic Lep tospira interrogans are correlated with virulence[J].Infect Immun,1997,65:729-738.
[12]el-AdhamiW,Roberts L,Vickery A,et al.Epidemiological analysis of amethicillin-resistant Staphylococcus aureusoutbreak using restriction fragment length polymorphisms of genomic DNA[J].J Gen Microbiol,1991,137(12):2713-2720.
[13]Herrmarm JL,Bellenger E,Perolat,et al.Pulsed.field gel eleclrophoresis of Not Idigests ofleptospiral DNA:a new rapid method of scrovar identification[J].J CIin Microbiol,1992,30:1696-1702.
[14]蒋秀高,肖玉春,聂一新,等.致病性钩端螺旋体脉冲场凝胶电泳图谱分型研究 [J].中华微生物学和免疫学杂志,2001,21(4):378-381.
[15]辛晓芳,蒋秀高,秦进才.流感伤寒群钩端螺旋体各型参考菌株的抗原分析及待检菌株的检定 [J].中国人兽共患病杂志,2001,17(5):83-85.
[16]秦进才,陈明华,蒋秀高,等.曼耗群钩端螺旋体的一个新血清型—贺岩型 [J].中国人兽共患病杂志,2004,20(6):474-476.
[17]Brenner DJ,Kaufmann AF,Sulzer KR,et al.Further determination of DNA relatedness between serogroups and serovars in the family Leptospiraceae with a proposal for Leptospira alexanderi sp.nov.and four new Lep tospira genomospecies[J].Int J Syst Bacteriol,1999,49:839 858.
[18]Ramadass P,Jarvis BD,Corner RJ,et al.Genetic characterization of pathogenic Lep tospira species by DNA hybridization[J].Int J Syst Bacteriol,1992,42:215 219.
Lep tospira inter rogans isolates by pulsed-field gel electrophoresis typing and genospecies identification in Guizhou Province
L IShi-jun,ZHANG Cui-cai,L IXiu-wen,TANG Guang-peng,TIAN Ke-cheng,L IU Ying,CA IXing-he,YU Chun,Nie Yi-xin,JIANG Xiu-gao
(Institute for Comm unicable D isease Control and Prevention,Guizhou Provincial Centers for Disease Control and Prevention,Guiyang 550004,China)
The aim of the study was to perform amolecular epidemiological investigation on the Leptospira isolates from animal hosts in Guizhou p rovince by using pulsed-field gel electrophoresis(PFGE)molecular typing and 16S rRNA gene sequencing based species-specific identification.The extracted chromosomal DNA from lep tospiral isolates were digested with restriction endonuclease No t Iand the DNA segments were separated by using PFGE.By BioNumerics V 4.0 software and 75%similarity as the standard,theobtained PFGE images from lep tospiral isolatesweremanaged and then the PFGEmapsof lep tospiral isolates were compared with those of reference strains belonging to l5 Serovar l5 serogroupsof L.interrogans for cluster analysis.Besides,species-specific identification of those three Lep tospira isolates were performed by 16S rRNA gene sequencing and analysis.PFGE analysis indicated that 3 strainsof L.interrogans from Guizhou p rovincewere classified in to two PFGE types,and both of the two PFGE types belonged to the Serovar-groups Icterohaemorrhagiae Serovar Lai strain Lai.16S rRNA gene sequencing and analysis demonstrated the sequencesof 16S rRNA gene of the 3 strainswere identical,with homogeny as 100%.And the homogeny of 16S rRNA gene between the three isolated strains and Leptospira reference strains of different serovar types contained in L.interrogans species was 100%.The results revealed that 3 strains of L.interrogans isolated from Guizhou p rovince belonged to Serovar-groups Icterohaemo rrhagiae Serovar Lai,and belonged to L.interrogans genospecies.The identification results of PFGE typing are consistent with that of 16S rRNA analysis.It would contribute to the active surveillance,investigation of outbreak and sourcetracking for lep tospirosis in Guizhou p rovince.
L.interrogans;PFGE;16S rRNA;sequence analysis;homogeneity;genospecies
R378.5
A
1002-2694(2011)07-0587-05
*贵州省优秀科技教育人才省长专项资金项目(No.黔省专合字(2010)90号)与贵州省疾病预防控制中心青年科学基金项目(No.2009-(青2)-2)联合资助(李世军与张翠彩同等贡献)
蒋秀高,Email:Jiangxiugao@icdc.cn
1.贵州省疾病预防控制中心传染病防治研究所,贵阳
550004;
2.中国疾病预防控制中心传染病预防控制所钩端螺旋体病室,北京 102206
2010-08-29;
2011-03-20
