例析“变量控制思想”的实验考查
2011-01-08王萍华
王萍华
(江苏省镇江市实验高级中学 江苏 镇江 212003)
例析“变量控制思想”的实验考查
王萍华
(江苏省镇江市实验高级中学 江苏 镇江 212003)
本文通过具体的实验考题,让学生了解变量控制思想的基本原理、结果处理和实验设计,将有助于学生进一步体验实验探究的基本过程,认识变量控制思想在化学科学研究和化学学习中的重要作用。
变量控制思想;实验;高考
化学是一门以实验为基础的学科,很多的化学理论都是从实验中总结得出的。然而,一个实验的结果往往受到很多因素的影响,这些并非单一的因素它们相互交错、共同作用,很容易干扰对实验探究的准确把握。因此,如何在研究过程中化繁为简,突出主要因素,创设“理想”的探究环境,有利于探究实验的目的,则显得尤为重要。针对具有这种特征的探究性问题,控制变量思想无疑是一种很好的探究思想。
控制变量思想作为科学探究的一种重要思想,受到新课程高考命题的关注。近2年的新课程高考对控制变量法的一般程序、结果的处理以及通过处理结果获得结论的信息加工能力进行了全方位的考查,在一定的实验情境中考查了学生对控制实验条件方法的掌握程度和运用能力。
本文通过具体的实验考题,让学生了解变量控制思想的基本原理、结果处理和实验设计,将有助于学生进一步体验实验探究的基本过程,认识控制变量思想在化学科学研究和化学学习中的重要作用。
一、“变量控制思想”实验的基本原理
【例1】某探究小组设计了如下实验。其实验目的是什么?
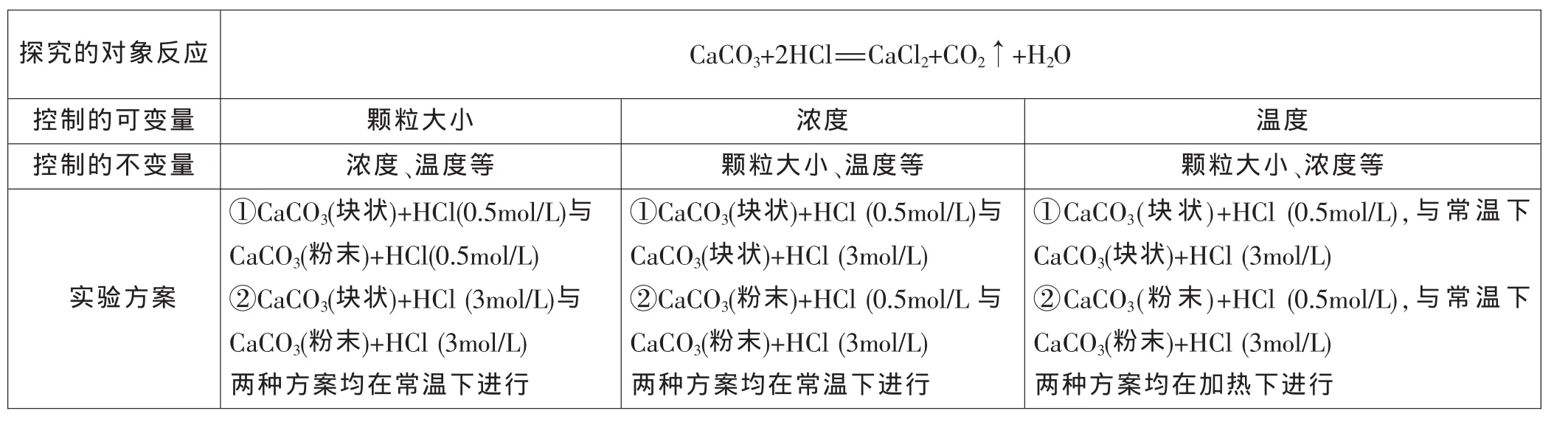
探究的对象反应 C a C O 3+2 H C l=C a C l 2+C O 2↑+H 2 O控制的可变量 颗粒大小 浓度 温度控制的不变量 浓度、温度等 颗粒大小、温度等 颗粒大小、浓度等实验方案①C a C O 3(块状)+H C l(0.5 m o l/L)与C a C O 3(粉末)+H C l(0.5 m o l/L)②C a C O 3(块状)+H C l(3 m o l/L)与C a C O 3(粉末)+H C l(3 m o l/L)两种方案均在常温下进行①C a C O 3(块状)+H C l(0.5 m o l/L)与C a C O 3(块状)+H C l(3 m o l/L)②C a C O 3(粉末)+H C l(0.5 m o l/L与C a C O 3(粉末)+H C l(3 m o l/L)两种方案均在常温下进行①C a C O 3(块状)+H C l(0.5 m o l/L),与 常 温 下C a C O 3(块状)+H C l(3 m o l/L)②C a C O 3(粉末)+H C l(0.5 m o l/L),与 常 温 下C a C O 3(粉末)+H C l(3 m o l/L)两种方案均在加热下进行
解析:对化学实验结果有影响的因素有多种可能,如何确定哪些因素有影响、影响的程度怎样?实验时,往往先控制其他几个因素不变,集中研究其中一个因素变化所产生的影响,依次类推,对有关因素逐个加以判断,就能找出影响实验结果的所有因素,这种思想称为“变量控制思想”。
所谓“变量”,通常可分为实验变量与反应变量。实验变量也称自变量,指实验中由实验者所操纵的因素或条件。反应变量,亦称因变量,指实验中由于实验变量而引起的变化和结果。通常,实验变量是原因,反应变量是结果,两者具有因果关系。“变量控制思想”的实验目的在于获得和解释这种前因后果。
本题主要考查通过对分组实验结的观察记录、比较分析,探究影响反应速率的因素,即“变量控制思想”实验中的自变量。
二、“变量控制思想”考题的结果处理
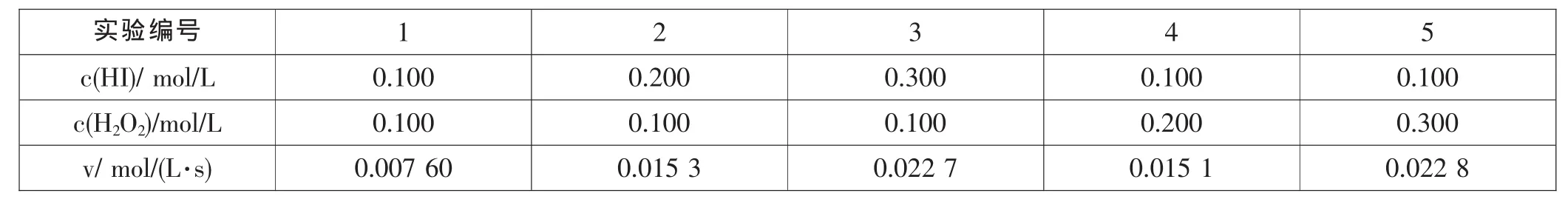
实验编号 1 2 3 4 5 c(HI)/mol/L 0.100 0.200 0.300 0.100 0.100 c(H2O2)/mol/L 0.100 0.100 0.100 0.200 0.300 v/mol/(L·s) 0.007 60 0.015 3 0.022 7 0.015 1 0.022 8
A.0.038 0 mol/(L·s) B.0.152 mol/(L·s)
C.0.608 mol/(L·s) D.0.760 mol/(L·s)
解析:实验后,需要将测量得到的原始数据,通过科学方法的处理,才能得到正确的客观实验规律。图表法是实验数据处理的常用方法,包括列表法和作图法。本题采用的就是列表法,将从实验中得到的数据按照一定的规律排列成表格,它的优点是能使物理量之间的对应关系清晰、明了,有助于我们从中发现实验中的规律。本题主要考查通过“变量控制思想”实验结果的处理。
答案:分析表中数据可知,反应速率与HI和H2O2浓度的乘积成正比,据此计算可得B项正确。
三、“变量控制思想”考题的实验设计
【例3】(2010年全国课标卷题28) 为了进一步研究硫酸铜的量对氢气生成速率的影响(指在硫酸溶液加入硫酸铜的量对锌与硫酸反应产生氢气速率的影响---笔者注)该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
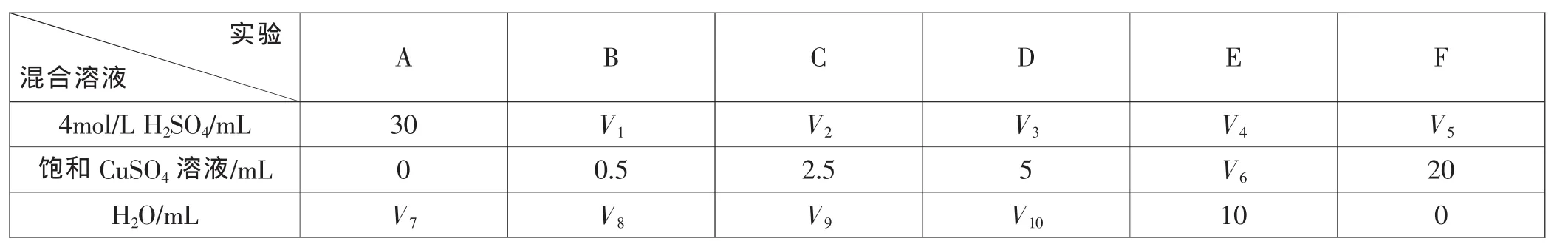
实验混合溶液4 m o l/L H 2 S O 4/m L饱和C u S O 4溶液/m L H 2 O/m L A 3 0 0 V 7 B C D E F V 1 V 2 V 3 V 4 V 5 0.5 2.5 5 V 6 2 0 V 8 V 9 V 10 1 0 0
①请完成此实验设计,其中:V1=_____,V6=_____,V9=_____;
②反应一段时间后,实验A中的金属呈_____色,实验E中的金属呈_____色;
③该同学最后得出的结论为:当加入少量溶液时,生成氢气的速率会大大提高。但当加入的溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____。
解析:试题设计的实验情景是:通过一系列实验研究硫酸铜的量对氢气生成速率的影响。由于该反应生成氢气的速率,受硫酸的浓度、用量,锌粒纯度、表面积,硫酸铜溶液的浓度、用量等因素的影响。因此,考生必须明白,为研究硫酸铜的量对氢气生成速率的影响,必须依据实验目的,控制实验条件(控制变量)。在实验中只能允许改变硫酸铜的量,保持其他条件不变,才能较快地揭示硫酸铜的量与氢气生成速率的关系。
依题设,硫酸、硫酸铜浓度是定值,题设没有说明锌粒规格、实验的温度、压强。可以认为都是基本相同的。因此,实验中必须保持除硫酸铜用量外的其他量不变,并有规律地改变硫酸铜用量。据此,要保持加入的硫酸溶液体积不变、反应溶液总体积不变,并逐步按题设示意的规律,增加硫酸铜用量。由此,可以推断V1=30,V6=10,V9=17.5。
试题的最后一小题,从反应实际出发,指出在使用硫酸铜的量超过一定数值时,生成氢气的速率就不再服从随加入的溶液增加而大大提高的规律。要求考生说明原因。这一小题,确实是帮助考生进一步理解“变量控制思想”的点睛之笔。
【例4】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。请完成以下实验设计表(表中不要留空格)。
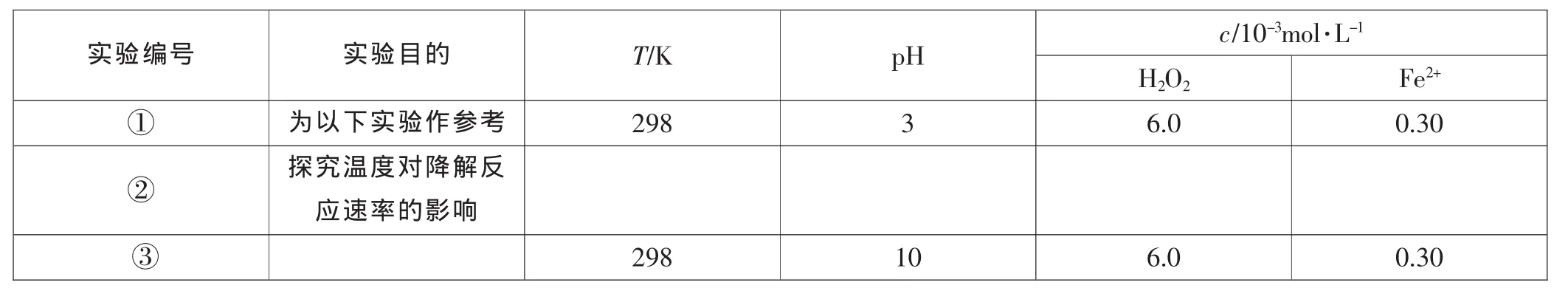
实验编号 实验目的 T/K p H c/1 0-3 m o l·L-1 H 2 O 2 F e 2+①为以下实验作参考 2 9 8 3 6.0 0.3 0②探究温度对降解反应速率的影响③2 9 8 1 0 6.0 0.3 0
解析:实验①是参照实验,所以与实验①相比,根据控制变量思想,实验②和③只能改变一个条件,已知实验②是探究温度对反应速率的影响,则T=313K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,与实验①相比,实验③显然是探究pH的大小对反应速率的影响。
答案:②313 3 6.0 0.30 ③探究pH的大小对反应速率的影响。
控制变量思想是中学化学实验中常用的思想方法,对影响实验结果的因素进行控制,以达到明确各因素在实验中意义的目的。尤其是在研究影响化学反应速率和化学平衡的因素时,由于外界影响因素较多,故为弄清某个因素的影响均需控制其他因素相同或不变时,再进行实验。因此,变量控制思想在这部分体现较为充分,在高考题中近几年也考查较多,且多以探究型实验题的形式出现。这类题目以实验为研究手段,模拟科学探究过程对小课题展开研究。尽管涉及因素较多,有其复杂性,但仍然重在考查学生基础知识和基本技能、学生分析能力和实验能力。
[1]陈益.例谈新课程高考“变量控制法”实验的考查[J].化学教育,2009,(2)
1008-0546(2011)07-0087-02
G633.8
B
10.3969/j.issn.1008-0546.2011.07.041
