纳米二氧化钛的毒性研究与安全性展望
2011-01-06刘晓闰唐萌
刘晓闰,唐萌
(环境医学工程教育部重点实验室,东南大学公共卫生学院,江苏省生物材料与器件重点实验室,江苏南京 210009)
近年来,随着纳米技术的兴起和快速发展,纳米材料越来越广泛地应用于机械化工、信息技术、环境保护、生物医学等社会生活的各个领域,环境中天然存在的纳米颗粒和人造的纳米颗粒污染也越来越多,由图1[1]可以看出,从原料开采、产品的生产到使用中的磨损和消耗,都会造成纳米颗粒在环境中的释放,引起职业人群、普通人群乃至整个生态系统的暴露。众所周知,在纳米尺度下,由于纳米材料尺寸在1~100 nm之间,它具有特有的小尺寸效应、表面效应、量子尺寸效应及宏观量子隧道效应等,从而呈现出既不同于其分子形式、也不同于其宏观大块材料的物理化学性质[2]。这些小尺寸的纳米材料与生物体中的细胞或蛋白质分子尺寸相当,甚至更小,但它们所产生的化学和生物效应与其化学成分相同的常规材料会有很大不同。所以,人们普遍担心纳米颗粒进入生物体后,可表现出特殊的生物学性质,产生某些特殊的毒性[3]。在应用纳米材料的同时,人们也在更多地关注纳米材料对人类健康和环境可能产生的影响[4-5]。目前,已经有一大批科学家把纳米材料的生物安全性问题研究提上了日程[6]。
纳米TiO2由于具有良好的热稳定性、耐化学腐蚀性和光学催化特性等,目前已被大力地开发生产和应用,是目前国内产量最高、需求最大、应用领域最广泛的纳米材料之一。纳米TiO2广泛用于涂料(48%)、塑料(19%)、树脂(10%)、造纸(8%)、纤维(3%)、橡胶(2%)、其他(10%)如废水处理、杀菌[7]、医药[8]、日化、食品、陶瓷、化妆品[9]等与人们的日常生活息息相关的行业[10],纳米TiO2的大量生产及其在众多领域的广泛应用,使得我们不可避免地大量接触纳米TiO2,因此其毒性也得到越来越广泛的关注。虽然到目前为止有关其毒性研究的相关资料已经有很多,但还没有关于纳米TiO2流行病学方面的研究,而且大多研究只侧重某一种暴露途径或对某个特定部位产生的影响,缺乏各种不同暴露途径的体内外毒性研究的对比数据,对其生物安全性尚未进行较为全面系统的评价。本文分别从体内、体外多种暴露途径对纳米TiO2的生物毒性进行综述,为综合开发利用纳米TiO2提供有价值的参考。
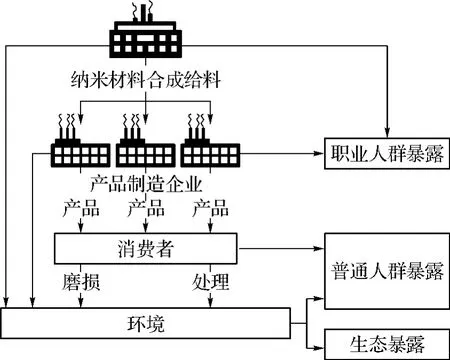
图1 纳米材料潜在的释放和暴露[1]
1 纳米二氧化钛的表征
纳米材料的纯度、物理化学性能、表面性能及其微观结构特征参数在研究纳米材料与生物体的相互作用中有着非常重要的作用。这些特征参数与材料的组成和性能之间的关系为预测材料在生物体内的行为及判断其与生物环境的相互作用、作用方式提供了依据。因此,研究纳米材料表征对认识纳米材料的特性、推动纳米材料的应用有着重要的意义[11]。
1. 1 纳米材料的粒度分析
近年来发展的粒度的分析方法有激光散射法、光子相干光谱法、激光衍射法、电子显微镜图像分析法、基于布朗运动的粒度测量法和质谱法等。其中激光散射法和光子相干光谱法由于具有测量范围广、数据可靠、速度快、重现性好、自动化程度高等优点而被广泛应用[12]。
1. 2 纳米材料的形貌分析
纳米材料常用的形貌分析方法主要有扫描电子显微镜(scanning electron microscopy,SEM)、透射电子显微镜(transmission electron microscopy,TEM)、扫描隧道显微镜(scanning tunneling microscopy,STM)、原子力显微镜(atomic force microscopy,AFM)法。SEM可以提供从数纳米到毫米范围内的形貌图像。TEM具有很高的空间分辨能力,特别适合粉体材料的分析。STM主要用于一些特殊导电固体样品的形貌分析,可以达到原子量级的分辨率,仅适合具有导电性的薄膜材料的形貌分析和表面原子结构分布分析,对纳米粉体材料不能分析。AFM可以对纳米薄膜进行形貌分析,分辨率可以达到几十纳米,比STM差,但适合导体和非导体样品,不适合纳米粉体的形貌分析。
1. 3 纳米材料的成分分析
纳米材料的成分分析方法按照分析目的不同又分为体相元素成分分析、表面成分分析等方法。纳米材料的体相元素组成及其杂质成分的分析方法包括原子吸收、原子发射、X射线荧光与衍射分析方法。纳米材料的表面分析方法目前最常用的有X射线光电子能谱法(X-ray photelectron spectroscopy,XPS)、俄歇电子能谱法(Auger electron spectroscopy,AES)、电子衍射分析方法和二次离子质谱法(secondary ion mass spectroscopy,SIMS)等。
1. 4 纳米材料的结构分析
随着分析仪器和技术的不断发展,纳米材料结构研究所能够采用的实验仪器越来越多,包括高分辨电子显微镜(high-resolution transmission electron microscopy,HRTEM)、扫描探针显微镜(scanning probe microscopy,SPM)、STM、AFM、场离子显微镜(field ion microscopy,FIM)、X 射线衍射仪(X-ray diffraction,XRD)、扩展X射线吸收精细结构测定仪(extended X-ray absorption fine structure,EXAFS)、穆斯堡尔谱仪、拉曼散射仪等。可以认为,纳米结构的研究方法几乎已经涉及全部物质结构分析测试的仪器。
1. 5 纳米材料表面与界面分析
目前,常用的表面和界面分析方法有:X射线光电子能谱法(XPS)、AES、静态 SIMS和离子散射谱(ISS)。在这些表面与界面分析方法中,XPS的应用范围最广,可以适合各种材料的分析,尤其适合材料化学状态的分析,更适合涉及到化学信息领域的研究。
2 纳米二氧化钛的化学修饰
纳米材料的生物学效应受其粒径、晶型、表面化学特性(如极性等)、组成及表面反应活性等因素的影响[13](图2),如纳米材料物质表面的亲水性质及表面修饰将影响其与细胞膜的作用和细胞对颗粒物质的摄入从而影响其对机体的生物学作用。纳米生物效应的研究结果给化学领域提出了新的研究方向——降低乃至消除纳米毒性的化学修饰。对毒性较高的纳米分子进行化学修饰,在保持其功能特性的同时消除其毒性,目前,已经开始这方面的相关研究。
TiO2表面修饰分有机修饰和无机修饰两种,有机修饰包括偶联剂法、表面活性剂法和聚合物包覆法等,无机修饰包括 SiO2、Al2O3、Fe(OH)3、ZnO 包覆和复合包覆(硅铝复合包膜)法等。Warheit等[14]利用Al2O3、SiO2等对纳米TiO2颗粒进行表面修饰,发现可以提高颗粒的分散度、减小紫外线对颗粒的损害作用,而且表面修饰会影响TiO2颗粒所致肺毒性,TiO2表面修饰物的浓度也会对毒效应产生影响。
吴佐全[15]将纳米TiO2薄膜表面修饰聚甲基丙烯酸甲酯(PMMA)人工晶状体(IOL)植入兔眼,研究其对兔晶状体后囊膜混浊抑制作用的有效性,发现TiO2薄膜表面修饰的PMMA IOL能减少术后前房渗出等炎症反应,且减轻后囊膜混浊的程度,对后发性白内障起到防治作用,无眼内毒性且对眼内组织无损伤。因此,对纳米TiO2的有效修饰可以在降低其毒性的同时发挥它特有的作用。

图2 纳米材料与生物体的可能作用机制[13]
3 纳米二氧化钛的毒性研究
3. 1 纳米二氧化钛的体内毒性研究
纳米材料可通过多种方式进入人体[16](图3),TiO2纳米材料主要通过呼吸道、消化道、皮肤和注射等方式进入人体,从而对机体的组织器官发生作用。因此,本研究选取了四种典型的暴露途径进行纳米TiO2的体内毒性研究。

图3 纳米物质进入人体的主要途径[16]
3.1.1 吸入暴露途径 纳米TiO2粒子粒径极小,可通过简单扩散或渗透等形式经过肺泡和皮肤进入体内。Oberdorster等[17]用粒径为20和200 nm 的 TiO2颗粒进行了为期12周的大鼠亚慢性吸入实验,发现两组大鼠的下呼吸道均出现TiO2颗粒沉积,20 nm组TiO2颗粒在肺部滞留时间较长,肺泡Ⅱ型细胞增生并出现间质纤维化病灶,且肺泡巨噬细胞清除能力显著低于200 nm组。另外,20 nm组向肺间质组织和周围淋巴结侵袭的程度也显著高于200 nm组。这些都显示20 nm TiO2颗粒不仅有很强的生物效应而且也显现出不同的动力学曲线,能使肺在低于颗粒容积负荷的情况下出现清除能力下降,并导致炎症反应增强。Chen等[18]在发现肺部炎症的同时,还观察到小鼠肺部气肿的发生,Borm等[19]的研究也发现,灌注0.1 mg的纳米TiO2能引起小鼠严重的肺部炎症反应。
Bermudez等[20]将大鼠、小鼠和地鼠暴露于超细TiO2(21 nm)颗粒中进行90 d吸入实验,在暴露刚结束时三种动物肺中的纳米TiO2颗粒含量最多,且随着剂量增加而增加,暴露后随着时间的延长肺中纳米TiO2颗粒含量逐渐下降,在恢复期结束时,发现高剂量组在大鼠、小鼠和地鼠肺内的沉积率分别为57%、45%和3%,中、低剂量组在小鼠和地鼠中没有沉积现象,在大鼠肺内的沉积率分别为25% 和10%。Crassian 等[21]将 C57B1/6 小鼠暴露于纳米 TiO2(4 h·d-1,10 d),发现小鼠肺部产生病理性变化,肺毒性的产生与纳米颗粒的表面积、大小以及团聚性有关[22]。
范轶欧等[23]比较研究了吸入纳米级[(15±5)nm]和微米级[(3±1)μm]TiO2对雄性大鼠精子及其功能的影响。观察到nm-TiO2致大鼠精子数量下降、LDH-C4活力下降和8-OHdG水平增加程度显著高于同剂量μm-TiO2组(P<0.05);结果表明nm-TiO2和μm-TiO2对雄性大鼠生精功能影响存在较大差异,nm-TiO2致生殖损伤能力高于同剂量水平的 μm-TiO2。Zhu等[24]的研究也发现水蚤暴露于纳米TiO2(21 nm,50 g·m-2)环境中21 d后,出现发育迟缓和生殖障碍。
Wang等[25]进行了纳米TiO2气管注入染毒大鼠血浆代谢组学研究,发现肝脏、肾脏和心脏是纳米TiO2气管注入染毒的潜在靶器官,其损伤可能与能量代谢紊乱有关,乳酸、丙胺酸、丙酮酸、葡萄糖、柠檬酸、胆碱、肌酸是机体损伤的生物标志物,核磁共振谱与模式识别技术结合的代谢组学技术能揭示气管注入纳米TiO2后大鼠血浆的代谢变化。张婷等[26]探讨了雄性大鼠吸入纳米TiO2对其肝脏和肺脏的氧化损伤。发现纳米TiO2致氧化损伤作用在肝、肺组织有不同表现,使肝脏清除氧自由基的能力减弱,使大鼠肺组织内脂质过氧化作用增强,并且使肺组织出现了早期纤维化的表现。
3.1.2 经口暴露途径 人体吸入纳米颗粒有好几种不同的途径,对于大多数人来说经口摄入也是一个潜在的暴露途径。Wang等[27]将25、80和155 nm TiO2颗粒以5 g·kg-1剂量对小鼠进行口服给药两周后发现25和80 nm TiO2颗粒组雌性小鼠的肝脏系数明显高于对照组,组织病理学检查观察到明显的肝损伤(围绕中央静脉的水样变性和肝细胞点状坏死),与对照组相比25和80 nm TiO2组血清中LDH和alpha-HBDH的变化显示心肌有损害。除此之外,实验组还观察到肾毒性像血尿素氮水平增加和肾脏病理学变化,说明纳米TiO2对肾脏有毒性,在心脏、肺、卵巢和脾脏中并未观察到异常的病理学变化。
3.1.3 皮肤暴露途径 目前TiO2被广泛应用于各类防晒化妆品中,其是否能经皮肤渗透进入人体内部已引起了人们的广泛关注。关于纳米TiO2的皮肤渗透可能性研究者们已经进行了若干研究,Lademann等[28]曾报道在毛囊角质层和毛乳头处发现了防晒霜中的超细TiO2颗粒的存在,但是这不足以说明TiO2颗粒能穿透活皮肤组织。
一些实验研究则发现TiO2颗粒(20~200 nm)可沉积于人皮肤角质层的最外层,角质层的深面、真皮层及皮下组织并未检测到其存在[29-30],相似的实验结果在猪皮上也得到了验证[31],说明纳米TiO2无法通过皮肤的屏障进入机体。但也有少数研究认为纳米TiO2可渗入皮肤深层,Bennat等[32]将油状和水状的TiO2用于评价其皮肤渗透性,研究结果表明油状的TiO2较水状的TiO2皮肤渗透现象显著。Menzel等[33]利用与人体皮肤最为相似的猪背部皮肤做纳米TiO2的皮肤渗透性实验,通过粒子诱发X射线荧光分析技术(PIXE)、卢瑟福背散射(RBS)技术观察纳米TiO2在皮肤中的分布情况,发现涂抹8 h后,粒径为45~150 nm长、17~35 nm宽的纳米TiO2可以穿过皮肤的角质层进入到表皮下的颗粒层。并且通过扫描透射显微镜(STIM)和二次电子成像(SEI)技术观察到TiO2纳米颗粒是通过皮肤角质层的细胞间隙进入皮下的颗粒层。
Brand等[34]以大鼠皮肤为模型研究了含TiO2纳米材料的防晒剂在皮肤涂抹和酒精饮用对除草剂2,4-二氯苯氧乙酸经皮肤吸收的影响,发现含TiO2纳米材料的防晒剂和酒精单独使用,均可提高2,4-二氯苯氧乙酸经皮肤吸收的量,而当酒精和TiO2纳米材料一起使用时,皮肤会产生宾主共生吸收效应。换言之,在摄取酒精之后,再使用含有TiO2纳米材料的防晒剂会进一步增加皮肤的通透性。
纳米TiO2是否可经皮渗透对人体产生毒性影响还不是很确定,因此专家们认为关于皮肤渗透需要加强如下几方面的研究:纳米TiO2对皮肤细胞的毒性作用机制,长期暴露于纳米TiO2后对皮肤的蓄积毒性,纳米TiO2在体内是否会代谢成更小的粒子而增加其潜在的毒性等[35]。纳米TiO2在人体皮肤表面的渗透方式见图4[36]。

图4 TiO2纳米材料在人体皮肤表层的渗透示意图[36]
3.1.4 腹腔注射暴露途径 腹腔注射是一种常用的给药方法,它操作方便,任何动物不论大小都可以腹腔注射。腹膜面积大,密布血管和淋巴管,吸收能力特强,每小时可吸收占动物体重3% ~8%的液体。Chen等[37]给小鼠注射不同剂量的纳米 TiO2(0、324、648、972、1 296、1 944、2 592 mg·kg-1),观察不同时间点(24 h、48 h、7 d和14 d)对血清生化指标的影响,观察发现试验组表现出相应的急性毒性如无精打采、厌食、抽搐和嗜睡等症状,血清生化试验发现天冬氨酸氨基转移酶和丙氨酸氨基转移酶活性上升,组织病理学检查发现纳米TiO2在肝脏、肾脏和肺中都有沉积,而在脾脏中的含量最高,对脾脏的损伤最严重,同时也引起肝细胞坏疽凋亡和肝纤维化、肾小球肿胀等,表明对肝脏和肾脏也产生毒性。Olmedo等[38]给大鼠腹腔注射TiO2悬液(1.60 g TiO2每100 g体重),18个月后将受试鼠处死,结果发现TiO2在软组织中均有分布,但未引起组织损伤。
刘青等[39]给小鼠一次性腹腔注射不同剂量的纳米TiO2颗粒溶液,14 d后观察到给予纳米TiO2后,小鼠肺及脏腑组织中的抗氧化酶SOD、CAT和GPX的活性及MDA浓度都呈现出一定的变化,肝脏中的GPT、GOT活性显著增高。结果表明纳米TiO2颗粒对肝脏有一定程度的损害作用,并能造成肺、脑组织的氧化防御体系失衡,造成抗氧化酶活性失调,氧化损伤程度则因组织器官的不同而有差异。
3. 2 纳米二氧化钛的细胞毒性研究
由于纳米TiO2的尺寸极小,使得它可以轻易地穿过细胞膜进入细胞内。纳米TiO2的高化学活性,又使其可以对细胞产生损伤,进而影响到细胞的生长、增殖及凋亡等。
3.2.1 纳米二氧化钛跨膜 细胞膜是细胞与外界环境进行物质交换的通透性屏障,纳米TiO2对细胞的损伤首先体现在它对细胞膜的破坏,细胞膜是纳米TiO2对细胞攻击的第一个目标。Long等[40]采用TEM观察发现纳米TiO2能够穿过神经小胶质细胞(BV2)的细胞膜进入细胞内部,聚集在线粒体中。研究者 Lu等[41]借助AFM发现近紫外光照射时,用TiO2薄膜培养的大肠杆菌细胞壁首先降解,接着出现细胞膜损伤和细胞的通透性受到破坏,引起细胞内容物外流,导致细胞死亡。Sunada等[42]研究发现TiO2能降解E.coli内毒素,内毒素存在于细菌细胞内,内毒素降解和细菌崩解死亡的相关性说明TiO2对细菌细胞的外膜有一定的催化氧化作用。Maness等[43]的研究认为TiO2表面产生的活性氧,如羟基自由基、超氧阴离子和过氧化氢,能够介导细胞膜的脂质过氧化过程,随即使细胞膜发生降解,之后TiO2颗粒则顺利进入胞内并对细胞内物质产生光催化氧化作用。虽然目前已证实纳米TiO2能够穿过细胞膜进入到细胞内部,但对其跨膜机制还不是很清楚。
3.2.2 抑制细胞生长 纳米TiO2可以抑制细胞生长,Amezaga-Madrid等[44]以假单胞菌属为对象,在纳米TiO2存在条件下,紫外线照射40 min后用透射电子显微镜(TEM)和X射线衍射仪(XRD)观测,发现纳米TiO2对细胞生长的抑制率达到60% ~72%。熊先立等[45]用47 nm粒径的TiO2培养人肝癌细胞,发现细胞周期G1期细胞数显著增加,S期数量开始减少,表明纳米TiO2可将细胞周期阻滞在G1期,使其不能进入S期,从而导致细胞生长抑制。
朱融融等[46]以人肾上皮细胞293T和中国仓鼠卵巢肿瘤细胞CHO为研究对象,通过MTT法酶标仪检测、倒置显微镜观察和DNA ladder实验等方法,研究了锐钛型TiO2对它们的选择性凋亡诱导作用。实验结果表明,纳米TiO2对肿瘤细胞具有非常显著的毒性作用,可侵入细胞内部,诱导CHO细胞产生细胞凋亡;而对293T细胞虽然会抑制其增殖,但不能够进入细胞膜内,没有产生细胞凋亡现象。
3.2.3 损伤DNA 纳米TiO2具有遗传毒性,可以影响细胞遗传物质DNA的表达。Nakagawa等[47]的研究发现,当用波长小于400 nm的紫外线照射纳米TiO2时,会产生具有强氧化能力的自由基攻击DNA链上的鸟嘌呤碱基,纳米TiO2(21 nm)在有光照条件下会对小鼠淋巴瘤细胞的DNA产生损伤,在无光照条件下则对DNA无损伤。Hirakawa等[48]的实验也证实了纳米TiO2引起的DNA断链大多发生在鸟嘌呤残基上。Wamera等[49]研究也发现用320~400 nm的紫外线照射含有 TiO2的小牛胸腺 DNA,经高效液相色谱(HPLC)分析发现有8-OHdG生成,说明DNA发生了氧化损伤。
3.2.4 引起细胞凋亡 纳米TiO2可以引发细胞的凋亡和坏死。Rahman等[50]发现20 nm的TiO2超细颗粒处理过的细胞,其微核数目显著升高,引起细胞凋亡。Gurr等[51]研究证实,纳米 TiO2(10 ~20 nm)在缺乏光照的情况下,也可以引起人类的支气管上皮细胞系(BEAS-2B)的DNA氧化损伤、脂质过氧化、微核效应,并导致过氧化氢和氧化亚氮的出现,进而对细胞产生影响。Wang等[52]研究发现纳米TiO2颗粒对离体人体淋巴细胞有显著的细胞毒性。
4 纳米二氧化钛的安全性展望
本文得出的主要结论是:(1)纳米TiO2粒径尺寸越小,越容易进入细胞,对细胞的毒性越大,颗粒数目超出一定的范围也能引起毒性。(2)纳米TiO2经不同的暴露途径作用于生物体对机体的影响不同,毒作用的主要器官及损伤程度存在较大差异。(3)纳米TiO2在较低浓度范围内体内体外毒性均较低。因此,将纳米TiO2颗粒应用于体内时,应将其控制在有效浓度范围内使用。(4)纳米TiO2的体内毒性研究结果与体外细胞毒性研究结果不太一致,因此体外的研究结果不能完全代表其体内毒性。
纳米TiO2由于具有超微性 (ultrafine property)、高效光催化活性 (highly efficient photocatalysis)及紫外吸收性(UV absorbance)等诸多特性,在诸多领域得到了广泛应用。虽然到目前为止还未出现纳米TiO2对人体产生毒效应的报道,但纳米TiO2的毒理安全性问题已引起世界各个领域专家学者们的广泛关注[53-54]。未来对纳米TiO2的研究,应主要体现在以下几个方面:(1)纳米TiO2的尺寸和结构与其毒性之间的关系,改变纳米TiO2表面的电荷性质、亲水/疏水性、粒径、表面修饰等,相同的纳米TiO2可能会表现出不同的毒性,甚至可消除其毒性。所以应致力于通过一定的化学修饰或物理处理来降低和消除纳米TiO2对生物体的负面生物效应,同时保持其有益的纳米特性。(2)纳米TiO2目前的研究多集中在整体水平和细胞水平上,而分子和基因水平上关于纳米TiO2与生物分子的相互作用及其对生物分子结构和功能影响的研究还很少,应加强分子和基因水平上纳米TiO2毒性效应的研究。(3)纳米TiO2对环境[55]的影响:对纳米TiO2进行生态毒理学(包括鱼类、水藻、植物等)研究,包括纳米物质在大气、水、土壤中的转移、迁移及相互作用,处理和消除的方法等。(4)制定纳米TiO2安全性评估方法和评估标准,指导其安全生产和合理使用。相对统一的纳米TiO2安全标准的制定与实施,将为相关纳米TiO2技术设备、产品的研发、产业化生产及销售提供科学的保障。(5)纳米TiO2毒性作用机制目前仍不清楚[56],因此纳米TiO2材料的毒性效应机制仍是今后研究的重点。建立纳米TiO2的健康安全暴露评价体系,包括暴露途径和安全暴露剂量等。(6)构建预测纳米TiO2潜在影响的理论模型。应建立有效的表征纳米TiO2在环境中释放、运输、转化、累积、吸收过程的数据模型。此模型能正确揭示生物体内纳米TiO2的剂量、运输、清除、累积、转化与反应行为,并与其物理、化学特性有机的关联,实现纳米TiO2的安全设计,发挥纳米TiO2的潜能,提供抑制纳米TiO2风险的有效途径以及实现对纳米TiO2安全处置的机制[57]。
目前,世界各国都已经开始了纳米TiO2毒性和安全性等方面的相关研究工作,但国内对纳米TiO2这方面的研究还比较薄弱,还只限于动物体内或体外等方面的研究,对于纳米TiO2宏观层面以及更深层次的生物效应机制的研究,目前的报道还较少,这些都值得我们深入探讨。开展这方面的研究关系到人类的生存健康,需要科研工作者的共同努力,它充满了科学创新的机遇与挑战。
[1]TSUJI J S,MAYNARD A D,HOWARD P C,et al.Forum series:Research strategies for safety evaluation of nanomaterials,Part IV:Risk assessment of nanoparticles[J].Toxicol Sci,2006,89(1):42-50.
[2]WARHEIT D B,WEBB T R,SAYES C M,et al.Pulmonary instillation studies with nanoscale TiO2rods and dots in rats:toxicity is not dependent upon particles size and surface area[J].Toxicol Sci,2006,91(1):227-236.
[3]SERVICE R F.American Chemical Society meeting:Nanomaterials show signs of toxicity[J].Science,2003,300(5617):243-243.
[4]SWEET L,STROHM B.Nanotechnology:Life-cycle risk management[J].Hum Ecol Risk Assess,2006,12(3):528-551.
[5]唐萌,浦跃朴,赵宇亮.人造纳米材料的生物效应及安全性毒理学研究.科学前沿与未来(第十一集)[M].北京:科学出版社,2009:58-72.
[6]赵宇亮,白春礼.纳米安全性:纳米材料的生物效应[J].世界科学技术,2005,7:104-107.
[7]MCCULLAGH C,ROBERTSON J M C,BAHNEMANN D W,et al.The application of TiO2photocatalysis for disinfection of water contaminated with pathogenic micro-organisms:a review[J].Res Chem Intermed,2007,33(3-5):359-375.
[8]夏阳,章非敏,徐丽娜,等.纳米TiO2增韧牙科复合树脂的结构和机械性能[J].东南大学学报:医学版,2011,30(1):57-62.
[9]PARK J H,KIM S,BARD A J.Novel carbon-doped TiO2nanotube arrays with high aspect ratios for efficient solar water splitting[J].Nano Lett,2006,6(1):24-28.
[10]莫斤斤,涂敏,陈春英.二氧化钛纳米材料的应用领域[M]//陈春英.二氧化钛纳米材料生物效应与安全应用.北京:科学出版社,2010:1-4.
[11]朱永法.纳米材料的表征和测试技术[M].北京:化学工业出版社,2006:499-501.
[12]李颖,王光祖.纳米材料的表征与测试技术[J].超硬材料工程,2007,19(2):38-42.
[13]NET A,XIA T,MADLER L,et al.Toxic potential of materials at the nanolevel[J]. Science,2006,311(5761):622-627.
[14]WARHEIT D B,BROCK W J,LEE K P,et al.Comparative pulmonary toxicity inhalation and instillation studies with different particle formulations:impact of surface treatments on particle toxicity[J].Toxicol Sci,2005,88(2):514-524.
[15]吴佐全.纳米TiO2薄膜表面修饰PMMA IOL植入兔眼的相关研究[D].福州:福建医科大学,2010.
[16]KANDLIKAR M,RAMACHANDRAN G,MAYNARD A,et al.Health risk assessment for nanoparticles:a case for using expert judgment[J].J Nanopart Res,2007,9:137-156.
[17]OBERDORSTER G,OBERDORSTER E,OBERDORSTER J.Nanotoxicology:an emerging discipline evolving from studies of ultrafine particles[J].Environ Health Perspect,2005,113(7):823-839.
[18]CHEN H W,SU S F,CHIEN C T,et al.Titanium dioxide nanoparticles induce emphysema-like lung injury in mice[J].The FASEB Journal,2006,20(13):2393-2395.
[19]BORM P J,KREYLING W.Toxicological hazards of inhaled nanoparticles-potential implications for drug delivery[J].J Nanosci Nanotechnol,2004,4(5):521-531.
[20]BERMUDEZ E,MANGUM J B,WONG B A,et al.Pulmonary responses of mice,rats,and hamsters to subchronic inhalation of ultrafine titanium dioxide particles[J].Toxicol Sci,2004,77(2):347-357.
[21]CRASSIAN V H,OSHAUGHNESSY P T,ANDREA A D,et al.Inhalation exposure study of titanium dioxide nanoparticles with a primary particle size of 2 to 5 nm[J].Environ Health Perspect,2007,115(3):397-402.
[22]LI J G,LI Q N,XU J Y,et al.Comparative study on the actue pulmonary toxicity induced by 3 and 20 nm TiO2primary particles in mice[J]. Environ Toxicol Pharmacol,2007,24(3):239-244.
[23]范轶欧,金一和,刘冰,等.吸入纳米和微米二氧化钛颗粒对雄性大鼠精子及其功能的影响[J].预防医学论坛,2007,13(2):137-140.
[24]ZHU X S,CHANG Y,CHEN Y S.Toxicity and bioaccumulation of TiO2nanoparticle aggregates in Daphnia magna[J].Chemosphere,2010,78(3):209-215.
[25]WANG S,TANG M,ZHANG T,et al.A Study on nano-TiO2intratracheally instilled using 1 H NMR based metabonomics in rats plasma[J].The Proceeding of ICNT,2008,12(3):19-23.
[26]张婷,唐萌,王姝,等.大鼠肺灌注纳米二氧化钛颗粒对其脏器氧化损伤的影响[J].南开大学学报:自然科学版,2008,41(3):24-28.
[27]WANG J,ZHOU G,CHEN C,et al.Acute toxicity and biodistribution of different sized titanium dioxide particles in mice after oral administration[J].Toxicol Lett,2007,168(2):176-185.
[28]LADEMANN J,WEIGMANN H J,RICKMEYER C,et al.Penetration of titanium dioxide micro-particles in a sunscreen formulation into the horny layer and the follicular orifice[J].Skin Pharmacol Appl Skin Physiol,1999,12(5):247-256.
[29]PFLUCKER F,WENDEL V,HOHENBERG H,et al.The human stratum corneum layer:an effective-barrier against dermal uptake of different forms of topically applied micronised titanium dioxide[J].Skin Pharmacol Appl Skin Physiol,2001,14(1):92-97.
[30]KISS B,BIRO T,CZIFRA G,et al.Investigation of micronized titanium dioxide penetration in human skin xenografts and its effect on cellular functions of human skin-derived cells[J].Exp Dermatol,2008,17(8):659-667.
[31]GAMER A O,LEIBOLD E,RAVENZWAAY B.The in vitro absorption of microfine zinc oxide and titanium dioxide through porcine skin[J].Toxicol In Vitro,2006,20(3):301-307.
[32]BENNAT C,MULLER-GOYMANN C C.Skin penetration and stabilization of formulations containing microfine titanium dioxide as physical UV filter[J].Int J Cosmet Sci,2000,22(4):271-283.
[33]MENZEL F,REINERT T,VOGT J,et al.Investigations of percutaneous uptake of ultrafine TiO2particles at the high energy ion nanoprobe lipsion[J].Nucl Instrum Methods Phys Res Sect B,2004,219-220:82-86.
[34]BRAND R M,MCMAHON L,JENDRZEJEWSKI J L,et al.Transdermal absorption of the herbicide 2,4-dichlorophe-noxyacetic acid is enhanced by both ethanol consumption and sunscreen application[J].Food Chem Toxicol,2007,45(1):93-97.
[35]MICHAEL P H,WILLIAM H F,TIMOTHY D L,et al.Forum series:Research strategies for safety evaluation of nanomaterials,Part II:Toxicological and safety evaluation of nanomaterials,current challenges and data needs[J].Toxicol Sci,2005,88(1):12-17.
[36]BORM P J,ROBBINS D,HAUBOLD S.The potential risks of nanomaterials:a review carried out for ECETOC[J].Part Fibre Toxicol,2006,3:11.
[37]CHEN J Y,DONG X,ZHAO J,et al.In vivo acute toxicity of titanium dioxide nanoparticles to mice after intraperitioneal injection[J].J Appl Toxicol,2009,29(4):330-337.
[38]OLMEDO D G,TASAT D R,GUGLIELMOTTI M B,et al.Biodistribution of titanium dioxide from biologic compartments[J].J Mater Sci Mater Med,2008,19(9):3049-3056.
[39]刘青,薛秀玲,叶静,等.纳米对小鼠肺、脑和肝脏组织的影响[J].华侨大学学报,2009,30(2):179-182.
[40]LONG T C,TAJUBA J,SAMA P,et al.Nanosize titanium dioxide stimulates reactive oxygen species in brain microglia and damages neurons in vitro[J].Environ Health Perspect,2007,115(11):1631-1637.
[41]LU Z X,ZHOU L,ZHANG Z L,et al.Cell damage induced by photocatalysis of TiO2thin films[J].Langmuir,2003,19(21):8765-8768.
[42]SUNADA K,WATANABE T,HASHIMOTO K.Studies on photokilling of bacteria on TiO2thin film[J].J Photochem Photobiol A Chem,2003,156(1-3):227-233.
[43]MANESS P C,SMOLINSKI S,BLAKE D M,et al.Bactericidal activity of photocatalytic TiO2reaction:toward an understanding of its killing mechanism[J].Appl Environ Microbiol,1999,65(9):4094-4098.
[44]AMEZAGA-MADRID P,SILVEYRA-MORALES R,CORDOBA-FIERRO L,et al.TEM evidence of ultrastructural alteration on Pseudomonas aeruginosa by photocatalytic TiO2thin films[J].J Photochem Photobiol B,2003,70(1):45-50.
[45]熊先立,吴美玲,李世普.纳米二氧化钛对人肝癌 Bel-7402细胞周期的影响[J].肿瘤防治研究,2003,30(4):300.
[46]朱融融,汪世龙,陈小平,等.纳米二氧化钛对卵巢肿瘤细胞的选择性凋亡的诱导作用[J].化学学报,2006,64:2161-2164.
[47]NAKAGAWA Y,WAKURA S,SAKAMOTO K,et al.The photogenotoxicity of titanium dioxide particles[J].Mutation Research,1997,394:25-132.
[48]HIRAKAWA K,MORI M,YOSHIDA M,et al.Photo-irradiated titanium dioxide catalyzes site specific DNA damage via generation of hydrogen peroxide[J].Free Radic Res,2004,38(5):439-447.
[49]WAMERA W G,YIN J J,WEI R R.Oxidative damage to nucleic acids photosensitized by titanium dioxide[J].Free Radical Biol Med,1997,23(6):851-858.
[50]RAHMAN Q,LOHANI M,DOPP E,et al.Evidence that ultrafine titanium dioxide induces micronuclei and apoptosis in Syrian hamster embryo fibroblasts[J].Environ Health Perspect,2002,110(8):797-800.
[51]GURR J R,WANG A S,CHEN C H,et al.Ultrafine titanium dioxide particles in the absence of photoactivation can induce oxidative damage to human bronchial epithelial cells[J].Toxicology,2005,213(1-2):66-73.
[52]WANG J J,BARBARA J S,SANDERSON,et al.Cyto-and genotoxicity of ultrafine TiO2particles in cultured human lymphoblastoid cells[J].Mutation Research,2007,628(2):99-106.
[53]THOMAS K,SAYRE P.Forum series:Research strategies for safety evaluation of nanomaterials,Part I:Evaluating the human health implications of exposure to nanoscale materials[J].Toxicol Sci,2005,87(2):316-321.
[54]THOMAS K,AGUAR P,KAWASAKI H,et al.Forum series:Research strategies for safety evaluation of nanomaterials,Part VIII:International efforts to develop risk-based safety evaluations for nanomaterials[J].Toxicol Sci,2006,92(1):23-32.
[55]唐萌,王晓娜,李倩,等.纳米氧化铁、纳米TiO2、碳纳米管的毒理学研究进展[J].国际生物医学工程杂志,2006,29(6):340-345.
[56]UMEMURA R,OGAWA H,KAN A.Low temperature sintering and microwave dielectric properties of(Mg3-xZnx)(VO4)2ceramics[J].J Eur Ceram Soc,2006,26(10):2063-2068.
[57]丁玲,刘鹏,李世迁.纳米材料毒性和安全性研究进展[J].材料导报,2010,24(3):29-44.
