高温刺激对刺参浮游期幼体存活率及Hsp70表达量的影响*
2011-01-05王青林董云伟董双林宋文华于姗姗
王青林,董云伟,董双林**,王 芳,宋文华,于姗姗
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.厦门大学海洋与环境学院,福建厦门361005)
高温刺激对刺参浮游期幼体存活率及Hsp70表达量的影响*
王青林1,董云伟2,董双林1**,王 芳1,宋文华1,于姗姗1
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.厦门大学海洋与环境学院,福建厦门361005)
设计不同温度(21.5,26,28和30℃),对刺参(A postichopus japonicus)囊胚期、原肠期和耳状幼体期幼体进行热激处理,热激45 min后,将幼体在21.5℃条件下继续培养至耳状幼体后期,计算刺参幼体的存活率,并用蛋白杂交方法测定幼体Hsp70的表达量。结果表明,高温刺激对幼体的存活有显著性影响,各时期幼体的存活率均随热激温度的升高而降低,原肠期的存活率要高于囊胚期和耳状幼体时期。原肠期幼体Hsp70表达量要比囊胚期和耳状幼体时期高,这表明在发育过程中Hsp70表达量与幼体存活率具有相关性。
高温刺激;刺参;幼体;热休克蛋白;发育
刺参(A postichopus japonicus)是我国北方的一个重要养殖品种,市场需求日益增加。由于刺参对高温的耐受性低,养殖区域和生长时间受到了极大的限制。温度刺激所诱导的保护作用在海洋生物中已有研究[1-2]。张其中等[3]发现近江牡蛎预先经受亚致死温度热休克以后,显著提高了对高温的耐受能力,这种保护作用与生物体内热休克蛋白的表达具有重要关系[4]。
热休克蛋白(Heat shock proteins,HSPs)是1种高度保守的蛋白质,具有防止蛋白变性,使变性蛋白复性的重要功能,其中分子量为66~78 kDa的热应激蛋白70(Hsp70)家族由于其保守性、重要性和在应激反应中的敏感性,受到广泛重视[5]。有研究表明少量诱导型热休克蛋白的表达能显著地影响生物的生长、发育、热耐受性、寿命以及繁殖[6-11]。目前,对于刺参的研究已经证实Hsp70在抵抗高温和渗透压胁迫中具有重要作用[4,12-14]。同时HSPs的累积与机体耐受性的提高有一定的相关性[15]。本实验通过检测不同热激条件下刺参浮游期幼体存活率和Hsps的含量,探讨Hsp70表达与幼体存活率之间的关系,分析不同发育时期刺参幼体对温度应激的敏感性,丰富刺参温度生理生态学研究,并为耐高温品系筛选提供一定的理论指导。
1 材料和方法
1.1 材料来源
实验所需幼体来自山东省胶南市育苗场的亲参,干法运至实验室后,在18℃暂养5 d,人工诱导产卵并培育而得。卵子和精子在21.5℃水温下孵化,受精卵的密度控制在10~20 inds/mL,在原肠期幼虫后期投喂牟氏角毛藻(Chaetoceros muelleri)、杜氏盐藻(Dunaliella salina)和海洋红酵母的混合液,投喂量依据刺参的不同发育时期、幼体的摄食活力以及水体中剩余的饵料数量而做适当的调整。整个苗种培育期间不间断充气,光照强度控制在500~1500 lux,光照周期为14 L∶10 D。水源为沙滤自然海水。每天换水1/2,海水盐度为30左右,换水前对海水进行预加热,防止换水造成水族箱温度变化过大。
1.2 实验设计
1.2.1 高温刺激对刺参浮游期幼虫存活率的影响
在囊胚期、原肠期以及耳状幼体初期,将幼体分别转移到26,28和30℃进行高温应激处理,持续时间为45 min,然后再转移到21.5℃继续培育至耳状幼体后期,每个处理3个重复,21.5℃培育下的不进行高温应激处理的幼体作为对照。分别于实验开始前及耳状幼体后期记录水体中幼体的数量。
1.2.2 不同发育时期刺参幼体Hsp70含量变化 在受精卵、囊胚期、原肠期以及耳状幼体初期,将幼体分别转移到不同温度(26,28和30℃)进行热激处理,持续时间为45 min,然后再转移到21.5℃继续培育,2 h后取大约8 000个幼体液氮保存,同时取未高温应激的幼体作为对照,每个处理3个重复。
1.3 样品处理
在预冷的研钵内加入液氮低温研磨刺参幼体,然后加入适量含有蛋白酶抑制剂的细胞裂解液在冰浴中匀浆。匀浆完毕后4℃下10 000 g 15 min,取上清液保存在-70℃超低温冰箱中。
1.4 蛋白杂交
以牛血清蛋白为标准方法参照Lowry等[16]测定样品中蛋白含量。Hsp70和Hsp72含量的测量方法参照Dong等[17]。蛋白的凝胶电泳选用10%的聚丙烯酰胺凝胶电泳[18]。取40μg蛋白加适量体积上样缓冲液(含DTT)煮沸5 min,进行电泳,然后参照Kyhse-Andersen[19]的方法将聚丙烯酰胺凝胶中的蛋白质转移到0.45μm的PVDF膜上利用脱脂奶粉封闭后,用单克隆抗Hsp70抗体,(H5147,Sigma,USA),在37℃孵育2 h(稀释1∶5000)。然后将膜在抗小鼠IgG(HRP)(ZB2305,中杉金桥,北京,中国)抗体中孵育1.5 h,采用ECL试剂(Amersham,USA)显色,曝光,条带强度采用Image J软件进行定量分析。
本实验标准值采用30℃条件下热激的受精卵样品,实验结果中的Hsp水平均为相对于标准样品水平的值(RU)。
1.5 计算与数据分析
实验期间幼体存活率(SR)采用以下公式计算:SR=N2/N1×100%,N1,N2分别为初始时期和耳状幼体后期幼体数量。
数据统计采用SPSS13.0进行,不同热激温度和不同发育时期的差异采用双因子方差分析(Two-way ANOVA),以P<0.05作为差异显著的标准。
2 结果
2.1 高温应激对刺参浮游期幼虫存活率的影响
在幼体生长的最适温度下(21.5℃),不同发育时期(囊胚期BLA、原肠期GAS以及耳状幼体期AUR)幼体的存活率不同(见图1)。其中囊胚期的存活率最高,为81.96%,显著高于耳状幼体期的70.0%(P<0.05),和原肠期的存活率(79.71%)没有显著差异。
双因子方差分析结果表明,热激温度和发育时期对刺参幼体存活率差值影响显著(见表1),温度和发育时期具有显著交互作用(P<0.001)。随着热激温度的升高,不同浮游期的刺参幼体的存活率呈下降的趋势,其中热激组与对照组幼体的存活率差值呈下降趋势(见图2)(BLA-26,-21.52%;BLA-28,-34.52%;BLA-30,-49.06%;GAS-26,-10.95%;GAS-28,-15.22%;GAS-30,-28.51%;AUR-26,-17.04%;AUR-28,-35.37%;AUR-30,-36.94%)。在囊胚期和原肠期,不同温度处理组之间差异显著(P<0.05)。在耳状幼体时期,26℃热激组幼体的存活率显著高于其它2组,其它2组差异不明显。
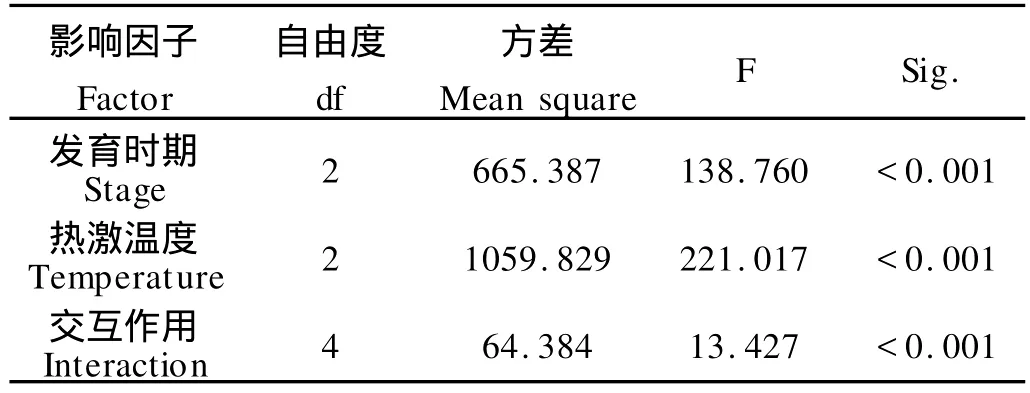
表1 不同温度热激对刺参不同浮游期幼体存活率影响的方差分析Table 1 Two-way ANOVO analysis of the effect of heat-shock temperature on survival rate ofA postichopus japonicuslarvae in different developmental stages
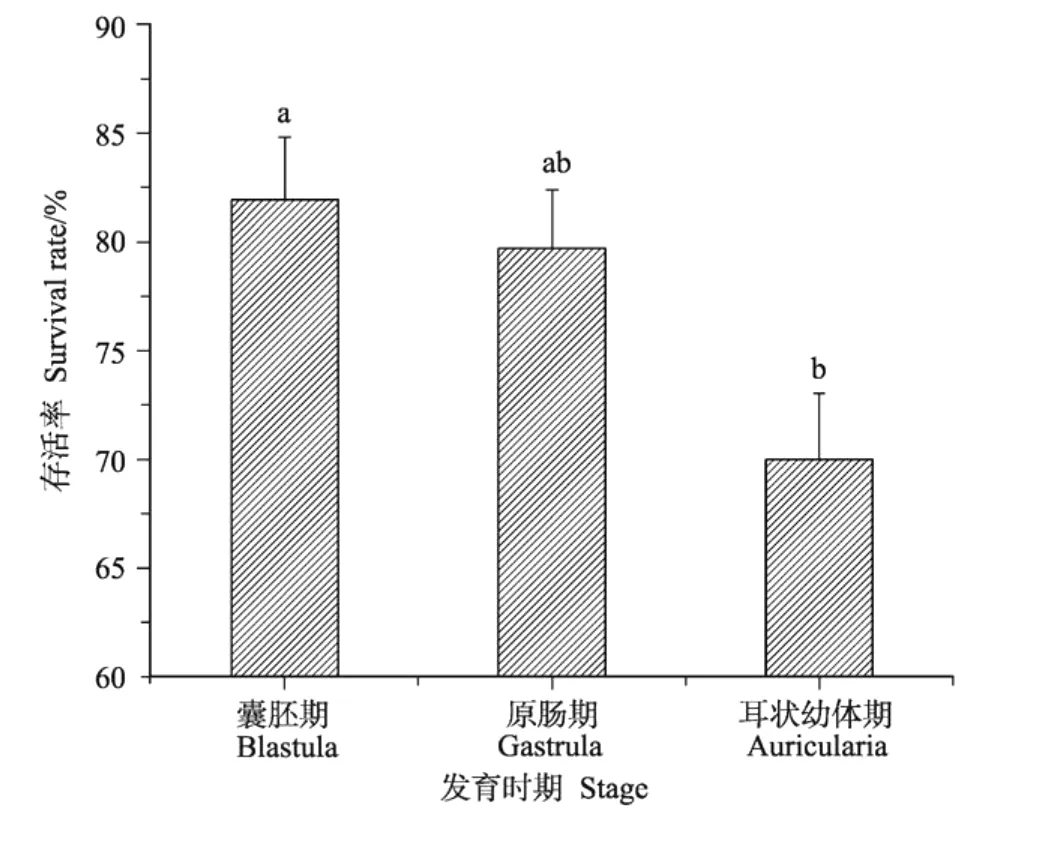
图1 不同浮游时期刺参存活率Fig.1 Survival rate of larvae at the stage of blastula,gastrula and auricularia inA postichopus japonicus
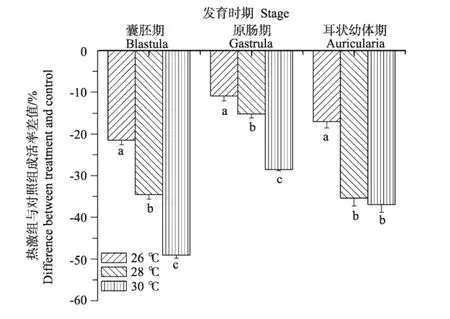
图2 热激对刺参浮游期幼体存活率的影响Fig.2 Survival rate of larvae stressed at the stage of blastula,gastrula and auricularia of sea cucumber A postichopus japonicus
2.2 刺参浮游幼体Hsp70的表达
2.2.1 热激温度对不同发育时期刺参幼体Hsp70表达量的影响 热激温度对不同发育时期刺参幼体Hsp70表达量的影响不同(见图3)。受精卵时期,随着热激温度的升高Hsp70的表达量增加,但是30℃时,表达量明显低于其它3组(P<0.05)。囊胚时期,对照组有少量Hsp70表达,但是热激组没有检测到有Hsp70表达(RU=0)。随着热激温度的升高,原肠期幼体Hsp70的表达量呈下降的趋势,并且各处理组之间差异显著(P<0.05)。耳状幼体时期,没有检测到Hsp70的表达。
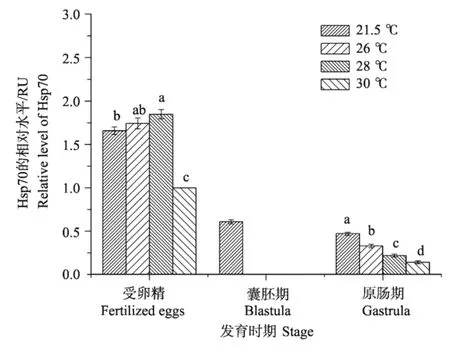
图3 热激温度对不同发育时期刺参幼体Hsp70表达量的影响Fig.3 Expression of Hsp70 of larvae stressed at pelagic stages of sea cucumberA postichopus japonicus

图4 热激温度对不同发育时期刺参幼体Hsp72表达量的影响Fig.4 Expression of Hsp72 of larvae stressed at pelagic stages
2.2.2 热激温度对不同发育时期刺参幼体Hsp72表达量的影响 热激温度对不同发育时期刺参幼体Hsp72表达的影响不同(见图4)。受精卵时期,Hsp72表达量随着温度的升高而增加,30℃条件下的表达量最高,显著高于其它3组(P<0.05)。28℃条件下的表达量显著高于21.5℃和26℃条件下的表达量,21.5℃和26℃条件下的表达量没有显著差异。囊胚时期,对照组有少量Hsp72表达,但是热激组没有检测到表达量。原肠时期,对照组有很高的Hsp72表达量,并且显著高于处理组(P<0.05),从26℃升高到28℃时,Hsp72的表达量随之增加,且2组之间的差异显著(P<0.05)。但是热激温度从28℃升高到30℃时,Hsp72的表达量呈下降的趋势,但差异不显著。耳状幼体时期,检测不到Hsp72的表达。
3 讨论
3.1 热激对刺参浮游期幼虫存活率的影响
水温是影响水生变温动物生长和其他生理过程的重要生态因子之一。有研究表明刺参幼体发育的最适温度为20~25℃[20-22],因此本实验选择21.5℃条件下的幼体发育为对照。温度能显著影响到刺参幼体的存活率[23]。本实验结果表明,在浮游幼体时期对刺参进行高温应激使得幼体存活率显著下降,存活率随着热激温度的升高而降低(见图2),且不同发育时期的刺参幼体对热激的敏感性不同。Chen[24]发现耳状幼体对环境的改变非常敏感,在此时期经常会出现大规模的幼体死亡。本实验的结果表明,相对囊胚期和耳状幼体时期的幼体,原肠期幼体在高温下存活率要比其它2个时期高,说明原肠期对高温的耐受性较强,而囊胚期和耳状幼体时期的幼体对热激较为敏感,这2个时期应该是筛选耐高温刺参的合适时期。刘广斌[25]研究发现,养殖环境的高温条件可以影响刺参对温度的耐受能力,并且这种能力是可以遗传的。故在囊胚期或者耳状幼体时期对幼体进行热激,是培育耐高温的刺参品系的一种途径。
3.2 刺参浮游幼体Hsp的表达
本实验表明,刺参受精卵、囊胚期以及原肠期都能检测到热休克蛋白表达,但是Hsp70具有2种单倍型,2种单倍型的表达模式有明显差别(见图3,4)。
就Hsp70的表达来说,受精卵时期,随着热激温度的升高,Hsp70的表达量随之增加,这表明当温度超过26℃时,刺参幼体会适应性的诱导产生热休克蛋白。但30℃条件下的Hsp70表达急剧降低,且显著低于其它3组(P<0.05),表明30℃已经超过幼体诱导产生热休克蛋白的上限。囊胚期,对照组有少量的Hsp70表达,但是当热激温度超过最适温度时,其表达量为零。原肠期,Hsp70的表达量随着热激温度的升高而显著下降(P<0.05)。在30℃下,各时期的幼体Hsp70表达量均有不同程度的降低,其表达量的下调与高温下机体整体蛋白合成降低有关[26]。如果过度刺激就会造成受刺激者整体处于不适状态,从而无法及时合成足够热休克蛋白,以对付有害刺激的伤害,严重时会导致死亡。Tedengren等[27]发现过度的热和镉离子浓度联合处理紫贻贝造成“生理适应度”降低,从而降低了Hsp70的表达水平。
受精卵期Hsp72表达量随着热激温度的升高,其表达量随之升高,此种蛋白表达量的上调表明热休克蛋白的表达受温度的诱导,Hsp70的表达与温度具有相关性[28]。当温度超过生物体的最适应温度时,某些蛋白丧失结构和活性,导致Hsp表达来重折叠变性蛋白和阻止更多的聚集[5]。囊胚期,Hsp72表达量趋势与Hsp70相同。原肠期,对照组表达量显著高于处理组(P<0.05),处理组表达量随着热激温度的升高呈先升后降趋势。
总体来说,不同时期2种单倍型热休克蛋白(Hsp70和Hsp72)的表达具有共同趋势:原肠期的表达量要高于囊胚期和耳状幼体期,而原肠期的存活率也高于囊胚期和耳状幼体期,表明两者具有一定的相关性。Dong等[29]通过研究位于高低潮区域的4种帽贝发现,高潮线附近的种类具有较高的Hsp70表达量。表明热休克蛋白在提高机体耐受性方面起着重要的作用。Hsp70可以增强机体的应激耐受性,提高细胞生存率。基本的细胞程序如转录、翻译、转运经过轻微热预处理后,在随后的应激过程中可以得到保护。这样不仅能使细胞的耐受性增加,而且能使细胞对其它应激原的耐受性也增加[30]。耳状幼体期没有Hsp的表达,可能是表达量太少,蛋白免疫印记无法检测,有研究表明Hsp在棘皮动物海胆胚胎时期的表达时期以及表达量因种而异[31-38],其具体原因有待进一步研究。
[1] Dubeau S F,Pan F,Tremblay G C,et al.Thermal shock of salmon in vivo induces the heat shock protein hsp70 and confers protection against osmotic shock[J].Aquaculture,1998,168:311-323.
[2] Tedengren M,Olsson B,Reimer O,et al.Heat pretreatment increases cadmium resistance and HSP70 levels in Baltic Sea mussels[J].Aquat Toxicol,1999,48:1-12.
[3] 张其中,邱马银,吴信忠,等.热休克诱导近江牡蛎对高温的耐受性[J].生态科学,2005,24(1):35-37.
[4] Dong Y W,Dong S L.Induced thermotolerance and expression of heat shock protein 70 in sea cucumberA postichopus japonicus[J].Fish Sci,2008,74:573-578.
[5] Feder M E,Hofmann G E.Heat-shock proteins,molecular chaperones,and the stress responses[J].Annu Rev Physiol,1999,61:243-282.
[6] Rutherford S L,Lindquist S.Hsp90 as a capacitor for morphological evolution[J].Nature,1998,396:336-342.
[7] S rensen J G,Loeschcke V.Larval crowding in Drosophila melanogaster induces Hsp70 expression,and leads to increased adult longevity and adult thermal stress resistance[J].J Insect Physiol,2001,47:1301-1307.
[8] Queitsch C,Sangster T A,Lindquist S.Hsp90 as a capacitor of phenotypic variation[J].Nature,2002,417:618-624.
[9] Rutherford S L.Between genotype and phenotype:Protein chaperones and evolvability[J].Nat Rew Genet,2003,4:263-274.
[10] Parsell D A,Lindquist S.The function of heat-shock proteins in stress tolerance:degradation and reactivation of damaged proteins[J].Annu Rev Genet,1993,27:437-496.
[11] Tomanek L.The heat-shock response:its variation,regulation and ecological importance in intertidal gastropods(genus Tegula)[J].Integr Comp Biol,2002,42:797-807.
[12] Dong Y W,Dong S L,Meng XL.Effects of thermal and osmotic stress on growth,osmoregulation and Hsp70 in sea cucumber(A postichopus japonicus Selenka)[J].Aquaculture,2008b,276:179-186.
[13] Dong Y W,Ji T T,Meng X L,et al.Difference in Thermotolerance between Red and Green Color Variants of the Japanese Sea Cucumber,A postichopus japonicusSelenka:Hsp70 and Heat Hardening Effect[J].Biol Bull,2010,218:87-94.
[14] Meng X L,Ji T T,Dong Y W,et al.Thermal resistance in sea cucumbers(A postichopus japonicus)with differing thermal history:The role of Hsp70[J].Aquaculture,2009,294:314-318.
[15] Moseley P L.Heat shock proteins and heat adaptation of the whole organism[J].J Applied Physiology,1997,83:1413-1417.
[16] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Forlin phenol reagent[J].Biol Chem,1951,193:265-275.
[17] Dong Y W,Dong S L,Ji T T.Effect of different thermal regimes on growth and physiological performance of the sea cucumber A postichopus japonicusSelenka[J].Aquaculture,2008a,275:329-334.
[18] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[19] Kyhse-Andersen J.Electroblotting of multiple gels:a simple apparatus without buffer tank for rapid transfer of proteins from polyacrylamide to nitrocellulose[J].Biochem Biophys Methods,1984,10:203-209.
[20] Kashenko S D.Effect of desalination on development of far eastern trepang[J].Russian Journal of Marine Biology,1992,18(3-4):43-52.
[21] Liu X Y,Zhu G H,Zhao Q,et al.Studies on hatchery techniques of the sea cucumber,A postichopus japonicus[M].[s.l.]:FAO Fisheries and Aquaculture Department,2005.
[22] 隋锡林.刺参人工育苗及增养殖技术[J].水产科学,2004,22(6):53.
[23] 常亚青,丁君,宋坚,等.海参海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[24] Chen X J.Overview of sea cucumber farming and sea ranching practices in China[J].SPC Beche-de-mer Information Bulletin,2003,18:18-22.
[25] 刘广斌.刺参A postichopus japonicus耐高温品系选育的基础研究:[D].青岛:中国科学院海洋研究所,2008.
[26] Hochachka P W,Somero G N.Biochemical Adaptation[M].New York:Oxford University Press,2002.
[27] Tedengren M,Olsson B,Reimer O,et al.Heat pretreatment increases cadmium resistance and Hsp70 levels in Baltic Sea mussels[J].Aquat Toxicol,1999,48:1-12.
[28] Dong Y W,Dong S L,Ji T T.Stress responses to rapid temperature changes of the juvenile sea cucumber(A postichopus japonicusSelenka)[J].Journal of Ocean University of China(English Edition),2007,6:275-280.
[29] Dong Y W,Miller L P,Sanders J G,et al.Heat-shock protein 70(Hsp 70)expression in four limpets of the genus Lottis:interspecific variation in constitutive and inducible synthesis correlates within situexposure to heat stress[J].Biol Bull,2008,215:173-181.
[30] Nakano K,Iwama G K.The 70-kDa heat shock protein response in two iintertidal sculpins,Oligocottus maculosus and O.snyderi:relationship of Hsp70 and thermal tolerance[J].Comp Biochem Phy,2002,133A:79-94.
[31] Giudice G,Roccheri M C,Bernardo M G.Synthesis of heat shock proteins in sea urchin embryos[J].Cell Biol Int Rep,1980,4:69-74.
[32] Roccheri M C,Sconzo G,La Rosa M,et al.Response to heat shock of different sea urchin species[J].Cell Differ,1986,18:131-135.
[33] B dard P A.,Brandhorst B P.Translational activation of maternal mRNA encoding the heat-shock proteins hsp 90 during sea urchin embryogenesis[J].Dev Biol,1986,117:286-293.
[34] Infante A A,Akhayat D,Rimland J,et al.Characterization of the prosome and a cytoplasmic particle containing a 21kD heat shock protein in sea urchin embryos[J].Acta Embryol Morphol Exp,1985,6:151-152.
[35] Giudice G.Heat shock proteins in sea urchin development.∥Changes in Eukaryotic Gene Expression in Response to Environmental Stress(Eds B.G.Atkinson&D.B.Walden)[M].New York:Academic Press,1985:115-133.
[36] Maglott D R.Heat shock response in the Atlantic sea urchinA rbacia punctulata[J].Experentia,1982,39:268-270.
[37] Howlett S,Miller J,Schultz G.Induction of heat shock proteins in early embryos ofA rbacia punctulata[J].Biol Bull,1983,165:500.
[38] Roccheri M C,Di Bernardo M G,Giudice G.Synthesis of heat shock proteins in developing sea urchins[J].Dev Biol,1981a,83:173-177.
Effects of Heat-Shock in Pelagic Stages on Survival and Hsp70 Expression of Juvenile Sea Cucumber,Apostichopus japonicus Selenka
WANG Qing-Lin1,DONG Yun-Wei2,DONG Shuang-Lin1,WANG Fang1,SONG Wen-Hua1,YU Shan-Shan1
(1.The Key Laboratory of Mariculture,Ministry of Education,College of Fisheries,Ocean University of China,Qingdao 266003,China;2.College of Oceanography,Xiamen University,Xiamen 361005,China)
The effects of heat-shock in pelagic stages on survival and Hsp70s expression of juvenile sea cucumber,A postichopus japonicusSelenka were investigated.Larvae at the stage of blastula,gastrula and auricularia were heat-shocked at selected temperatures(21.5,26,28 and 30℃)for 45 min and returned to 21.5℃for continuous rearing.After the heat-shock,there were significant differences in survival among larvae in the four heat-shocked treatments.The survival rate of larvae decreased with the increasing of heat-shock temperature,and the rate was higher in the stage of gastrula than those in blastula and auricularia.The Hsp70s expression of larvae in the stage of gastrula was higher than those in the stages of blastula and auricularia,suggesting that the survival of larvae partly correlates with the expression of Hsp70s.
heat-shock;sea cucumber;larvae;heat shock protein;development
S917.4
A
1672-5174(2011)03-047-05
国家科技支撑计划项目(2006BAD09A01);山东省优秀中青年科学家科研奖励基金计划项目(BS2009NY019)资助
2010-05-28;
2010-11-03
王青林(1984-),男,博士生。E-mail:wangqinglin2009@gmail.com
**通讯作者:E-mail:dongsl@ouc.edu.cn
责任编辑 于 卫
