响应面法优化鲫鱼鱼鳞酸溶性胶原蛋白提取工艺
2010-11-10朱秀灵戴清源蔡为荣
朱秀灵,戴清源,蔡为荣,王 建
(安徽工程科技学院生物化学工程系,安徽芜湖241000)
响应面法优化鲫鱼鱼鳞酸溶性胶原蛋白提取工艺
朱秀灵,戴清源,蔡为荣,王 建
(安徽工程科技学院生物化学工程系,安徽芜湖241000)
在单因素实验基础上,采用响应面法对影响酸溶性胶原蛋白(acid-soluble collagen,ASC)提取效果的3个因素即乙酸浓度、液料比和提取时间进行了优化,建立并分析了各因素与ASC得率关系的数学模型。结果表明:ASC最佳提取工艺条件为:乙酸浓度0.41mol/L,液料比12mL/g,提取时间54.81h,在此工艺条件下,ASC最高得率(以干基计)理论值为20.97%,而实测值可达20.68%,与理论预测值相比,相对误差为1.38%。ASC的相对溶解度在pH4时最大,当NaCl浓度低于3%(mg/mL)时,ASC的相对溶解度基本不变,当NaCl浓度大于3%(mg/mL)时,相对溶解度迅速降低,但都在40%以上。
酸溶性胶原蛋白,响应面法,优化,鱼鳞
胶原蛋白不仅是构成生物体的重要成分(如动物皮肤、骨骼、肌腱、韧带、软骨及血管等)[1],而且作为原料已被广范应用到食品、医药及化妆品等众多领域[2-3]。胶原蛋白的主要来源最初仅限于陆生动物如牛、猪等的骨骼和皮肤[4]。然而,近几年来,由于疯牛病及口蹄疫等疾病的爆发使人们对这些来源的胶原蛋白的安全性甚是担忧[5]。欧美、日本等国家相继出台了不少法规,限制从牛等哺乳动物皮骨中的提取物用于食品、医药等对人体直接影响的产品中[6]。另外,来源于猪的胶原蛋白由于宗教信仰问题,其应用也受到限制[7]。基于此,必须寻找新的胶原蛋白来源。鱼类加工副产物——皮肤、骨、鱼鳞等富含胶原蛋白,以此为原料提取胶原蛋白的报道较多,但大多以深海鱼类为主,而以淡水鱼鱼鳞为原料的报道尚少[8]。本实验以淡水鱼鲫鱼鱼鳞为原料,采用传统的酸法提取工艺,利用响应面分析法对酸溶性胶原蛋白(acid-soluble collagen,ASC)提取工艺进行优化,并初步探讨pH及NaCl浓度对ASC溶解度的影响。
1 材料与方法
1.1 材料与仪器
鱼鳞 购于本地集贸市场,活鱼屠宰后的鱼鳞用清水洗净,真空干燥(25℃),粉碎过80目筛,4℃保存,备用;乙二胺四乙酸二钠(EDTA-2Na)、乙酸、盐酸、柠檬酸、乳酸、氯化钠等 均为国产分析纯;牛血清白蛋白(BSA) 广州蕊特生物科技公司。
SP-754型紫外分光光度计 上海光谱仪器有限公司;DZX-型(60508)真空干燥箱 上海福玛实验设备有限公司;L-550台式大容量离心机 湘仪离心机有限公司;PHS-2C数显酸度计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 鲫鱼鱼鳞中ASC的提取工艺流程 鱼鳞粉(质量m1,g)→碱液处理→脱脂→脱钙→酸解→盐析→透析→真空干燥(质量为m2,g)
具体操作参照文献[3,9]进行,则 ASC得率η(%,以干基计)=m2/m1×100%。
1.2.2 响应面法优化提取工艺 应用Box-Behnken中心组合方法进行三因素三水平的实验设计。在单因素实验基础上,以酸液浓度,液料比,提取时间3个因素为自变量,分别以x1、x2、x3表示,按方程Xi=(xi-x0)/△x对自变量进行编码(Xi为自变量的编码值,xi为自变量的真实值,x0为实验中心点处自变量的真实值,△x为自变量的变化步长)。并以自变量的编码值+1、0、-1分别代表自变量的高、中、低水平,ASC得率Y为响应值,实验自变量因素编码及水平见表1。

表1 实验因素编码及水平表
1.2.3 紫外可见光谱分析 准确称取一定质量的ASC溶于0.02mol/L乙酸水溶液,得到2mg/mL ASC溶液[10-11]。在波长范围190~400nm下测定其吸光度,记录最大吸收波长。
1.2.4 ASC溶解度实验 参照文献[10,12-13]进行,先用0.5mol/L乙酸溶解胶原蛋白配制成质量浓度分为3mg/mL和6mg/mL的胶原蛋白溶液。然后分别考察 pH及 NaCl浓度对胶原蛋白溶解度的影响。
1.2.4.1 pH对ASC溶解度的影响 取10支离心管,各加入 8mL 3mg/mL的 ASC溶液,并用 6mol/L NaOH或6mol/L HCl溶液调节pH分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,然后加入蒸馏水(将其pH调整到与胶原蛋白pH相同)至溶液体积为10mL,磁力搅拌 30min后进行离心(30min,1000r/min)。测定上清液中蛋白质含量(mg/mL),计算ASC相对溶解度。
1.2.4.2 NaCl浓度对ASC溶解度的影响 将NaCl溶解于0.5mol/L乙酸中,制得质量浓度分别为0%、2%、4%、6%、8%、10%、12%(mg/mL)的NaCl溶液。分别取5mL不同质量浓度的NaCl溶液于离心管中,各加入5mL 6mg/mL的ASC溶液,混匀,则混合溶液中NaCl质量浓度分别为0%、1%、2%、3%、4%、5%、6%(mg/mL)。然后离心(30min,1000r/min),测定上清液中蛋白质含量(mg/mL),计算ASC相对溶解度。
1.2.4.3 ASC相对溶解度计算 以牛血清白蛋白为标准,参照文献[14]对上清液中蛋白质含量(mg/mL)进行测定。

式(1)中:V1为ASC溶液的体积,mL;C1为ASC溶液的浓度,mg/mL;V2为离心后上清液的体积,mL;C2为上清液中蛋白质含量,mg/mL。
2 结果与分析
2.1 紫外可见吸收光谱分析
通过测定ASC在波长190~400nm下的吸光度,得知最大吸收波长为222nm,这与ASC多肽链中含有的C=O、COOH、CONH2基团有关[10]。绝大部分蛋白质因含有一定量的酪氨酸和色氨酸,因此在280nm处具有最大吸收峰。苯丙氨酸在251nm处有最大吸收峰。而胶原蛋白在280nm及251nm处无显著吸收峰[11]。因此,实验所得蛋白质为胶原蛋白。
2.2 不同酸对ASC得率的影响
称取4份质量均为5g的鱼鳞,按照1.2.1操作,分别以0.5mol/L的盐酸、乙酸、柠檬酸、乳酸为提取剂,液料比为10mL/g,提取时间为72h,ASC得率见图1。由图1看出,不同酸液提取ASC得率不同,按得率由大到小依次为乙酸、柠檬酸、盐酸、乳酸。故实验选择乙酸作为ASC的提取剂。

图1 酸对ASC得率的影响
2.3 乙酸浓度对ASC得率的影响
称取5份质量均为5g的鱼鳞,以液料比为10mL/g分别加入浓度为 0.20、0.35、0.50、0.65、 0.80mol/L的乙酸,提取时间为72h,按1.2.1操作进行提取,结果如图2所示。
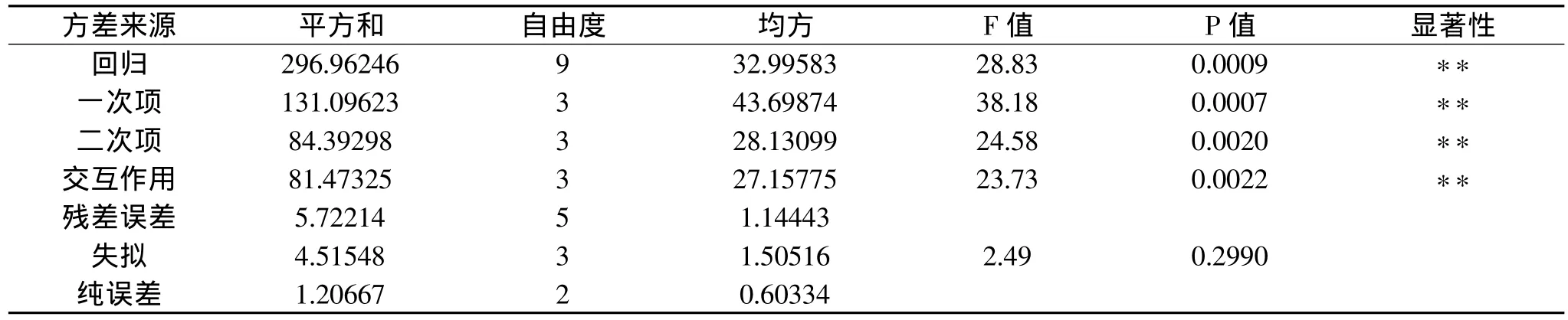
表3 回归方程的方差分析
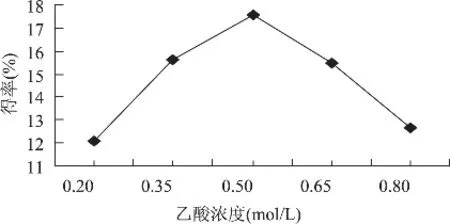
图2 乙酸浓度对ASC得率的影响
乙酸浓度对ASC得率的影响如图2,乙酸浓度为0.2~0.5mol/L时,ASC得率随着乙酸浓度的增加而增大;当乙酸为0.5mol/L时,得率最大为17.58%;当乙酸浓度大于0.5mol/L时,得率反而下降。这可能是随着乙酸浓度增大,溶液pH降低,胶原蛋白变性,致使溶解度降低,其得率也相应降低。故乙酸浓度以0.50mol/L较为合适。
2.4 液料比对ASC得率的影响
称取5份质量均为5g的鱼鳞,以液料比为5、10、15、20、25mL/g分别加入0.50mol/L的乙酸,提取时间为72h,按1.2.1操作进行提取,结果如图3所示。当液料比为5~10mL/g时,ASC得率急剧增加,液料比为10~15mL/g时,得率增加也较快,但相对于前者增加幅度较小;当液料比为15~25mL/g时,得率趋于平缓。考虑到酸液使用量大,后处理困难及成本高等问题,故液料比以10~15mL/g为合适范围。
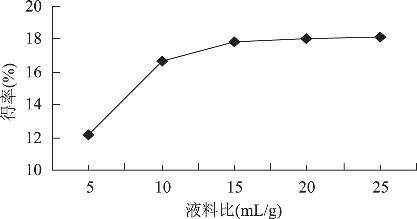
图3 液料比对ASC得率的影响
2.5 提取时间对ASC得率的影响
称取7份质量均为5g的鱼鳞,以液料比10mL/g加入0.50mol/L的乙酸,提取时间分别为24、36、48、60、72、84、90h,按1.2.1操作进行提取,结果如图4所示。
由图4得知,当提取时间为24~60h,ASC得率随着提取时间的延长而快速增加;当提取时间为60h时,得率达到17.45%;当提取时间大于60h,再随着时间延长,得率增加不明显。故提取时间以60h为最佳。
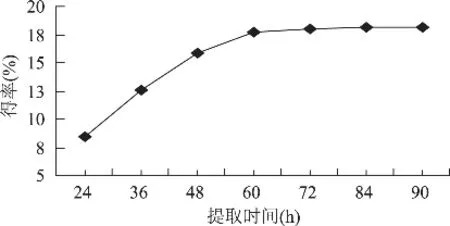
图4 提取时间对ASC得率的影响
2.6 鲫鱼鱼鳞中ASC提取工艺优化
在单因素实验基础上,以乙酸浓度、液料比和提取时间3因素3水平进行响应面实验设计及分析,实验因素编码及水平表见表1,实验设计及结果见表2。以编码值X1,X2,X3为自变量,以ASC得率Y为响应值,采用SAS RSREG程序进行响应面分析实验,结果见表3,因子经过回归拟合,解得回归方程为:
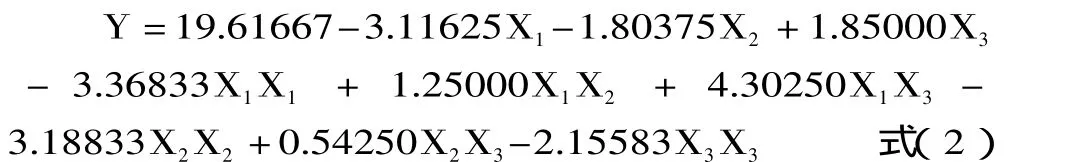
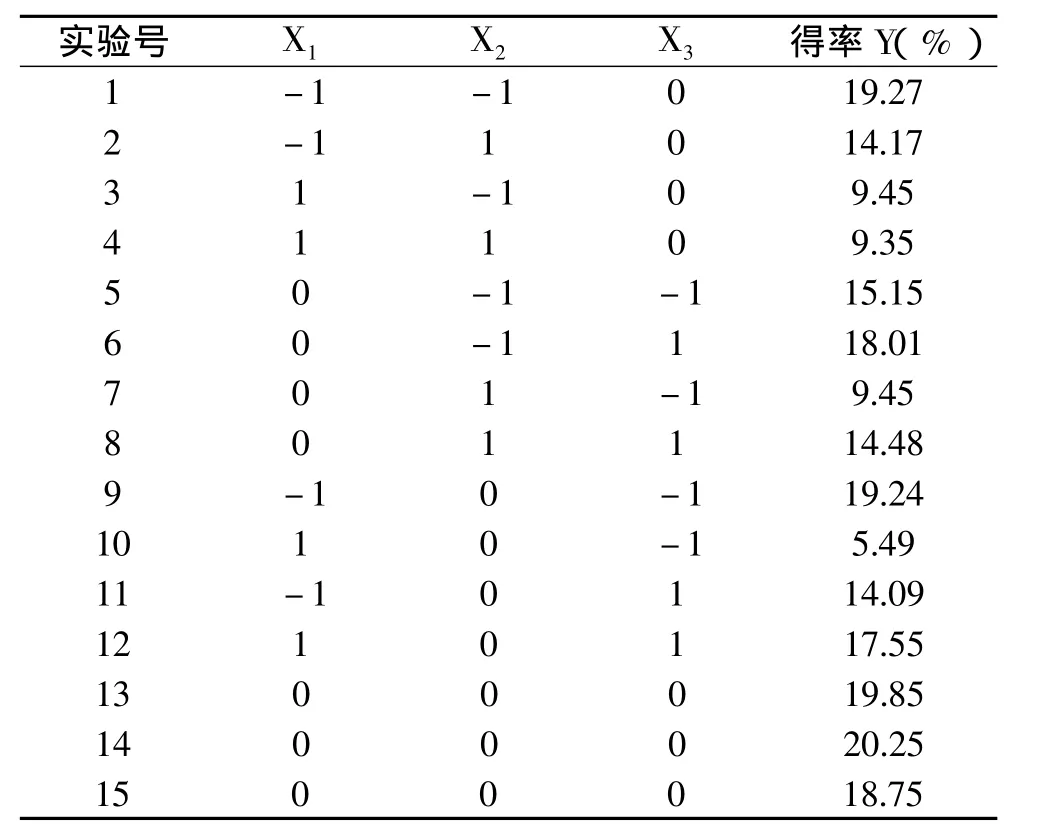
表2 ASC提取实验设计与结果
回归方程(2)的方差分析和参数估计分别见表3、表4。由表3可知,模型回归P为0.0009,说明模型回归高度显著可靠;一次项、二次项交互作用高度显著,说明各因素之间不是简单的线性关系,而是二次关系;失拟项F值较小,失拟项P为0.2990,表明失拟项不显著,说明该方程对实验拟合好,实验误差小。因此可以用该回归方程代替实验真实点对实验结果进行分析。由表4知,对方程影响显著程度由大到小依次为乙酸浓度、提取时间和液料比,三者对ASC得率的影响均高度显著,说明三者取值大小直接关系到ASC得率。模型的回归系数R2为0.9811,说明模型响应值即ASC得率的变化98.11%来自所选因变量,即乙酸浓度、液料比和提取时间的值,因此,回归方程可以较好地描述随机因子与响应值之间的关系,可以利用该回归方程确定最佳提取工艺条件。
图5~图7反映了乙酸浓度、液料比和提取时间三因素交互作用对响应值的影响。由图5可知,当液料比X2一定时,随着乙酸浓度X1的增加,胶原蛋白得率先是逐渐增大然后又逐渐减少;当乙酸浓度一定时,胶原蛋白得率随着液料比的增大也是先逐渐增大而后又逐渐减少。如编码X3为0,X1为-0.5时,当编码X2为-0.62时,ASC得率为20.60%,X2为-0.40时,得率为20.79%,X2为-0.09时,得率为20.55%,X2为0.20时得率又降低为19.77%。

表4 参数估计
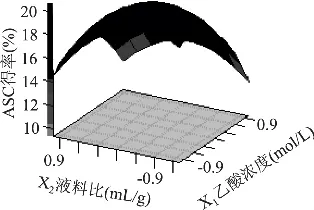
图5 乙酸浓度和液料比对ASC得率影响的响应曲面(X3=0)

图6 液料比和提取时间对ASC得率影响的响应曲面(X1=0)
图6表明,提取时间不变,随着液料比的增大,ASC得率先是逐渐增大而后又逐渐下降;当液料比一定时,提取时间编码X2在-1至1范围内变化,在一定时间内延长提取时间有利于ASC得率的提高,但超过一定值后ASC得率随时间延长变化不明显。由图7得知,乙酸浓度不变时,随着提取时间的延长,ASC得率也是先增加而后又逐渐减少。而提取时间不变时,随着乙酸浓度的增大,ASC得率呈下降趋势。
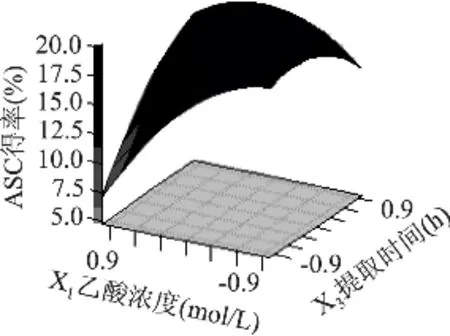
图7 乙酸浓度和提取时间对ASC得率影响的响应曲面(X2=0)
图5~图7表明,ASC得率与乙酸浓度、液料比和提取时间三个因素有关,且这三个因素存在最佳参数组合可以满足ASC得率达到理论最大值。再对三维非线性回归模型(2)取一阶偏导数等于零,得到如下方程组:

解方程组得X1=-0.8871,X2=-0.5009和X3= -0.5192,根据编码值与非编码值的转换式解得x1= 0.41mol/L,x2=12mL/g,x3=54.81h。即鲫鱼鱼鳞中ASC最佳提取工艺为乙酸浓度0.41mol/L,液料比12mL/g,提取时间54.81h,由回归方程可得ASC最高得率理论值可达到20.97%。在该提取工艺条件下,实际测得ASC得率为20.68%(三次平行实验的平均值,即 n=3),与理论预测值相比,相对误差为1.38%,因此,采用响应曲面分析法优化得到的提取工艺参数准确可靠,具有实用价值。
2.7 ASC的溶解度
按照1.2.4操作,pH及氯化钠对ASC的影响分别见图8、图9。
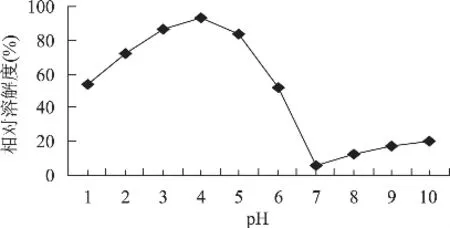
图8 pH对ASC溶解度的影响
pH对ASC溶解度影响(见图8)较大,当pH为4时,ASC相对溶解度最大为93.63%;当pH为7时,相对溶解度最小;而pH在7~10范围内,相对溶解度又随着pH增大而逐渐增大。其原因可能是胶原蛋白等电点在7附近,当pH接近蛋白质的等电点时,蛋白质所带净电荷接近零及蛋白质肽链间疏水相互作用增强,导致蛋白质分子聚集、沉淀,相对溶解度降低[13]。当pH偏离等电点时,蛋白质带有较多净电荷,蛋白质分子间相互排斥,因此蛋白质相对溶解度较高。
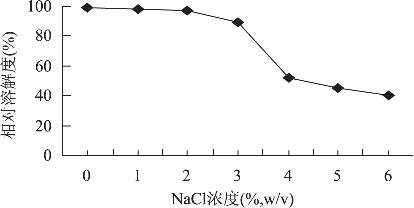
图9 NaCl对ASC溶解度的影响
由图9看出,当溶液中 NaCl浓度低于 3%(mg/mL)时,ASC在0.5mol/L乙酸中的溶解度稍微高于在 NaCl溶液中的溶解度;当 NaCl浓度为3%~4%时,相对溶解度随着NaCl浓度增大而迅速下降;当NaCl浓度大于4%时,相对溶解度缓慢下降;但是,ASC在NaCl溶液(1%~6%,mg/mL)中的相对溶解度均在40%以上。蛋白质在NaCl溶液中溶解度降低原因主要是由于较高离子浓度导致蛋白质分子间疏水相互作用增强,蛋白质与蛋白质发生聚集沉淀而使溶解度降低[15]。
3 结论
利用SAS9.1软件,采用响应面法(RSM)建立了鲫鱼鱼鳞ASC提取工艺条件的二次多项式数学模型,分析了各因素对响应值的影响。并对ASC在不同pH及NaCl溶液中的溶解度进行了初步分析。
结果表明:对响应值影响显著程度由大到小依次为乙酸浓度、提取时间和液料比;二次多项式数学模型拟合程度高,实验误差小。对响应回归方程进行一阶偏导数等于零,求出最佳提取工艺条件为:乙酸浓度0.41mol/L,液料比12mL/g,提取时间54.81h,在此条件下,ASC最高得率理论值为20.97%,而实测值可达20.68%,与理论预测值相比,相对误差为1.38%。ASC溶解度与溶液pH及离子强度(NaCl溶液)有关。当pH在等电点时,相对溶解度较低,偏离等电点时,相对溶解度增大,当pH为4时,相对溶解度最大为93.63%;当NaCl浓度低于3%,离子强度对ASC相对溶解度影响较小,当NaCl浓度大于3%时,相对溶解度先是迅速下降而后又趋于平缓,但都在40%以上。
[1]Senaratne LS,Park PJ,Kim SK.Isolation and characterization of collagen from brown backed toadfish(Lagocephalus gloveri)skin[J].Bioresource Technology,2006,97(2):191-197.
[2]Morimura S,Nagata H,Uemura Y,et al.Development of an effective process for utilization of collagen from livestock and fish waste[J].Process Biochemistry,2002,37(12):1403-1412.
[3]Ogawa M,Portier RJ,Moody MW,et al.Biochemical properties ofbone and scale collagens isolated from the subtropical fish black drum(Pogonia cromis)and sheepshead seabream(Archosargus probatocephalus)[J].Food Chemistry,2004,88(4):495-501.
[4]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanus vitta)[J].Food Chemistry,2005,93(3):475-484.
[5]Kittiphattanabawon P,Benjakul S,Visessanguan W,et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper(Priacanthus tayenus)[J].Food Chemistry,2005,89(3):363-372.
[6]胡业丽,吴洁,张瑞,等.酸法提取人工养殖鲟鱼皮中胶原蛋白工艺的研究[J].食品科技,2008,33(2):209-212.
[7]Sadowska M,Kolodziejska I,Niecikowska C.Isolation of collagen from the skins of Baltic cod(Gadus morhua)[J].Food Chemistry,2003,81(2):257-262.
[8]Zhang J,Duan R,Tian Y,et al.Characterisation of acidsoluble collagen from skin of silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2009,116(1):318-322.
[9]Duan R,Zhang J,Du X,et al.Properties of collagen from skin,scale and bone of carp(cyprinus carpio)[J].Food Chemistry,2009,112(3):702-706.
[10]Zeng S,Zhang C,Lin H,et al.Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia(0reochromis niloticus)[J].Food Chemistry,2009,116(4):879-883.
[11]Yan M,Li B,Zhao X,et al.Characterization of acid-soluble collagen from the skin of walleye pollock( Theragra chalcogramma)[J].Food Chemistry,2008,107(4):1581-1586.
[12]Nalinanon S,Benjakul S,Visessanguan W,et al.Use of pepsin for collagen extraction from the skin of bigeye snapper(Priacanthus tayenus)[J].Food Chemistry,2007,104(2):593-601.
[13]Montero P,Jiménez-Colmenero F,Borderìa J,et al.Effect of pH and the presence of NaCl on some hydration properties of collagenous material from trout(Salmo irideus Gibb)muscle and skin[J].Journal of the Science of Food and Agriculture,1991,54(1):137-146.
[14]LowryOH,RosebroughNJ,FarrAL,etal.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):256-275.
[15]Fennema OR著.食品化学[M].第三版.王璋,许时婴等译.北京:中国轻工业出版社,2003:307-308.
Optimization of extraction acid-soluble collagen from crucian carp scale by response surface methodology
ZHU Xiu-ling,DAI Qing-yuan,CAI Wei-rong,WANG Jian
(Department of Biochemistry Engineering,Anhui University of Technology and Science,Wuhu 241000,China)
Based on the single factor experiments,the effects of acetic acid concentration,ratio of solvent to solid and extraction time on the yield of acid-soluble collagen(ASC)from crucian carp scale were optimized with response surface methodology.A methematical model was established and analyzed to describe the relationships between the factors and the response of the yield of ASC from crucian carp scale.The results showed that the optimum extracting conditions for ASC were as follows:the concentration of acetic acid 0.41mol/L,the ratio of solvent to solid 12mL/g and extraction time 54.81h.Under the optimum conditions,the predictive maximum yield of ASC on the dry weight basis was 20.97%and experimental value was 20.68%.Comparing predictive value with experimental value,the relative error was 1.38%.The highest relative solubility of ASC from crucian carp scale was obtained at pH4.No changes in solubility were found in the presence of NaCl up to 3%(mg/mL).However,a sharp decrease but no less than 40%in solubility was observed with NaCl above 3%(mg/mL).
acid-soluble collagen(ASC);response surface methodology;optimization;scale
TS254.1
B
1002-0306(2010)11-0247-05
2009-11-25
朱秀灵(1978-),女,硕士,讲师,研究方向:农副产品资源开发与利用。
安徽省高等学校省级自然科学研究项目(KJ2009B091);安徽工程科技学院青年基金项目(2008YQ050)。
