5,7-二溴-8-羟基喹啉锰配合物催化H2O2选择氧化乙苯
2010-11-06卢春丽伏再辉刘亚纯刘凤兰秦金纬何乡陵尹笃林
卢春丽 伏再辉 刘亚纯 刘凤兰 秦金纬 何乡陵 尹笃林
(湖南师范大学化学化工学院,资源精细化与先进材料湖南省高校重点实验室,化学生物学及中药分析教育部重点实验室,长沙 410081)
5,7-二溴-8-羟基喹啉锰配合物催化H2O2选择氧化乙苯
卢春丽 伏再辉*刘亚纯 刘凤兰 秦金纬 何乡陵 尹笃林
(湖南师范大学化学化工学院,资源精细化与先进材料湖南省高校重点实验室,化学生物学及中药分析教育部重点实验室,长沙 410081)
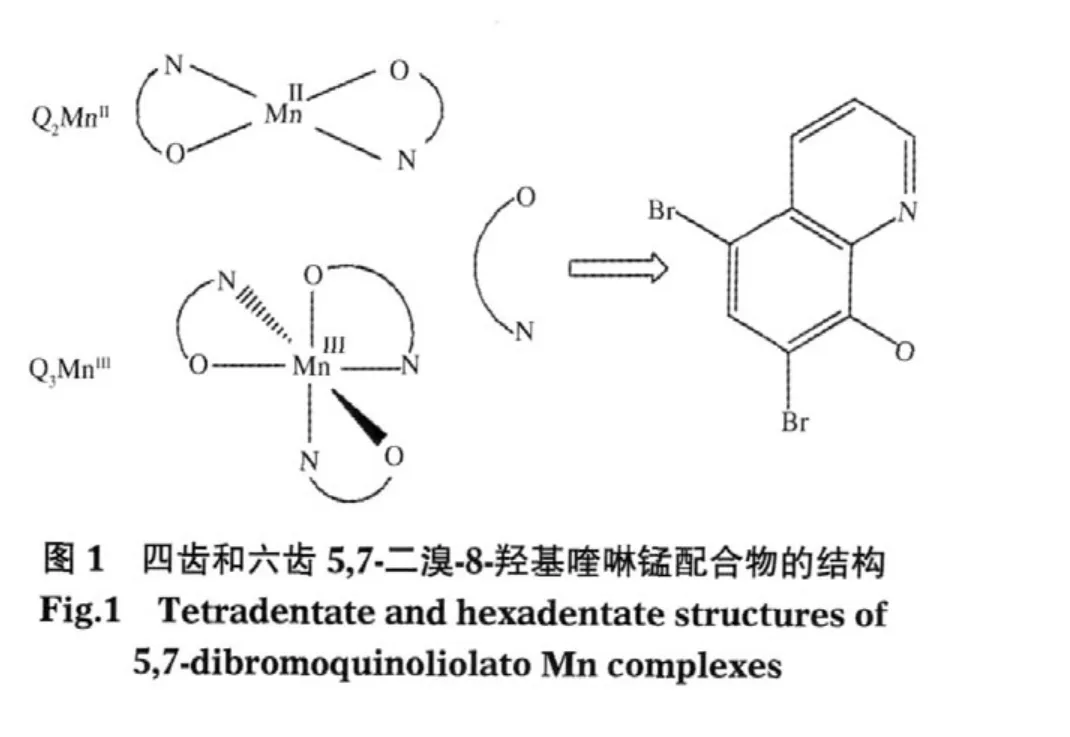
设计合成了5,7-二溴-8-羟基喹啉锰的四齿和六齿配合物(Q2MnII和Q3MnIII),并用傅里叶变换红外(FTIR)光谱对两个配合物进行了表征.以醋酸铵和醋酸为助剂,丙酮-水作溶剂,两个锰配合物在室温20℃下能高选择性催化双氧水氧化乙苯制苯乙酮的反应,Q3MnIII比Q2MnII具有更高的催化活性和选择性.在优化的反应条件下,乙苯转化率达27%,苯乙酮的选择性>95%;而且催化剂稳定性良好,可循环使用三次.
5,7-二溴-8-羟基喹啉锰配合物; 六齿配合物; 乙苯; 苯乙酮; 选择氧化
作为一种重要的有机化合物和中间体,苯乙酮越来越多地被用于香料、医药、树脂、醇类、脂类、醛类和催泪瓦斯的合成,也可作为纤维树脂的溶剂.乙苯侧链氧化的有效性和苯乙酮的产率有密切的关系,所以一个有效的催化体系对于乙苯的侧链氧化很重要.基于过渡金属盐及配合物催化分子氧产生自由基参与乙苯α-位氢的氧化生成苯乙酮是常用的一种方法[1-14],其中Co(II)或Mn(II)是目前报道最有效的催化体系之一[8],但这一催化过程用醋酸介质和溴盐助剂对设备腐蚀严重,反应条件比较苛刻(≥120℃),产物选择性较差.为了改善基于分子氧参与的乙苯选择氧化过程,一些研究者发展了N-羟基邻苯二甲酰亚胺(NHPI)和过渡金属共催化分子氧选择氧化乙苯过程[9-14],这一个过程有着反应条件相对温和(约100℃)和苯乙酮收率高的优点.但是需要使用昂贵的NHPI限制它的工业应用前景.双氧水作为一种环境友好型氧化剂,因反应副产物为水,且反应后容易处理,所以以H2O2为氧化剂的乙苯氧化受到了很多的关注[15-22],其中含钒[15-16,18]、铁[17]、钛[18,20-21]或其它杂原子[22]的催化剂能有效催化这一氧化反应.但这些催化体系或多或少存在如下不足: (1)使用一些具有毒性的金属如V、Cr和Mo作催化剂,以及有毒的乙腈等作溶剂,反应体系不够环境友好;(2)反应温度较高,产物选择性较差和双氧水利用率较低,反应过程原子经济性不够理想.因此,发展在温和反应条件下实现乙苯与双氧水的选择氧化的环境友好催化体系仍然是人们追求的目标.
我们在研究Mn基催化双氧水选择氧化有机反应中发现,一类六齿配位的8-羟基喹啉锰配合物在室温和相对绿色的丙酮-水介质中,能高效催化H2O2环氧化烯烃[23-24]、选择氧化醇[25]和硫醚[26]反应.为了拓展这类配合物在有机选择氧化中的应用,我们尝试把它们用于催化较不活泼的C—H化合物如乙苯的氧化过程.这里,我们报道了5,7-二溴-8-羟基喹啉锰配合物以醋酸铵和醋酸为助剂,在丙酮-水介质中催化H2O2氧化乙苯制苯乙酮反应中取得的一些初步研究结果.
1 实验部分
1.1 试 剂
实验所需的丙酮、无水乙醇均为分析纯,湖南师大化学发展有限公司生产;30%H2O2,分析纯,广东汕头西陇化工厂生产;5,7-二溴-8-羟基喹啉,分析纯,阿法埃莎(天津)化学有限公司生产;25%-28%氨水,分析纯,湖南株洲市化学化工研究所生产;醋酸锰,分析纯,广东汕头西陇化工厂生产;乙苯,分析纯,天津市科密欧化学试剂开发中心生产;三苯基膦,分析纯,南京市翔泰化工有限公司生产;水为二次蒸馏水.
1.2 催化剂制备
六齿锰配合物的制备参照文献[23]进行,将1 mol· L-1的Mn(OAc)2乙醇溶液5 mL滴加到30 mL含有15 mmol的5,7-二溴-8-羟基喹啉的乙醇溶液中,再滴加0.57 g(5 mmol)30%H2O2,所得溶液用氨水调节pH至6-7.常温下搅拌2-3 h,过滤,用乙醇洗涤固体物质3次,空气气氛100℃烘干,得到灰黄色固体5,7-二溴-8-羟基喹啉锰(III)(Q3MnIII),收率为95%.采用Mn2+与配体的摩尔比为1∶2,不使用氧化剂H2O2,按上述方法可制备四齿锰配合物(Q2MnII,收率95%),Q2MnII和Q3MnIII结构如图1所示.
1.3 催化剂的锰含量测定
称取约0.1 g催化剂于锥形瓶中,在其中加入4 mL王水,煮沸至干,再用王水同样方法处理两次.加入2 mL浓盐酸将固体加热溶解至溶液呈淡黄色,然后加入浓氨水将溶液调至碱性,接着加入10 mL氨水-氯化铵的缓冲溶液(pH=10),再分别加入0.02 g抗坏血酸和酒石酸.将所得溶液加热到70℃,滴入3-4滴铬黑T溶液作指示剂,然后用乙二胺四乙酸(EDTA,10 mmol·L-1)溶液滴定,当溶液由红色变蓝时即为滴定终点.平行滴定三次取平均值.测定Q3MnIII的锰含量为5.64%(w),与按六齿配位结构计算值5.72%(w)非常相近;测定样品Q2MnII的锰含量为8.24%(w),与其四齿配合结构计算值8.35%(w)基本相符.
1.4 催化剂的表征
用Nicolet310 FT-IR光谱仪(美国)在400-4000 cm-1范围内测定样品的红外光谱(KBr压片法);用UV-3310型紫外分光分度仪(日本日立公司)对固体样品在200-800 nm范围进行扫描,以BaSO4作标准;运用Ganssinan03化学程序包,采用密度泛函理论(DFT)的B3LYP方法,6-311+(d)基组对六齿和四齿锰配合物结构进行计算.
1.5 催化反应

将0.01 mmol催化剂,1 mmol乙苯,2.25 mL丙酮和0.75 mL助剂(0.2 mmol NH4OAc和0.1 mmol HOAc)水溶液置于10 mL的烧瓶中,充分搅拌后,把0.34 g 30%的H2O2(3 mmol)慢慢滴加进去,室温下搅拌直到检测氧化剂消耗完.反应结束后,经过滤除去催化剂的反应液用Agilent Technologies 6890N气相色谱(安捷伦科技有限公司)定量分析(FID检测器,SE-30石英毛细管柱).测定条件:柱温100℃,汽化室温度250℃,N2流速1.0 mL·min-1.另取反应液加入三苯基膦搅拌1 h再进行分析,通过对比加三苯基膦的分析结果可以确定产物中没有过氧化物.产物组分用Shimadazu GC-MS QP-2010(日本岛津公司)进行鉴定.
2 结果与讨论
2.1 催化剂的表征
运用Ganssinan 03化学程序包,采用密度泛函理论(DFT)的B3LYP方法,6-311+(d)基组对六齿和四齿8-羟基喹啉锰类配合物的结构进行优化,并计算它们的Mn—O和Mn—N键长.结果表明(见图2和表1),Q3MnIII中Mn3+与三个配体配位生成一个八面体配合物,其中有一个Mn—O和Mn—N键分别比其它两个Mn—O和Mn—N键稍长,表明它具有畸变八面体结构[27].而Q2MnII的Mn2+与二个配体配位生成一个四齿平面配合物,它的两个Mn—O和Mn—N键长彼此相等,说明这类四齿配合物不存在畸变效应.
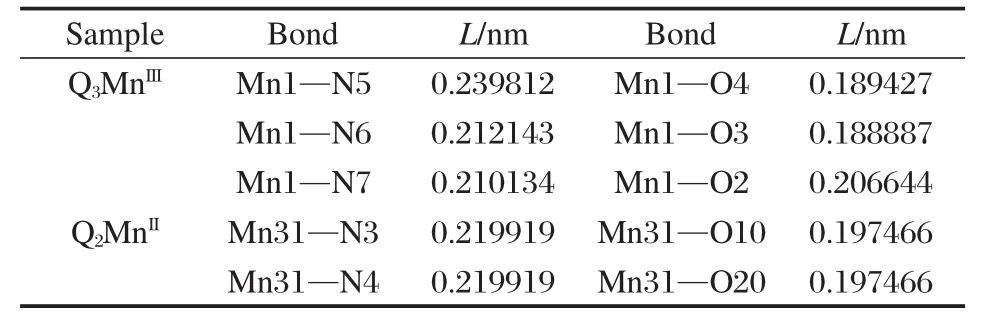
表1 Q3MnIII和Q2MnII的Mn—O和Mn—N键长(L)Table 1 Various Mn—N bond and Mn—O bond distances(L)of Q3MnIIIand Q2MnIIcomplexes
对5,7-二溴-8-羟基喹啉(HQ)和它的二配Q2MnII及三配Q3MnIII锰配合物的红外光谱进行了对比(图3,表2).在配体的红外光谱中,1568 cm-1为C═N伸缩振动带,1332、1396和1490 cm-1为C═C伸缩振动带,1045 cm-1为C—O伸缩振动带,562、652和723 cm-1为配体的面内弯曲振动带(δligand),而497 cm-1为C—O弯曲振动带(δC—O)[28].在Q2MnII和Q3MnIII样品的红外光谱中,这些特征带都发生了不同程度的位移,这应归因于配体与Mn离子的配位作用.进一步比较Q2MnII和Q3MnIII的红外谱图可以发现,两者在800-1600 cm-1区域的谱图很相似,但在400-800 cm-1指纹区内有细微的区别,与Q2MnII相比,Q3MnIII的δC—O峰和在650 cm-1的δligand峰明显变宽,而且在570 cm-1左右的δligand峰被分裂成了两个.在Q3MnIII中存在的这些红外特征有可能与它的Mn3+与三个配体之间的配位存在差异有关,这种差异要归因于Mn3+(d4)在八面体配位场中具有Jahn-Teller效应[29],易导致Q3MnIII具有畸变八面体结构;而Q2MnII中的Mn2+(d5)不存在Jahn-Teller效应,它与两个配体配位是等同的,这与上述理论计算结果是相吻合的.


表2 催化剂及配体的红外谱图数据Table 2 FT-IR spectral data of catalysts and ligand
2.2 催化反应
2.2.1 助剂的影响
在丙酮-水介质中,首先考察了各类助剂对Q3MnIII在室温下催化乙苯与双氧水选择氧化反应的影响(见表3的Entries 1-6).在没有助剂的帮助下,Q3MnIII能催化这一氧化反应,在双氧水消耗完时给出8.0%的转化率和88%的苯乙酮选择性(Entry 1);Entry 2说明使用酸性的HOAc(在丙酮水溶液中pH=5.23)助剂能显著加速Q3MnIII催化双氧水的分解反应,导致其转化率和选择性明显下降;NH4OAc (pH=8.09)助剂能加速这一催化反应,明显提高转化率和选择性(Entry 3);使用碱性稍强的Na2HPO4(pH= 8.60)助剂能稍微提高乙苯转化率(Entry 4);而使用碱性更强的NaHCO3(pH=9.30)助剂尽管可提高苯乙酮选择性,但由于加快双氧水的分解而导致转化率有所下降(Entry 5);Entry 6说明当使用pH为7.13的NH4OAc-HOAc混合助剂时效果达到最佳,其转化率、选择性和双氧水有效利用率分别达27.0%、97%和54.0%.上述结果表明这一催化氧化反应适合于在含有一定量OAc-的中性反应介质中进行. Entry 7说明用Q2MnII作催化剂时,在同样反应条件下其转化率(17.5%)和选择性(81%)与Q3MnIII的相比明显偏低,表明锰催化剂的价态和配位模式对其催化氧化性能有显著影响.有趣的是过氧醋酸可直接氧化乙苯到苯乙酮,给出8.0%的转化率和78%的选择性(Entry 8).
使用NH4OAc和HOAc作助剂,考察了温度对Q3MnIII催化性能的影响,其结果见Entries 9-10.随着温度的升高,反应速度加快,反应时间缩短,但由于双氧水分解速度加剧使转化率有所下降.值得一提的是,当前的温度变化对产物的选择性没有影响.
2.2.2 催化剂浓度的影响
在上述优化条件下,进一步考察了Q3MnIII催化剂浓度对催化性能的影响,结果如图4所示.当催化剂浓度在0.50%到1.00%之间时,转化率是随其浓度增加而上升的,这符合一般的催化反应规律;但是当催化剂浓度进一步增加时,转化率反而有所降低.造成这一现象的原因还有待研究,也许是Q3MnIII在反应介质中几乎不溶,在其浓度过高时易出现它与底物混合不好现象,由于Mn3+的过渡金属络合物有催化双氧水分解副反应的倾向[25,30],在双氧水大大过量情况下,有可能更易发生这一分解反应.从图4可知,适宜的催化剂浓度为1.00%.
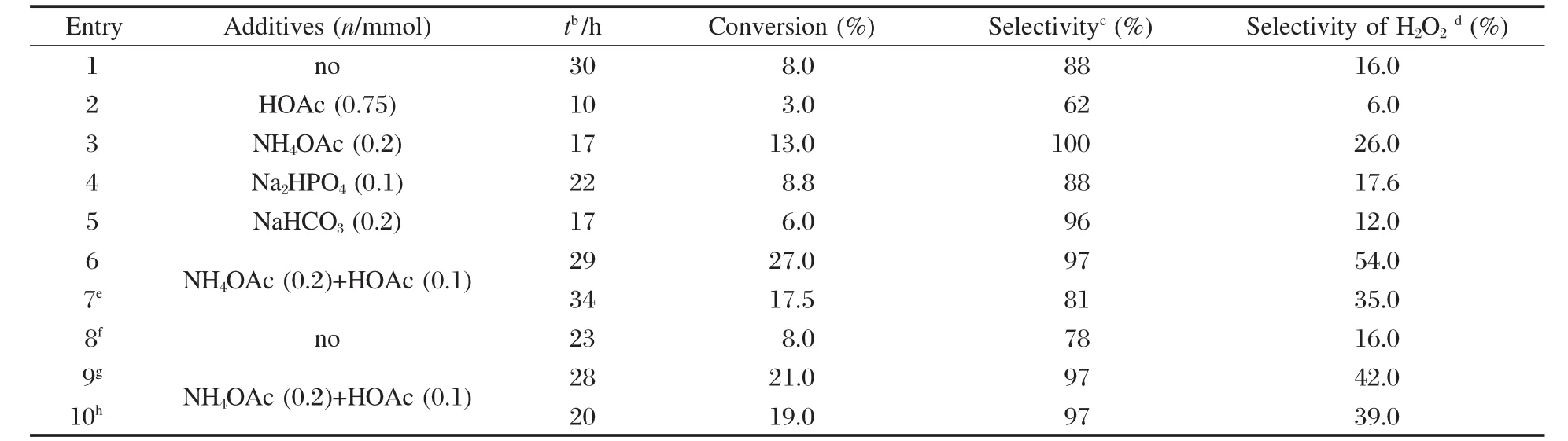
表3 助剂和温度对Q3MnIII催化乙苯与双氧水氧化反应的影响Table 3 Effect of additive and temperature on the Q3MnIIIcatalyzed oxidation of ethylbenzene with H2O2a

2.2.3 氧化剂用量的影响
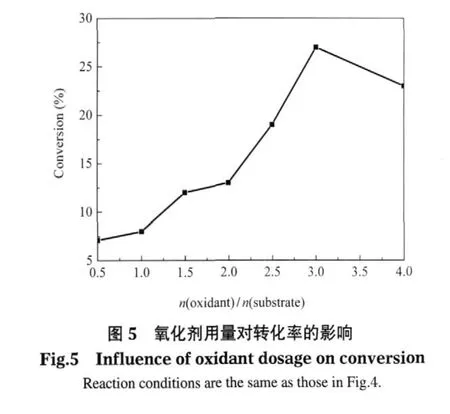
在0.01 mmol Q3MnIII催化剂和NH4OAc-HOAc助剂的作用下,考察了氧化剂用量对这一催化氧化反应的影响,结果如图5所示.从图5中可以看到,当乙苯的用量固定为1 mmol时,随着氧化剂量的增加,乙苯氧化的转化率不断上升,直到氧化剂量为乙苯量的3倍时,得到了最佳的结果.但是当氧化剂量增加到乙苯用量的4倍时,转化率反而有所降低.这也许是在使用过多的氧化剂情况下,一方面由于反应介质中的水量增加,易导致底物溶解性变差;另一方面会增加氧化剂对催化剂的破坏作用.
2.2.4 催化剂的重复利用
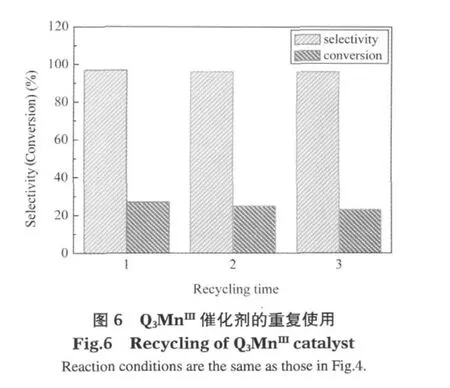
Q3MnIII催化剂在该体系中是不溶的,可以通过离心的方法把它从反应液中分离回收,用丙酮与水洗涤,干燥后再次用于该催化反应.从图6中可以发现,催化剂在3次重复使用过程中,乙苯转化率只有≤4%的变化,而选择性没有变化.图7是新鲜和回收催化剂的固体紫外-可见光谱图,在图中,新鲜催化剂在424 nm存在一个金属与配体之间的电荷转移带(MLCT)[23];使用过的催化剂无论从光谱曲线形状,还是MLCT带的位置和强度都与新鲜催化剂无甚差别.这些结果一致表明Q3MnIII在该反应体系中是比较稳定的.
2.3 催化反应机理推测
基于上述反应结果和相关的文献报道[24-25],我们推测在质子酸的作用下(见图8),Q3MnIII(1)易与双氧水反应,通过打开它最长的Mn—O键形成一个五齿结构的Q3MnIII-OOH中间体(2);接着中间体(2)与OAc-作用生成一个过氧醋酸根中间体Q3MnIII-OOAc(3),最后中间体(3)可能通过自由基反应途径直接氧化乙苯生成苯乙酮,同时再生成催化剂(1).上面使用过氧醋酸直接氧化乙苯的实验结果(Entry 8,表3)支持中间体(3)作为乙苯氧化的关键中间体.此外这一机理能够合理解释一些助剂的添加效应,显而易见,使用碱性助剂Na2HPO4,特别是NaHCO3是不利于发生催化剂结构由(1)向(2)的转变,自然给出差的反应结果;尽管醋酸提供的质子酸有利于(1)向(2)的转变,但它低的电离度不能提供足够多的OAc-来形成(3)这种关键中间体;显而易见,在含醋酸铵和醋酸的反应介质中,(3)是最易形成的,这一点得到了上面反应结果的证实.


3 结 论
设计合成了四齿和六齿配位的5,7-二溴-8-羟基喹啉锰配合物(Q2MnII和Q3MnIII),研究了它们在催化双氧水选择氧化乙苯制苯乙酮反应中的催化性能,发现具有畸变八面体结构的Q3MnIII是催化这一反应的有效催化剂.发展的Q3MnIII催化体系具有反应条件温和,使用的丙酮-水介质相对绿色环保,催化剂易制备可循环使用等优点.如何提高该催化反应体系的双氧水利用率将是我们下一步研究的重点.
1 Yang,G.Y.;Ma,Y.F.;Xu,J.J.Am.Chem.Soc.,2004,126: 10542
2 Wang,R.M.;Chai,C.P.;He,Y.F.;Wang,Y.P.;Li,S.B.Eur. Polym.J.,1999,35:2051
3 Colin,E.;Michael,S.S.;Raymond,W.W.Combust.Flame,2003, 132:291
4 Yasuhiko,K.J.Inorg.Organomet.Polym.,2000,10:127
5 Ma,H.;Xu,J.;Chen,C.;Zhang,Q.H.;Ning,J.B.;Miao,H.; Zhou,L.P.;Li,X.Q.Catal.Lett.,2007,113:104
6 Chisem,I.C.;Martin,K.;Shieh,T.;Chisem,J.;Clark,J.H.; Jachuck,R.;MacQuarrie,D.J.;Rafelt,J.;Ramshaw,C.;Scott,K. Org.Proc.Res.Dev.,1997,1:365
7 Punniyamurthy,T.;Velusamy,S.;Iqbal,J.Chem.Rev.,2005,105: 2329
8 Ma,H.;Xu,J.;Chen,C.;Zhang,Q.H.;Ning,J.B.;Miao,H.; Zhou,L.P.;Li,X.Q.Catal.Lett.,2007,113:3
9 Yoshino,Y.S.;Hayashi,Y.;Iwahama,T.J.Org.Chem.,1997,62: 6810
10 Recupero,F.;Punta,C.Chem.Rev.,2007,107:3800
11 Xu,H.F.;Tang,R.R.;Gong,N.H.Progress in Chemistry,2007, 19:1736 [许海峰,唐瑞仁,龚年华.化学进展,2007,19:1736]
12 Ishii,Y.;Nakayama,K.;Takeno,M.J.Org.Chem.,1995,60: 3934
13 Masui,M.;Ueshima,T.;Ozaki,S.S.J.Chem.Soc.,1983,8:479
14 Einhom,C.;Einhom,J.;Marcada1-Abbadi,C.Chem.Commun., 1997,(13):447
15 Maurya,M.;Kumar,M.;Kumar,U.J.Mol.Catal.A,2007,273: 133
16 Maurya,M.;Arya,A.;Adao,P.Appl.Catal.A,2008,351:239
17 Balland,V.;Mathieu,D.J.Mol.Catal.A,2004,215:81
18 Mal,N.K.;Ramaswamy,A.V.Appl.Catal.A,1996,143:75
19 Xavier,K.O.;Chacko,J.;Mohammed,Y.K.K.Appl.Catal.A, 2004,258:251
20 Mal,N.K.;Ramaswamy,A.V.Appl.Catal.A,1996,143:75
21 Qiao,J.D.;Li,Q.;Xing,Y.Fine Chemicals,2001,8:475 [乔庆东,李 琪,刑 宇.精细化工,2001,8:475]
22 Ronny,N.;Mauricio,D.V.J.Mol.Catal.A-Chem.,1993,84:93
23 Zhong,S.;Tan,Y.M.;Fu,Z.H.J.Catal.,2008,256:154
24 Zhong,S.;Tan,Y.M.;Fu,Z.H.Adv.Synth.Catal.,2008,350: 802
25 Ye,Z.P.;Fu,Z.H.;Zhong,S.J.Catal.,2009,261:110
26 Xie,F.;Fu,Z.H.;Zhong,S.J.Mol.Catal.A,2009,307:93
27 Xie,F.;Fu,Z.H.;Zhong,S.Chinese Journal of Catalysis,2009, 10:981 [谢 芳,伏再辉,衷 晟.催化学报,2009,10:981]
28 Chisem,I.C.;Martin,K.;Shieh,M.T.Org.Process Res.Dev., 1997,1:365
29 Hubin,T.J.;McCormick,J.M.;Alcock,N.W.;Busch,D.H. Inorg.Chem.,2001,40:435
30 Zhao,G.D.;Lü,Y.;Xi,Z.W.Chemistry,2004,67(11):w089 [赵公大,吕 迎,奚祖威.化学通报,2004,67(11):w089]
Selective Oxidation of Ethylbenzene with Hydrogen Peroxide Catalyzed by 5,7-Dibromo-8-quinolinolato Manganese Complexes
LU Chun-Li FU Zai-Hui*LIU Ya-Chun LIU Feng-Lan QIN Jin-Wei HE Xiang-Ling YIN Du-Lin
(Key Laboratory of Resource Fine-Processing and Advanced Materials of Hunan Province,Key Laboratory of Chemical Biology and Traditional Chinese Medicine Research of Ministry of Education of China,College of Chemistry and Chemical Engineering,Hunan Normal University,Changsha 410081,P.R.China)
Two 5,7-dibromo-8-quinolinolato manganese complexes in tetradentate(Q2MnII)and hexadentate (Q3MnIII)modes were prepared and then characterized by Fourier transform infrared(FT-IR)spectrometry.We found that both Mn complexes,together with NH4OAC and HOAc,efficiently catalyzed the oxidation of ethylbenzene to acetophenone by hydrogen peroxide in an acetone-water medium at 20℃.Q3MnIIIshowed much higher catalytic activity for this reaction than Q2MnII,affording a 27%ethylbenzene conversion and more than 95%selectivity for acetophenone under optimum conditions.Q3MnIIIwas reused three times without significant deactivation,indicating good stability.
5,7-Dibromo-8-guinolinolato Mn(III)complex;Hexadentate mode;Ethylbenzene; Acetophenone; Selective oxidation
O643
Received:February 17,2010;Revised:June 9,2010;Published on Web:August 3,2010.
*Corresponding author.Email:fzhhnu@tom.com;Tel:+86-731-88872576;Fax:+86-731-88872531.
The project was supported by the National Natural Science Foundation of China(20873040,20573035).
国家自然科学基金(20873040,20573035)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
