大豆蛋白组分功能性质的比较研究
2010-11-04曲家妮杨晓泉
曲家妮 杨晓泉
(华南理工大学轻工与食品学院食物蛋白工程研究中心,广州 510640)
大豆蛋白组分功能性质的比较研究
曲家妮 杨晓泉
(华南理工大学轻工与食品学院食物蛋白工程研究中心,广州 510640)
系统比较了两种大豆蛋白分级方法所得蛋白组分的亚基组成、蛋白质得率以及组分流向、溶解性和乳化活性等物化性质和功能性质,结果表明两种方法的蛋白组分在不同性质上表现各有异同。Nagano的IM和 Samoto的LP组分的亚基组成差异较大。Nagano组分总蛋白得率略高于 Samoto。相对于 7S组分,两种分级方法的大豆蛋白均更多地集中于 11S和 I M/LP组分。Nagano和 Samoto法的蛋白质分别在 11S和LP组分富集。11S和7S组分的脂量分布低于 I M或LP组分,Samoto的LP组分脂分布率明显高于其他组分。Naga2 no和 Samoto蛋白组分等电点在 pH 4.5左右,Samoto的LP组分由于其较高脂含量而溶解度最低且对 pH不敏感。Nagano和 Samoto组分中 7S组分的乳化活性较高,Samoto的LP由于其低溶解性而使乳化活性最低。
大豆蛋白 分级 11S 7S 功能性质
大豆是重要的植物蛋白来源之一,电泳分析表明大豆蛋白主要由功能和营养特性各异的 2S、7S、11S和15S球蛋白组成。随着科技和工业的发展,越来越精细的大豆蛋白分级方法逐步实现了不同功能性质蛋白的生产和加工,从而拓宽大豆蛋白的应用领域。大豆7S球蛋白具有较高的营养保健功能,通过降低血液胆固醇[1-3]和甘三脂[4-6]等降低心脑血管疾病的功效, Tsuruki等[7]发现 7S球蛋白还具有抗癌作用。
近年来新发明的大豆蛋白分级方法主要有 Na2 gano法[8]和 Samoto法[9],这两种方法都采用三步法分级大豆蛋白。Nagano法用亚硫酸钠代替以往使用的巯基乙醇作为还原剂,结合 11S球蛋白的低温冷沉性质将大豆蛋白分为三种组分:富含 11S和 7S球蛋白的组分,以及 11S和 7S混合的 I M(Inter midiate Protein)组分,其中富含 11S和 7S组分的纯度均在90%以上。Nagano法成为目前实验室分离大豆蛋白广泛使用的方法,其富含 11S和 7S球蛋白的组分已广泛用于 11S和 7S球蛋白功能性质的研究[10-11]。大豆蛋白经 Samoto法分级得到 11S和 7S组分的同时,还可以得到脂质量分数高达 11%的亲脂性蛋白 (Lipophilic Protein,LP)组分。这些亲脂性蛋白主要是与磷脂、糖脂等极性脂相结合,Samoto法作为新近提出的大豆蛋白分级分离方法,对其蛋白组分功能性质的研究还未见报道。
通过系统比较 Nagano和 Samoto组分的亚基组成、蛋白质得率、组分的分布、溶解性和乳化活性等性质,从分级方法的角度研究大豆蛋白的物化和功能性质。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕:许昌邦迪蛋白有限公司,蛋白质质量分数 55.0%(干基),含水量 10.0%。
摇摆式高压万能粉碎机DYF-500:温岭市林大机械有限公司;水浴恒温振荡器 THZ-82:江苏金坛宏华仪器厂;冷冻干燥机DELTAT-24/LSC:德国 Christ公司;高速冷冻离心机CR22G:日本日立公司;三恒电泳仪 ECP3000:北京市六一仪器厂;快速定氮仪 Rapid N Cube:德国 Elementrar公司;流变仪 RS600,德国Hakke公司;均质机 T25,德国 IKA公司。
1.2 试验方法
1.2.1 大豆蛋白组分的制备
将低温脱脂豆粕常温粉碎后过 60目筛,分别按照Nagano法和 Samoto法将大豆蛋白分级分离,得到11S、中间蛋白组分 (Inter mediate Protein,I M)或亲脂性蛋白以及 7S组分,冷冻干燥后置于 4℃密封备用。
1.2.2 聚丙烯酰胺凝胶电泳 (SDS-PAGE)
根据 Laemmli[12]的方法进行 SDS-PAGE分析,浓缩胶和分离胶质量分数分别为 12.5%和 3%,考马斯亮蓝 R250染色。参照Mujoo等[13]的方法辨别11S和 7S各亚基,通过QuantityOne软件分析各亚基对应光密度,其中 11S和 7S组分的纯度为各自亚基的密度之和与 11S和 7S总密度的比值。
1.2.3 蛋白质含量和得率的测定
采用 Duams定氮的方法测定样品的蛋白质含量,蛋白质转换系数为 6.25。根据所得各蛋白组分的蛋白质含量、脱脂豆粉的质量和总蛋白质含量,可得各组分的蛋白质得率,即各组分蛋白质得率 =各组分中蛋白质的质量/原脱脂豆粉中蛋白质的质量 × 100%。3次测量取平均值。
1.2.4 脂含量的测定
参考 GB 2906—1982采用索氏抽提法测定各级分的脂含量,以氯仿:甲醇 (体积比 2:1)为抽提剂。其中:脂含量(干基)=脂类质量/试样质量/(1-含水量)×100%。
1.2.5 溶解度
采用Lowry法于 500 nm处测吸光值的方法测定样品溶解性:将蛋白样品溶于去离子水使其质量分数为 1%。用2 mol/L NaOH调pH至2、3、4、4.5、5、6、7、8、9、10、11和 12,搅拌 1 h。取适量溶液于 50 mL离心管,离心(10 000×g,10 min,20℃)后取上清液,样品平行测量 3次。
1.2.6 乳化活性
乳化活性系数 EA I测定按照 Rickert法[15]略有改动。将蛋白组分溶于去离子水配成 0.1%,将 3 mL蛋白溶液和 1 mL大豆油于 10 000×g均质 1 min。立即用0.1%SDS溶液将其稀释 50倍,于 500 nm处测吸光值近似比较样品的 EA I。样品重复测定 3次。
2 结果与讨论
2.1 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
图 1表明两种方法对应组分的亚基组成情况各有异同。其中 Nagano 11S组分的纯度与 Samoto相似,I M组分的亚基组成主要是 11S和 7S球蛋白的亚基、LP组分 11S和 7S球蛋白含量相对较低而杂带较多,Nagano的 7S组分纯度明显低于 Samoto。图 1表明Nagano和 Samoto分级所得 11S组分中酸性 A和碱性B亚基比例相当,污染的 7S亚基的比例不同, Nagano的 11S组分中含有较多的α亚基。
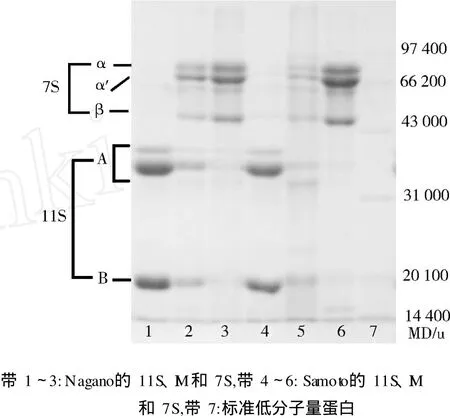
图1 Nagano和 Samoto组分的 SDS-PAGE
结合表 1数据表明,I M和LP组分储藏蛋白中均含有将近 60%的 11S亚基,LP组分中除含有 7S和11S亚基条带外还有较多杂带,其储藏蛋白所占比例低于 I M,主要是由于 I M和 LP聚集沉淀方式不同。在分离 11S后所得上清液中,Nagano法采用NaCl盐析方法沉淀 I M,而 Samoto法则通过加热和回调 pH的方法使包括LP在内更多的杂蛋白不溶。结合图 1和表 1数据,Nagano的 7S组分的纯度比 Samoto低7.9%且含有更多的α亚基,污染在这两种 7S组分中的 11S主要是酸性亚基A。
2.2 蛋白质得率及分布
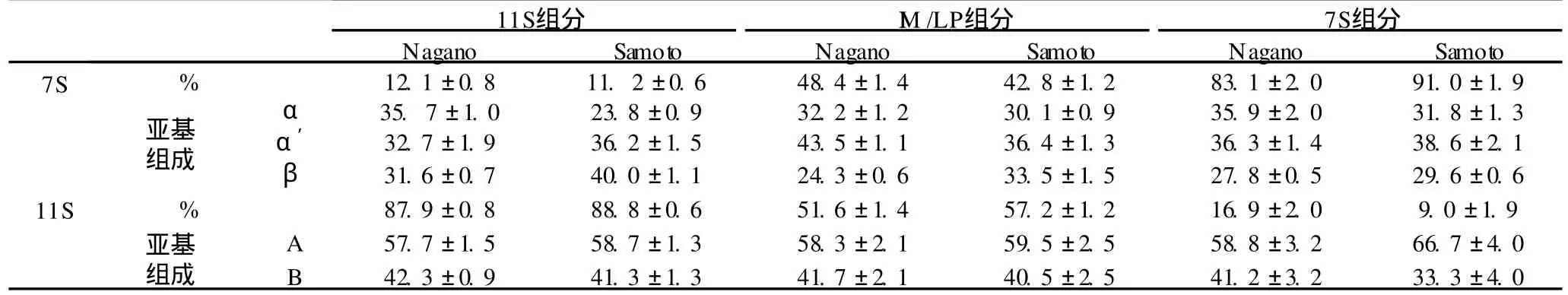
表1 Nagano和 Samoto组分的 SDS-PAGE分析数据
Samoto法有较多蛋白质富集于 LP组分,总蛋白质得率比Nagano法的低 2.14%。由于 Samoto法的脱脂豆粉经过 75℃预热处理,引起部分蛋白质结构和性质的变化,使 Samoto的总蛋白得率降低。不同方法分级的大豆蛋白经分布情况不同。蛋白质在11S和 I M/LP组分的分布率大于 7S组分,Nagano法的蛋白质在 11S组分富集最多,而 Samoto法在LP最多。图 2表明蛋白质在Nagano组分的分布较为均匀且以 11S组分蛋白质总量最高,在 Samoto组分中LP的蛋白质总量明显高于其他两种组分。以上结果表明大豆蛋白质富集方向与分级方法有关。
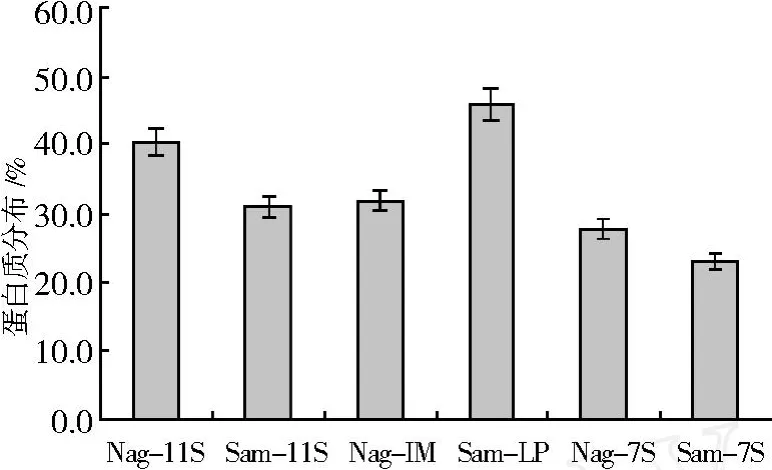
图 2 Nagano和 Samoto组分的蛋白质分布
2.3 脂分布
11S和 7S组分的脂量低于 I M或LP组分,Samo2 to法的LP组分的脂分布率明显高于其他组分。图 3以各分级方法所得脂总量为 100%,其结果显示Na2 gano法的脂类分布较 Samoto法均匀,11S和 7S组分的脂量大致相等,I M组分的脂量略高于其他两个组分;Samoto的 11S和 7S组分脂量均低于Nagano的对应组分,但LP组分脂量远远高于其他组分。说明大豆蛋白经 Nagano法分级后脂类在组分间分布较均匀,经 Samoto法分级后脂类主要集中于LP组分且与Samoto[9]测定的组分脂含量趋势相似。
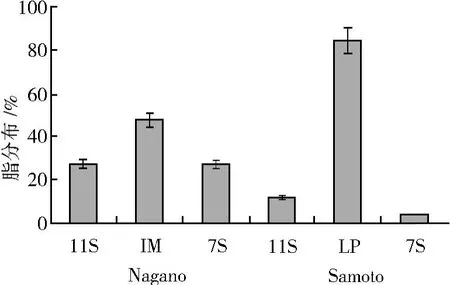
图 3 Nagano和 Samoto组分的脂分布
2.4 溶解度
Nagano和 Samoto蛋白组分的溶解度在 pH 4.5左右最低,LP组分的溶解度明显低于其他组分。如图 4和 5所示,除 Nagano的 7S组分在 pH 4.0时溶解度最低外,其他 5种蛋白组分等电点均在 pH 4.5, pH接近 3或 6~7时大部分组分的溶解度开始达到最大值。当 pH逐渐远离等电点时,11S组分中 Na2 gano的溶解度比 Samoto更早达到最大值。Samoto的LP组分在 pH 2~12的溶解度是所有组分中最低的,其对 pH不敏感且只在 pH 11以上是溶解度开始接近其他组分。联系图 2中LP组分的脂量较高,LP组分溶解性差的主要原因是蛋白质与大量脂类结合使得LP组分大多以乳状液的形式存在。Nagano的 I M组分主要是 11S和 7S球蛋白的混合物,其溶解性较高。这与 Rickert等[15]证实的 I M组分溶解度较低的结果不一致。Samoto的 7S组分溶解度高于Nagano。说明同Nagano法通过 NaCl盐析分离 I M组分相比, Samoto法在LP分离前恒温处理和回调 pH使较多不溶性或引起组分不溶的物质富集在 LP组分从而更有利于随后分离的 7S组分溶解性。
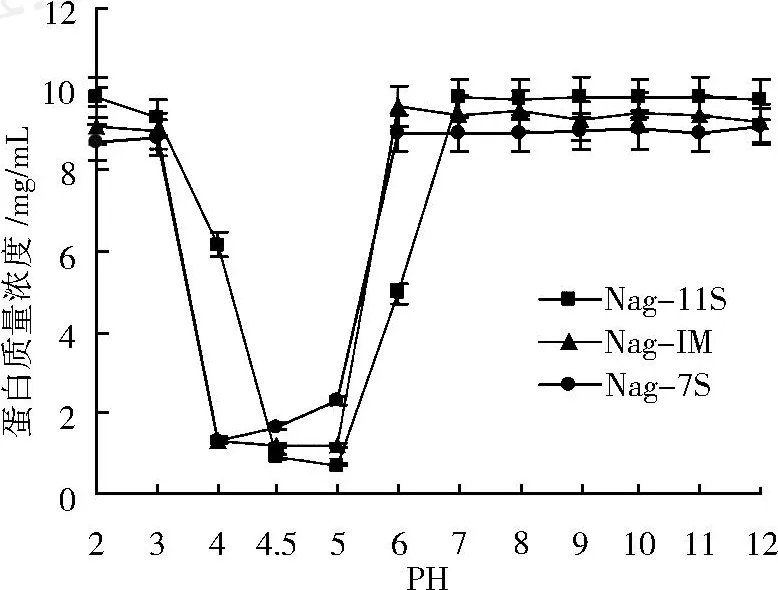
图 4 Nagano蛋白组分的溶解度曲线
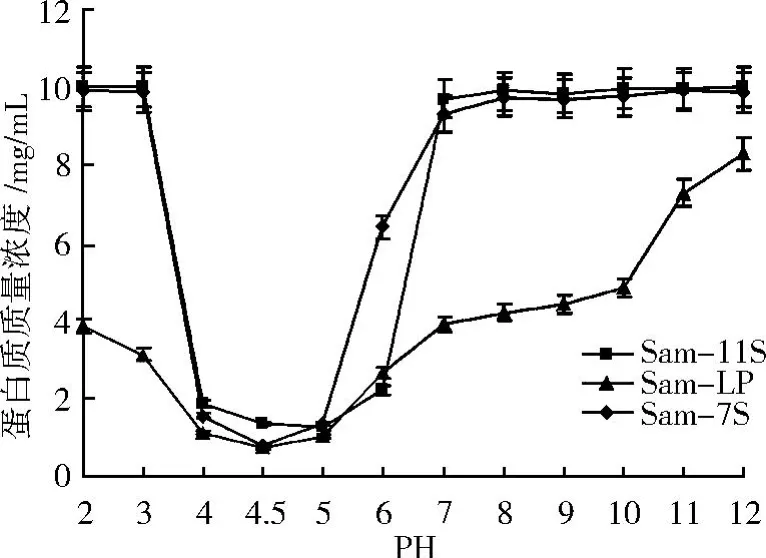
图5 Samoto蛋白组分的溶解度曲线
2.5 乳化活性
Nagano和 Samoto组分中 7S组分的乳化活性较高,Samoto的LP组分乳化活性最低。Nagano蛋白组分的乳化活性优于对应的 Samoto组分。图 6数据经分析显示 7S组分的乳化活性高于 11S和 LP组分,这与前人结果[6,8-9]一致。6种组分中以 Nagano的7S组分乳化活性最大,Samoto的 LP组分最低,I M组分的乳化活性介于 7S和11S组分之间。结合图3和5中 Samoto的LP溶解性较低、极性脂含量较高是其乳化活性较低的主要原因。
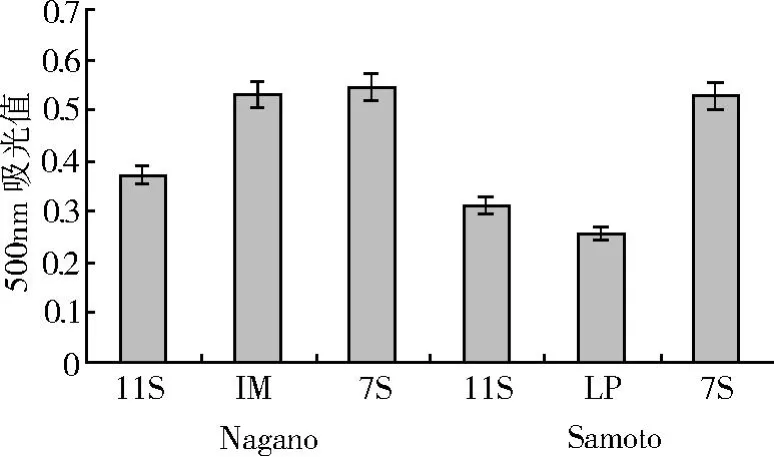
图 6 Nagano和 Samoto蛋白组分的乳化活性
3 结论
对大豆蛋白分级的两种方法,即 Nagano法和Samoto法所得 11S,I M或 LP以及 7S组分在亚基组成、蛋白质得率及组分流向、溶解性和乳化活性等物化和功能性质进行了探索和比较,研究表明两种方法的蛋白组分在不同性质上表现各有异同。SDSPAGE表明两种分级方法对应组分在 I M和 LP之间亚基差异显著。I M主要是 11S和 7S球蛋白亚基的混合物,而LP中除含有 11S和 7S球蛋白亚基外还有较多杂带。Nagano组分总蛋白得率略高于 Samoto。相对于 7S组分,两种分级方法的大豆蛋白均更多地集中于 11S和 I M/LP组分。Nagano和 Samoto法的蛋白质分别在 11S和LP组分富集。11S和 7S组分的脂量分布低于 I M或LP组分,Samoto的LP组分脂分布率明显高于其它组分。Nagano和 Samoto蛋白组分等电点在 pH 4.5左右,Samoto的LP组分由于其较高脂含量而溶解度最低且对 pH不敏感。Nagano和Samoto组分中 7S组分的乳化活性较高,Samoto的LP由于其低溶解性而使乳化活性最低。
[1]Manzoni C,DurantiM,Eberini I,et al.Subcellular locali2 zation of soybean 7S globulin in HepG2 cells and LDL recep2 tor up-regulation by its alpha’constituent subunit.J Nutr, 2003,133:2149-2155
[2]AdamsMR,Golden DL,Franke AA,et al.Dietary soy beta -conglycinin(7S globulin)inhibits atherosclerosis in mice. J Nutr,2004,134:511-516
[3]DurantiM,LovatiMR,Dani V,et al.The alpha’subunit from soybean 7S globulin lowers plas ma lipids and upregu2 lates liver beta-VLDL receptors in rats fed a hypercholester2 olemic diet.J Nutr,2004,134:1334-1339
[4]Aoyama T,Kohno M,Saito T et al.Reduction by phytatereduced soybeanβ-conglycinin of plas ma triglyceride levels of young and adult rats.Biosci Biotechnol Biochem,2001, 65:1071-1075
[5]Baba T,Ueda A,Kohno M,et al.Effects of soybean betaconglycinin on body fat ration and serum lipid levels in healthy volunteers of female university students.J Nutr Sci Vitaminol(Tokyo),2004,50:26-31
[6]Moriyama T,Kishimoto K,Nagai K,et al.Soybean betaconglycinin diet suppresses serum triglyceride levels in nor2 mal and genetically obese mice by induction of beta-oxida2 tion,downregulation of fatty acid synthase,and inhibition of triglyceride absorption.Biosci Biotechnol Biochem,2004, 68:352-359
[7]Tsuruki T,Kishi K,TakahashiM,et al.Soymetide,an im2 munostimulating peptide derived from soybeanβ-conglyci2 nin,is an f MLP agonist.FEBSLett,2003,540:206-210
[8]Nagano T,HirotsukaM,Mori H,et al.Dynamic viscoelastic study on the gelation of 7S globulin form soybeans[J].Agric Food Chem.,1992,40:941-944
[9]Samoto M,MeabuchiM,Miyazak C,et al.Abundant protein associated with lecithin in soy protein isolate[J].Food Chem.,2007,102,317-322
[10]Nagano T,Fukuda Y,Akasaka T.Dynamic viscoelastic study on the gelation properties ofβ-conglycinin-rich and glycinin-rich soybean protein isolates[J].Agric Food Chem.,1996,44:3484-3488
[11]RiblettA L,Herald T J,Schmidt KA,et al.Characteriza2 tion ofβ-conglycinin and glycinin soy protein fractions from four selected soybean genotypes.Agric Food Chem., 2001,49:4983-4989
[12]LaemmliU K.Cleavage of structural proteins during the as2 sembly of the head of bacteriophage T4[J].Nature,1970, 227:6845-6851
[13]Mujoo R,TrinhD T,Ng P KW.Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J].Food Chem.2003,82:265-273.
[14]GB 2906—1982谷物、油料作物种子粗脂肪测定方法[S]
[15]RickertD A,JohnsonL A,Murphy PA.Functionalproperties of improved glycinin andβ -conglycinin fractions[J]. Food Sci.,2004,69:303-311.
Comparative Studies on Functional Properties of Soy Protein Fractions
Qu Jiani Yang Xiaoquan
(Depar tment of Food Science and Technology,South China University of Technology,Guangzhou 510640)
Characteristics of soy protein fractions generated with Nagano procedure or Samoto procedure in sub2 unit composition,protein yield and ingredient distribution,solubility and emulsification were investigated.Results: The above characteristics differ between the fractionations from Nagano or Samoto procedure.Prominent difference in subunit composition is found between I M and LP fractionswith reference to SDS-PAGE.Totalprotein yield ofNaga2 no procedure is a little higher than Samoto procedure.More soy proteins are distributed in 11S and I M/LP fractions than in 7S fractions for both procedures.Soy proteinsmostly are distributed in 11S fraction forNagano procedure and in LP fraction for Samoto procedure.Fewer lipids are distributed in 11S and 7S fractions than in I M orLP fractions with LP richest in lipids than any other fraction.The isoelectronic points of protein fractions discussed above are pH 4.5.The solubility ofLP produced from Samoto procedure is insensitive to pH in wide range.The emulsification ac2 tivities are relatively high for both 7S-rich fractionswith emulsification stabilities for both 11S-rich fractions.The emulsification activities of 11S-and 7S-rich fractions produced from Nagano procedure are superior to 11S-and 7S-rich fractions from Samoto procedure,whereas that ofLP is inferior due to its undesirable solubility.
soy protein,fractionation,11S,7S,functional property
S207.3 文献标识码:A 文章编号:1003-0174(2010)06-0026-05
国家自然科学基金(20776050),广东省自然科学基金(7006508)
2009-07-08
曲家妮,女,1984年出生,硕士,粮食、油脂与植物蛋白工程
杨晓泉,男,1965年出生,教授,博士生导师,大豆蛋白的开发利用
