涡流色谱技术在生物样品分析中的应用
2010-10-21周建良安婧婧
刘 朋, 周建良, 安婧婧, 李 萍
(现代中药教育部重点实验室,中国药科大学生药学教研室,江苏南京210009)
涡流色谱技术在生物样品分析中的应用
刘 朋, 周建良, 安婧婧, 李 萍*
(现代中药教育部重点实验室,中国药科大学生药学教研室,江苏南京210009)
生物样品的复杂性使其在进行分析测定前必须经过处理。传统的样品前处理方法(如液-液萃取、固相萃取等)耗时长且操作繁琐。涡流色谱作为在线萃取技术,可以实现生物样品直接进样,减少了样品处理步骤,有效富集纯化了分析物,是一种高通量、高选择性的生物样品前处理方法。为此,本文介绍了涡流色谱技术的原理及优势,并总结了不同涡流柱的特点及其在生物样品分析领域中的应用情况。
涡流色谱;样品前处理;生物样品
Abstract:The complexity of biological fluids makes the sample p reparation necessary in the analytical process.The traditional techniques,such as liquid-liquid extraction and solid-phase extraction,are time-consuming and labor-intensive.Turbulent flow Chromatography(TFC),as an on-line direct injection technique,possesses the advantages of reducing sam p le p reparation steps and enabling the effective p re-concentration and clean-up of biological fluids.Therefore,it is a high-throughput and high-selectivity technique for biological sample pretreatment.In this review,the theory,advantages,characteristics and current status of TFC in bioanalysis are introduced and summarized.
Key words:turbulent flow Chromatography(TFC);sample pretreatm ent;biological samples
药物研究过程中,生物样品分析是其中的一个重要环节。生物样品尤其是血液样品分析时,最主要的问题是样品中生物大分子如蛋白质、核酸等杂质的干扰。首先,蛋白质可能会与待测物结合,影响分析物的回收率;其次,如果直接进样,生物大分子遇有机相易发生变性,变性后的大分子就会造成色谱柱堵塞及分析物在固定相上传质效率下降等不利后果,从而使柱效降低、吸附容量下降、分析柱寿命缩短,最终会严重干扰小分子分析物的准确测定[1]。另外,生物样品基质复杂,待测物含量往往很低。所有这些情况决定了分析过程中生物样品的净化和富集(样品前处理)是一个不可或缺的重要环节。
传统的生物样品前处理方法主要包括蛋白质沉淀、液-液萃取(LLE)等。这些方法的灵敏度较低,易导致杂质与分析物的共沉淀和质谱检测信号的抑制[2-6]。近些年发展起来的固相萃取(SPE)、固相微萃取(SPM E)、膜萃取(超滤、微透析)等方法虽然提高了灵敏度,但是仍然需要繁琐的样品处理过程,耗时费力,不能满足高通量分析的需要[7-9]。而涡流色谱(turbulent flow Chromatography,TFC)技术则可以在线处理生物样品,速度快、选择性好、灵敏度高,易于实现自动化,近年来在生物领域尤其是体内药物分析中得到了广泛的应用。为此,本文就涡流色谱的原理及其在生物样品前处理中的应用进行了综述。
1 原理
涡流色谱技术是利用大粒径填料使流动相在高流速下产生涡流状态,从而对生物样品进行净化与富集。这一概念早在19世纪60年代就已经提出,Pretorius等[10]指出在基于开管柱的色谱分析中,相对于一般的层流式,流动相在涡流状态下可以使分析时间明显缩短。然而这项技术并没有迅速应用至填充柱中,因为产生涡流态需要流动相具有高流速,会造成柱压太大,在实际应用中难以实现[11]。直到1997年Q uinn和Takarew ski[12]才解决了这一技术难题。他们使用了大颗粒的烷基键合硅胶柱,使得其在高流速(7.6cm/s)下也可以保持低柱压。在这样高的流速下,流动相不再是层流式而是涡流式;溶剂前沿也不再是典型的抛物型,而变成了塞型(如图1所示)。
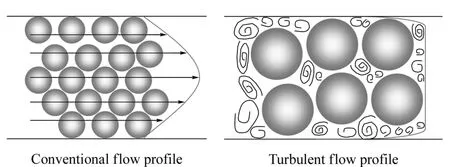
图1 不同流速下流动相的流态Fig.1 F low p rofiles of m ob ile p hase a t d iffe ren t flow ra tes
根据经典的范氏方程(Van D eem ter equation),当流速很高时,理论塔板高度会随之增大,塔板数减小,分离效率降低。但是这里并不能用范氏方程来解释,因为在涡流状态下,溶质分子传质加快,传质阻抗减小,实际的塔板高度要比范氏方程预测的低得多。虽然其流速很高,但分离效率并没有随之降低。形成这种情况主要有两方面的原因:一方面,在流动相中,溶质分子都存在浓度趋向均一的扩散,涡流状态可以增大溶质在柱内的浓度梯度变化,使分子扩散加快;另一方面,高流速下的流动相会在柱内有回流和旋转运动,从而形成旋涡,也会加快溶质分子从流动相到固定相的传质过程[13]。在这种情况下,大分子的基质成分如蛋白质等,还未能扩散进入填料颗粒内部就已被洗出柱外,而小分子的待测物则可以保留下来,与基质分离。现在常用一个无量纲的参数雷诺数(Reynolds num ber,Re)来说明这种流态。雷诺数是表征流体流动特性的一个重要参数,Re=uρd/μ,其中u是流动相的线速度,ρ是流动相密度,d是柱内径(开管柱)或柱填料颗粒粒径(填充柱),μ是流动相的黏度系数。雷诺数越大,越容易产生涡流状态。为此,涡流系统采用了大粒径(20~60μm)填料,并使流动相在高流速下运行来得到较大的雷诺数。在开管柱中,一般认为临界雷诺数为2 000,小于这个临界值为层流状态,反之为涡流状态。而在填充柱中,临界雷诺数还存有争议[13-15]。目前较一致的观点是:(1)从层流态到涡流态的过程是渐变的,存在一个过渡状态;(2)填充柱的临界雷诺数比开管柱低得多。对于填充柱中临界雷诺数的问题,还需要流体动力学方面的进一步研究。
当然,涡流色谱技术的快速分离能力是毋庸置疑的。随着该技术的发展,已经出现了各种商品化的涡流色谱柱,其性能各有差异,对不同极性的化合物具有不同的萃取能力。目前商品柱主要分为4类:反相柱、正相柱、离子交换柱、混合模式柱,详细的分类见表1。Asperger等[16]在测定水中痕量农药时比较了硅胶填料柱Turbo C18、TurboPhenyl(粒径均为50μm)和聚合物填料柱Oasis HLB(35μm)、Cyclone(50μm)的性能。结果表明,在保留能力、洗脱效率、洗脱体积等方面,聚合物填料柱都要优于硅胶填料柱,更适于对痕量化合物的富集。Sadagopan等[17]评价了Cohesive Cyclone柱和Polar Plus柱,认为可根据化合物的亲脂性质来选择富集柱的类型,这样可加快样品分析方法的建立。

表1 涡流色谱柱的主要类型Tab le1 M a in types of TFC colum ns
2 应用
涡流色谱已经发展成为一种直接进样、快速净化和分离生物样品的前处理技术,它的主要应用模式有:单柱模式、双柱模式和多柱模式。单柱模式中,涡流色谱柱直接与检测器相连,主要用于净化样品;双柱模式中,在涡流色谱柱和检测器之间添加了分析柱,涡流柱主要用于对目标成分的富集;多柱模式中,多个涡流色谱柱通过切换阀与分析柱相连,可实现不同目的的高通量样品分析。
2.1 单柱模式
该模式由单涡流色谱柱与检测器组成。在进行分析时,样品中的小分子待测物会保留在涡流柱上,生物大分子被高流速的流动相洗脱除去,然后更改流动相把保留在柱上的分析物直接洗脱至检测器中进行定性定量分析,如图2所示。单柱模式主要适用于单个化合物的分析。Ayrton等[18]运用该模式,对血清中的单一药物进行了快速、直接分析。首先以4mL/m in的水相将血清样品直接上样于涡流色谱柱中,蛋白质和其他的生物大分子被洗脱,待测物在柱中富集。随后降低流速,并提高有机相的比例,将保留于涡流柱上的化合物冲入质谱进行检测,每个样品分析时间仅需2.5m in,线性范围为5~1 000 ng/mL。Z imm er等[19]比较了涡流色谱单柱模式、SPE、LLE3种样品前处理方法,结果表明涡流色谱的样品处理效果要好于自动SPE和手工LLE,且分析时间大大缩短。但是,当单柱模式用于多个化合物同时定性定量分析时,由于其分离效率有限,难以满足高分辨、高灵敏分析的要求,此时则需要使用双柱模式。

图2 单柱模式的涡流色谱Fig.2 S ingle-co lum n m ode of tu rbu len t flow chrom a tography
2.2 双柱模式
该模式主要由单涡流色谱柱、切换阀、单分析柱以及检测器组成,涡流色谱柱主要用于纯化和富集待测物。首先,萃取用流动相将样品带入涡流柱,清除蛋白质等成分后,通过柱切换,分析用流动相将样品从涡流柱冲入分析柱进行分离,随后进入检测器进行检测,如图3所示。与单柱模式相比,其优势明显,该系统已广泛用于生物样品的在线分析。Jem al等[20]使用该模式对血清中的普伐他汀及其同分异构体进行了含量测定,通过添加分析柱,2种异构体可在2.8m in内得到很好的分离,普伐他汀的回收率为50%,其异构体回收率为90%。Herm an[21]使用涡流色谱双柱模式建立了高通量药物筛选的通用方法。该方法已经被用来筛选了1 000多种化合物,处理的生物基质包括血浆、尿液、脑匀浆、肝匀浆、肠液、脑脊液等,99%以上的分析实验符合所需的灵敏度和重现性。涡流色谱柱还可以和手性柱联用,如W u等[22]以沙丁胺醇旋光异构体为研究对象,建立了一种简单、有效、高通量分析血浆中手性药物的方法。该方法总分析时间仅8m in,线性范围为2.5~2 500nmol/L,2种异构体基本达到基线分离。Krebber等[23]利用双柱模式测定了多种食用动物的不同组织中恩氟沙星及其代谢物环丙沙星的残余量,目标物的回收率为72%~105%,这也是涡流色谱技术首次用于多种动物组织的分析。Jem al等[24]比较了涡流色谱双柱模式与液-液萃取法,处理100个样品,前者的处理时间仅为后者的1/4。

图3 双柱模式的涡流色谱Fig.3 Coup led-co lum n m ode of tu rbu len t flow chrom a tography
2.3 多柱模式
该模式使用多个涡流色谱柱对样品进行纯化和富集。在应用过程中,涡流柱一般采取并联方式,具体过程如图4所示。涡流柱A首先进样洗脱,当柱A与分析柱、检测器相连对待测物进行分析时,涡流柱B用适当溶剂清洗及平衡。柱A的在线测定过程结束时,柱B开始进样,从而缩短进样循环时间,增大样品分析通量。Hsieh等[25]使用双涡流柱并联-单分析柱-质谱联用系统,对血清中的GW572016(专利药)进行了定量分析,进样循环时间仅需0.8 m in;通过进一步增加切换阀和分析柱,进样循环时间可减少到0.4m in。此方法适用于药物的高通量体内过程评价研究。O ng等[26]比较了双柱模式和多柱模式,结果发现,采用双柱模式,单次分析时间需要4m in;而采用双涡流柱并联模式,完成一次分析仅需2.08m in,分析速度提高了近1倍。但是,多柱模式残留较高,达到0.24%;双柱模式残留则相对较低,小于0.04%。B ayliss等[27]使用4根涡流色谱柱和4通道多喷雾器质谱仪并行分析,组成了高通量分析系统。不同于上面提到的并联阀切换系统,该系统对4根涡流柱同时进样分析,每小时可处理120个样品,定量限达5ng/mL。M allet等[28]对涡流色谱的多种使用模式进行了比较,待测物为酸性药物二氟尼柳和碱性药物氯马斯汀,基质为大鼠血浆,结果表明,双柱模式比单柱模式的质谱峰更加尖锐,峰形好,信噪比高。多柱并联模式和双柱模式在峰形上没有明显差别,但分析时间短,适用于大量样品的分析。然而多柱模式使用了多个切换阀和色谱柱,比起单柱模式易产生交叉污染,不过只要阀切换时间合适,就可以把污染降到最低。
涡流色谱技术最大的特点是富集小分子化合物的同时除去生物大分子化合物,作者所在实验室根据这一特点,设计了双涡流柱串联模式用于筛选靶蛋白结合成分,并已成功用于中药复杂体系中活性成分群的筛选,其流程如图5所示[29]。该系统的主要创新在于TFC技术的正反结合使用:涡流柱A的使用方式与一般情况相反,它将未能与靶蛋白结合的小分子杂质保留下来,靶蛋白与配体结合的复合物则被纯化收集、洗脱至解离线圈并在线解离,使活性配体从靶蛋白上游离出来,然后进入涡流柱B(如图5中的上图所示)。涡流柱B的使用方式则与一般情况相同,解离后游离配体被富集在TFC柱的前端,而靶蛋白质则被洗脱至废液,保留的配体进入LC-MS进行定性定量分析(如图5中的下图所示)。该模式为涡流色谱柱的使用开辟了新的方向。
目前,上述提及的3种涡流色谱分析模式已广泛用于生物样品的分析,表2总结了3种模式在不同生物基质中的应用,包括对血浆[30-36]、血清[25,37]、尿液[38,40,41]以及其他生物基质(脑浆[26]、透析液[41]、组织[23]等)的分析。

图4 并联多柱模式的涡流色谱Fig.4 Parallel configuration of multi-dimensional column mode of turbulent flow chromatography
3 现存问题与发展趋势
与传统的萃取技术相比,涡流色谱技术与液相色谱、质谱在线联用可对复杂的生物样品直接进样测定,而不受样品中蛋白质等大分子物质的干扰,分析速度快、效率高、灵敏度和选择性好。目前,该技术已经在生物分析中得到了广泛的应用。
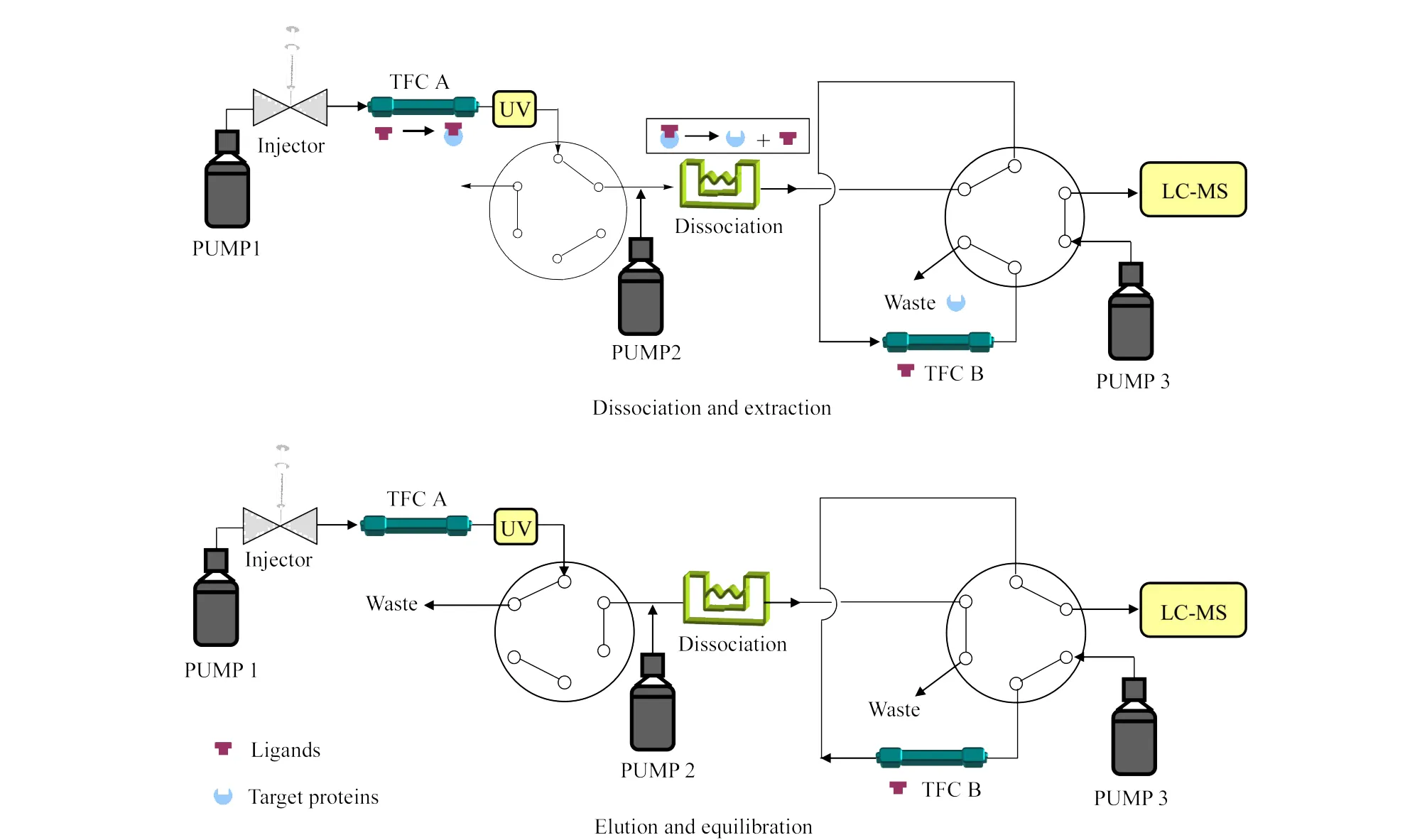
图5 串联多柱模式的涡流色谱Fig.5 Tandem configuration of multi-dimensional-column mode of turbulent flowchroma to graphy
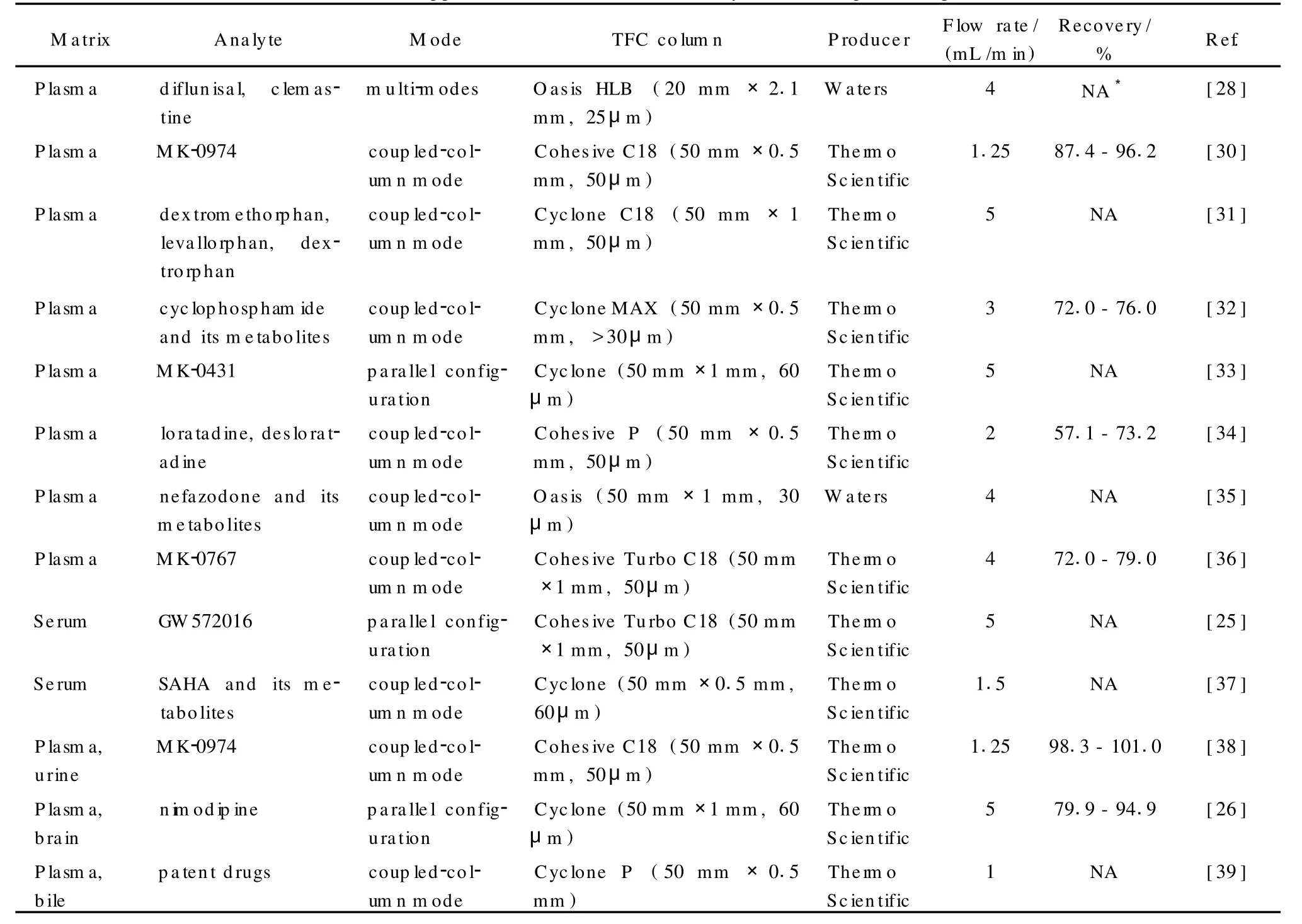
表2 涡流色谱在生物样品分析中的应用Table2 Applications of TFC in the analysis of biological samples
不过由于是直接进样,污染物残留就成为一个不可避免的问题。自动进样器、色谱柱、切换阀等都可能会有残留物,其中40%的污染来源于自动进样器。因此在进样时应注意定量环的量程,避免满量程进样,进样结束后需仔细清洗进样针和定量环[46]。而涡流柱的污染问题可采取反冲方式清洗残余蛋白质、洗脱结束后用多种溶剂冲洗涡流柱等手段来加以解决[47]。G rant等[48]针对残留问题使用了新型切换阀材料(PAEK)并改装了自动进样器,提高了除残留效率,缩短了整体分析时间。涡流色谱技术的另一个缺点是柱寿命较短。Mallet等[28]使用涡流柱进样200次(每次进样量200μL)后,色谱峰发生变形,分离效率降低。这是由于生物样品中的污染物在涡流柱中积累已达到饱和,堵塞了填料孔,使柱压升高,分离效率下降。Zeng等[49]设计了新的清洗方法来延长涡流柱寿命。他们使用高浓度(15%)乙酸水溶液上样来洗脱血浆样品中的蛋白质,90%四氢呋喃溶液清洗涡流柱和分析柱以除去柱中残留的脂质;进样2 000次后,测定结果未发生显著变化。
随着技术的发展,涡流色谱的应用也趋于多样化。Fairhurst等[50]将涡流技术用于分子印迹色谱,然而在高流速下,印迹微球聚合物和非印迹微球聚合物在分离普萘洛尔异构体时没有显著的差异。不过微球型聚合物仍然表现出了较好的应用前景,在涡流条件下,该聚合物可以有效萃取血浆中的普萘洛尔,同传统的C18色谱柱相比,基线更平稳且无杂峰干扰。Zeng等[51]将涡流柱和整体柱联用,涡流柱纯化,整体柱分析,测定了血浆中的芬氟拉明、替马西泮、奥沙西泮、它莫西芬等碱性药物。由于涡流柱和整体柱都可以采用高流速,单个样品分析过程仅用1.2m in,连续10h分析样品407份,系统柱压升高不到30%。在限进填料(RAM)中,涡流技术也得到了应用[52,53]。限进填料外表面涂覆亲水性基团,利用体积排阻原理,使蛋白质等大分子不被保留排入废液;内表面键合各种反相基团,可以吸附小分子分析物,但限进填料柱一般只采用常规流速。Vintiloiu等[52]制备了限进色谱柱(ADS,50mm×0.76mm,40~63μm),并使其在5mL/m in的高流速下达到涡流状态,从而大大缩短了分析时间,并具有良好的线性、重现性和回收率。由于限进填料表面的生物相容性,阻止了蛋白质和固定相中疏水基团的结合,使萃取柱寿命延长。另外,微涡流柱的出现也弥补了普通涡流柱寿命短的缺陷。这种色谱柱内径更窄,一般为0.5mm,因此可以在低流速下达到涡流状态。微涡流柱还可以降低溶剂消耗量,提高质谱灵敏度,减少残留[54]。Chassaing等[47]使用微涡流柱进样1 000次后,柱压未升高且污染残留影响不明显。

表2 (续)Table2 (Con tinued)
4 展望
综观国外发表的有关涡流色谱技术的论文,虽然已取得了很大的进展,但是涡流色谱应用的样品基质绝大部分局限在生物体液方面,尤其是血液样品,分析物又多为化学药物,其应用领域有待于进一步发掘。近几年在应用基质方面已经有所扩展,有文献报道应用涡流色谱对蜂蜜[55]和河水[16,56]中的化合物进行测定,但在分析物方面还没有进一步拓宽的报道。当前中药受到了越来越多的关注,为了阐明中药的效应物质基础和作用机制,中药药理学、中药药动学的研究快速发展起来。然而由于中药的复杂性,样品的前处理过程难度较大,对中药成分中活性化合物的确定和筛选亦十分困难。在国家自然科学基金等项目的资助下,作者所在课题组正在尝试将涡流色谱技术应用于中药分析,旨在提高分析效率。相信随着研究工作的不断深入,涡流色谱技术的不断发展,其在分析领域必将发挥出更大的潜力。
[1] Hagestam I H,Pinkerton T C.Anal Chem,1985,57(8):1757
[2] Bonfiglio R,King R C,O lah T V,et al.Rap id Comm un mass Spectrom,1999,13(12):1175
[3] Xu R N,Fan L,Rieser M J,et al.J Pharm B iom ed Anal,2007,44(2):342
[4] Gordien J B,Pigneux A,Vigouroux S,et al.J Pharm B iom ed Anal,2009,50(5):932
[5] Cham bers E,Wagrow ski-D iehlD M,Lu Z,et al.J Chromatogr B,2007,852(1/2):22
[6] Polson C,Sarkar P,Incledon B,et al.J Chromatogr B,2003,785(2):263
[7] Ridgw ay K,Lalljie S P D,Sm ith R M.J Chromatogr A,2007,1153(1/2):36
[8] W ille S M R,Lam bert W E E.Anal B ioanal Chem,2007,388(7):1381
[9] Zhou S N,Ouyang G,Paw liszyn J.J Chromatogr A,2008,1196/1197(4):46
[10] Pretorius V,Sm uts T W.Anal Chem,1966,38(2):274
[11] M artin M,Guichon G.Anal Chem,1982,54(9):1533
[12] Quinn H M,Takarew ski J J.International Patent,WO97/16724.[1997-05-1]
[13] W ilson ID.B ioanalytical Separations//Sm ith R.Handbook of Analytical Separations.Am sterdam:Elsevier,2003:91
[14] Knox J H.Anal Chem,1966,38(2):253
[15] Hlushkou D,Tallarek U.J Chromatogr A,2006,1126(1/2):70
[16] Asperger A,Efer J,Koal T,et al.J Chromatogr A,2002,960(1/2):109
[17] Sadagopan N,Pabst B,Cohen L.J Chromatogr B,2005,820(1):59
[18] Ayrton J,Dear G J,Leavens W J,et al.Rap id Comm un mass Spectrom,1997,11(18):1953
[19] Zimm er D,Pickard V,Czem borW,et al.J Chromatogr A,1999,854(1/2):23
[20] Jem al M,Xia Y Q,Whigan D B.Rap id Comm un Mass Spectrom,1998,12(19):1389
[21] Herm an J L.Rap id Comm un mass Spectrom,2002,16(5):421
[22] W u S T,Xing J,Apedo A,et al.Rap id Comm un Mass Spectrom,2004,18(21):2531
[23] Krebber R,Hoffend F J,Ruttm ann F.Anal Chim Acta,2009,637(1/2):208
[24] Jem alM,Huang M,J iang X,et al.Rap id Comm un Mass Spectrom,1999,13(21):2125
[25] Hsieh S,Tobien T,Koch K,et al.Rap id Comm un Mass Spectrom,2004,18(3):285
[26] Ong V S,Cook K L,Kosara C M,et al.Int J Mass Spectrom,2004,238(2):139
[27] Bayliss M K,Little D,M allett D N,et al.Rap id Comm un mass Spectrom,2000,14(21):2039
[28] M allet C R,M azzeo J R,Neue U.Rap id Comm un Mass Spectrom,2001,15(13):1075
[29] Zhou J L,An J J,Li P,et al.J Chromatogr A,2009,1216(12):2394
[30] Xu Y,W illson K J,Anderson M D G.J Chromatogr B,2009,877(16/17):1634
[31] Zhou S,Zhou H,Larson M,et al.Rap id Comm un Mass Spectrom,2005,19(15):2144
[32] Bai F,Fraga C H,Tagen M,et al.J Chromatogr B,2009,877(18/19):1709
[33] Xia YQ,Whigan D B,Pow ellM L,et al.Rap id Comm un mass Spectrom,2000,14(2):105
[34] Srinubabu G,Patel R S,Shedbalkar V P,et al.J Chromatogr B,2007,860(2):202
[35] M ao Y,HuangM Q,Xia YQ.J Pharm B iom ed Anal,2007,43(5):1808
[36] Xu X,Yan K X,Song H,et al.J Chromatogr B,2005,814(1):29
[37] Du L,M usson D G,Wang A Q.Rap id Comm un mass Spectrom,2005,19(13):1779
[38] Xu Y,W illson K J,M usson D G.J Chromatogr B,2008,863(1):64
[39] Herm an J L.Rap id Comm un mass Spectrom,2005,19(5):696
[40] Cohesive Technologies Inc.A Turbulent Flow Chromatography App licationin D rugsof Abuse:Amphetam ines.LCGC North Am erica Supp l,2005,Vol84.(2005-12-02).http://Chromatographyonline.findanalytichem.com/lcgc/App+Notes+Pharm a/A-Turbulent-Flow-Chromatography-Application-in-D ru/Article Standard/Article/detail/211498
[41] Zeng W,M usson D G,Fisher A L,et al.J Pharm Biomed Anal,2008,46(3):534
[42] Sm alley J,Marino A M,Xin B,et al.J Chromatogr B,2007,854(1/2):260
[43] Lavén M,Markides K,L。angstr¨om B.J Chromatogr B,2004,806(2):119
[44] Smalley J,Kadiyala P,Xin B,et al.J Chromatogr B,2006,830(2):270
[45] Liesener A,Karst U.J Sep Sci,2005,28(14):1658
[46] Chassaing C,Luckw ell J,MacraeP,et al.Chromatographia,2001,53(3/4):122
[47] Chassaing C,Stafford H,Luckw ell J,et al.Chromatographia,2005,62(1/2):17
[48] Grant R P,Cam eron C,ShelleyM M.Rap id Comm un Mass Spectrom,2002,16(18):1785
[49] Zeng W,Fisher A L,M usson D G,et al.J Chromatogr B,2004,806(2):177
[50] Fairhurst R E,Chassaing C,Venn R F,et al.B iosens B ioelectron,2004,20(6):1098
[51] Zeng H,Deng Y,Wu J T.J Chromatogr B,2003,788(2):331
[52] Vintiloiu A,M ullettW M,Papp R,et al.J Chromatogr A,2005,1082(2):150
[53] Sch¨afer C,Lubda D.J Chromatogr A,2001,909(1):73
[54] Turnpenny P,Fraier D,Chassaing C,et al.J Chromatogr B,2007,856(1/2):131
[55] M ottier P,Hamm el Y A,Grem aud E,et al.J Agric Food Chem,2008,56(1):35
[56] Takino M,Daishim a S,Nakahara T.Rap id Comm un Mass Spectrom,2003,17(5):383
Application of turbulent flow chromatography in the analysis of biological samples
LIU Peng,ZHOU Jianliang,AN Jingjing,LI Ping*
(Key Laboratory of Modern Chinese Medicines,Ministry of Education,Department of Pharmacognosy,China Pharmaceutical University,Nan jing 210009,China)
O658
A
1000-8713(2010)02-0168-07
*通讯联系人:李 萍,教授,研究方向为生药活性成分与质量评价.Tel:(025)85391244,E-m ail:lip ing2004@126.com.
“十一五”国家“重大新药创制”科技重大专项(No.2009ZX09502-020)和中国药科大学研究生创新计划项目(No.02704006-522).
2009-08-28
DO I:10.3724/SP.J.1123.2010.00168
